Vous êtes ici
Mécanobiologie : la pression créatrice
Après une coupure ou une égratignure, l’intégrité de la peau est rompue et notre organisme doit mettre en branle toute une batterie de processus pour amorcer la cicatrisation. Pour ce faire, des cellules doivent migrer, se faufiler, se toucher, proliférer, jusqu’à combler les endroits où la peau fait défaut. Ces mouvements cellulaires impliquent l’intervention de processus mécaniques essentiels. Restés un temps dans l’ombre des millions de réactions chimiques qui font tourner la grande machinerie de notre organisme, ces phénomènes mécaniques jouent pourtant un rôle essentiel dans le monde du vivant. Leur étude, la mécanobiologie, bénéficie aujourd’hui de nombreuses avancées technologiques, notamment en microscopie.
« Quand les chercheurs ont commencé à faire de l’imagerie cellulaire et de l’embryologie au début du XXe siècle, ils pensaient déjà que la géométrie et la mécanique jouaient un rôle important dans la physiologie, la division et la migration des cellules, explique Nicolas Minc, directeur de recherche au CNRS, à l’Institut Jacques Monod1. Mais avec la découverte de l’ADN en 1953 et la popularisation des approches génétiques, ces idées ont été mises de côté pendant plusieurs décennies. Il faudra attendre la fin des années 1990, et de multiples avancées dans le domaine de la microscopie, pour que les signaux mécaniques perçus par les cellules soient à nouveau pris en compte. »
De la division à la migration
En effet, toujours plus précis, les microscopes ont évolué pour désormais « voir » au sein d’un tissu sur plusieurs micromètres d’épaisseur. Certains, comme les microscopes à force atomique (AFM), peuvent même mesurer, grâce à des sondes, la rigidité de la membrane d’une cellule ou de l’un de ses constituants. La microscopie des forces de traction (TFM) évalue quant à elle les forces qu’exerce une cellule, lorsqu’elle se déplace, sur son environnement immédiat. Tous ces outils ont permis d’étudier les mouvements et les forces jusqu’à l’intérieur des cellules, révélant que ces dernières parviennent, contre toute attente, à détecter des signaux mécaniques, mais aussi à en émettre. C’est donc tout un pan du fonctionnement du vivant qui reste à explorer.


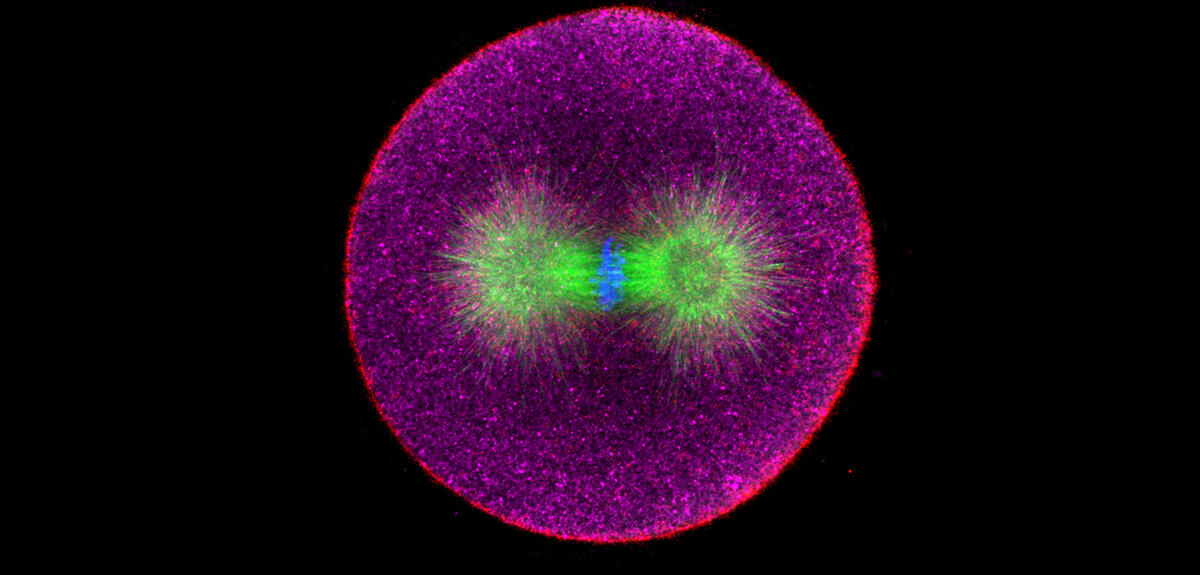
Depuis une dizaine d’années, Nicolas Minc étudie l’impact des forces mécaniques sur la géométrie et la division des cellules embryonnaires chez l’oursin, un animal qui présente l’avantage de produire des gamètes, les cellules reproductrices mâles ou femelles, en grande quantité. Comme toutes les cellules eucaryotes, c’est-à-dire qui possèdent un noyau, celles des embryons d’oursins possèdent de nombreuses fibres, les microtubules, qui s’assemblent en un réseau en forme de fuseau : le fuseau mitotique. C’est grâce à la mise en place de ce réseau que le matériel génétique est réparti équitablement entre cellule mère et cellule fille. Nicolas Minc et son équipe ont développé un système original où ils attachent de minuscules billes magnétiques aux fuseaux mitotiques, afin de contrôler leur position dans les cellules et de mesurer les forces en jeu.
« Nous savions que les fibres exerçaient des forces au sein de la cellule, mais sans connaître leur valeur, explique Nicolas Minc. Grâce à notre invention, nous avons pu pour la première fois mesurer cette force. Ces chiffres ont ensuite servi à construire des modèles de génération de forces à l’échelle de centaines de milliers de microtubules. » Ce système breveté permet en effet différentes explorations en mécanobiologie, comme celle de la mécanotransduction, le phénomène selon lequel les cellules, notamment grâce à des récepteurs présents à leur surface, détectent les forces et contraintes mécaniques extérieures, pour éventuellement les traduire en signaux biochimiques et génétiques. Ces forces peuvent aussi bien provenir de l’environnement que des cellules à proximité.
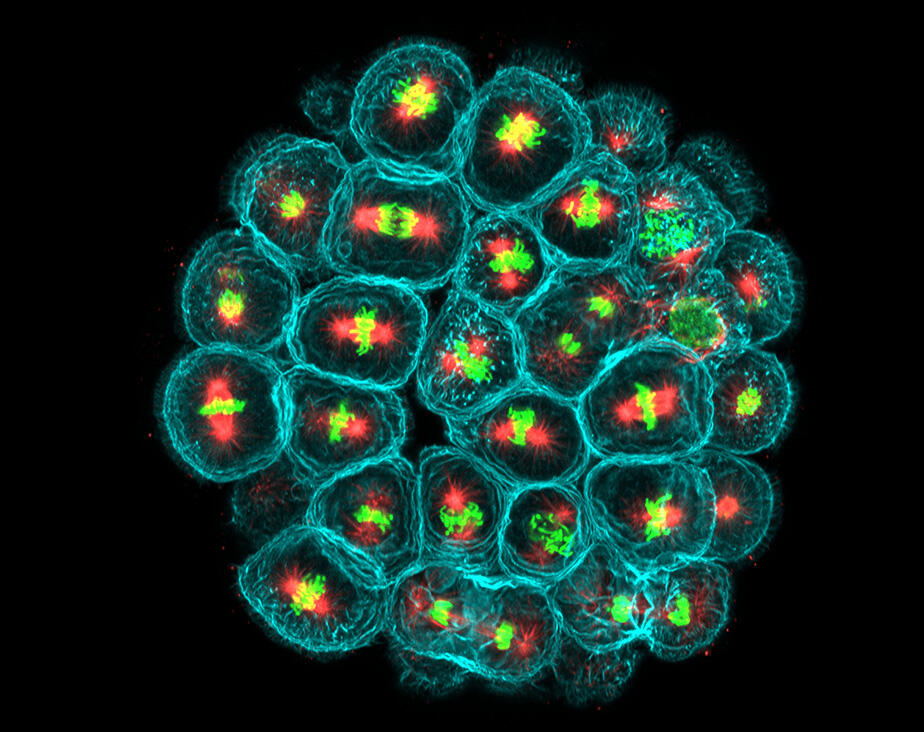
« Cela permet de transmettre des messages de manière linéaire, détaille le chercheur. Ces cascades de signaux guident par exemple la migration cellulaire et d’autres comportements collectifs. » Les scientifiques de l’Institut Jacques Monod appliquent également leur système magnétique à l’étude des organoïdes, des organes artificiels miniatures développés pour l’étude in vitro de différentes pathologies. Ces travaux permettent par exemple de mieux comprendre comment les cancers intestinaux affectent la division et la migration cellulaire.
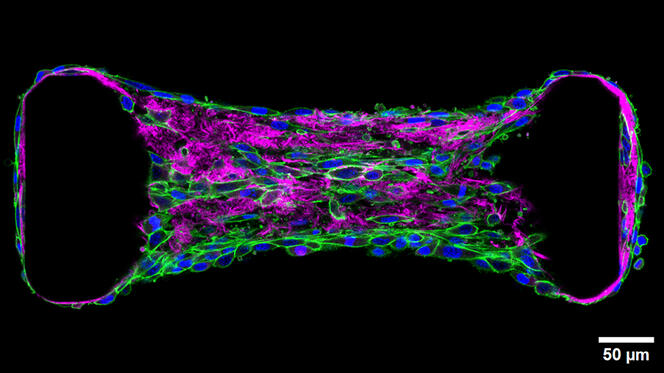
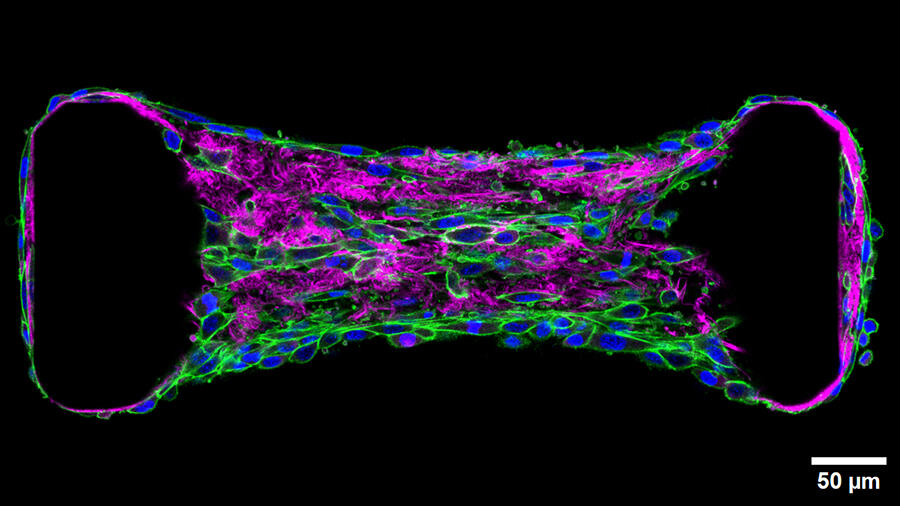
Une migration qui se déroule notamment dans, sur et à travers la matrice extracellulaire (MEC), un échafaudage de macromolécules principalement constitué de collagène synthétisé et structuré par des cellules spécialisées, les fibroblastes. Siège de nombreuses allées et venues cellulaires, la MEC fait l’objet d’une attention particulière de la part de chercheurs comme Thomas Boudou, du Laboratoire interdisciplinaire de physique2 (LIPhy) qui explore la mécanobiologie des tissus. « Ces cellules exercent en continu des forces sur leur environnement et sur leurs voisines, explique-t-il. On peut voir la matrice extracellulaire comme une toile d’araignée, laissant les signaux mécaniques se propager le long de ses fibres. Ces informations peuvent pousser des cellules à migrer ou à se différencier. »
Pour étudier les forces mécaniques impliquées dans la migration ou la différenciation des cellules, le chercheur utilise l’optogénétique : une méthode qui permet, après modification génétique, d’activer une protéine spécifique grâce à la lumière. Telle une cascade, cette activation découle en une autre qui, à terme, induit un processus biologique d’intérêt. Thomas Boudou transforme ainsi des cellules en véritables actionneurs, qu’il contracte à volonté pour regarder comment ces mouvements influencent le tissu et jusqu’où le signal peut se propager. « Notre approche est basée sur une réponse physiologique, précise le chercheur. Comme ce sont bien des cellules qui tirent, le signal reste dans les clous de la réalité physiologique. »
Ces travaux ont notamment porté sur la fibrose, un durcissement et une perte d’élasticité d’un tissu, le plus souvent à la suite d’une lésion ou d’une inflammation. Lors de cette modification du tissu, les fibroblastes sont en quelque sorte réactivés et produisent un excès de collagène. Or cette réactivation pousse les cellules à tirer davantage sur leur environnement, un signal qui induit l’activation de leurs voisines directes, engendrant un cercle vicieux et propageant la fibrose dans l’ensemble du tissu.
Des forces mécaniques précurseurs
La manière dont les cellules tirent et s’influencent est également au cœur des travaux de Jean-Léon Maître. Directeur de recherche au CNRS, à l’unité Génétique et biologie du développement3, il étudie le développement des embryons de mammifères, principalement chez l’humain et la souris. « Si la chimie des cellules est importante, les changements de forme de l’embryon viennent principalement de forces mécaniques, explique-t-il. Ces stimuli peuvent d’ailleurs être transformés en réponse chimique, qui va ensuite induire l’expression des gènes. »
Jean-Léon Maître utilise des marqueurs fluorescents pour observer l’adhérence des cellules entre elles, ainsi que la manière dont elles tirent grâce à des protéines qui contractent la surface des cellules. Le chercheur emploie également des micropipettes pour mesurer la force requise pour déformer la surface des cellules, ainsi que des pinces optiques, guidées par des lasers, pour explorer la mécanique de l’intérieur des cellules.
« Nous constatons que pendant le développement d’un embryon de mammifère, les forces et les cellules impliquées changent au cours du temps, détaille le chercheur. Les cellules qui tirent le plus fort se retrouvent à l’intérieur de l’embryon. Quand celui-ci ne comporte que seize cellules, c’est leur position qui définit lesquelles restent dans l’embryon et lesquelles vont former le placenta. On a longtemps étudié cette séparation en s’intéressant à des critères chimiques, mais ce sont bien les forces mécaniques qui agissent en amont des changements d’expression des gènes. »
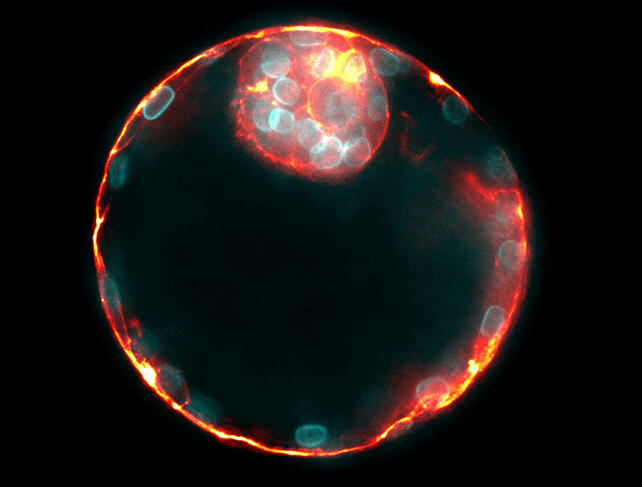

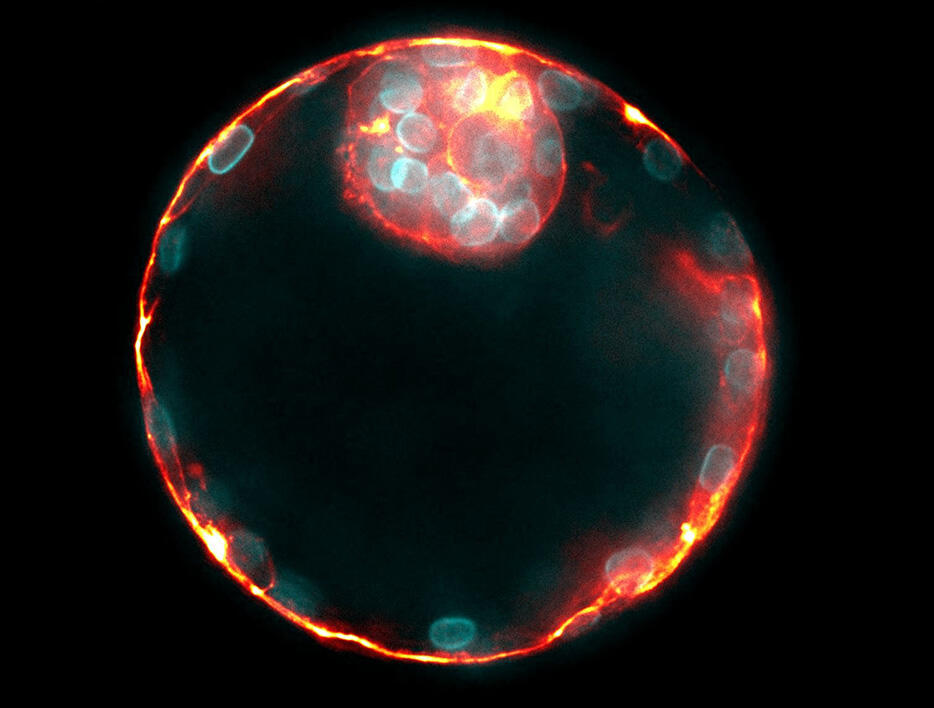
Ces forces de traction commencent, au sein de l’embryon, dès le stade huit cellules, soit quelques heures seulement après la fécondation. Après une division asymétrique, les cellules filles les plus fortes parviennent à se hisser vers l’intérieur de la masse cellulaire, garantissant ainsi leur participation à l’embryon plutôt qu’au placenta. L’embryogenèse se poursuit avec la formation d’une poche d’eau au sein de l’embryon, le lumen, où les forces hydrostatiques fracturent les points de contact entre les cellules, permettant au fluide de s’accumuler là où les cellules adhèrent le moins les unes aux autres. Les contractions autour de la cavité font également déplacer le lumen, comme l’air au sein d’un ballon de baudruche à moitié dégonflé. « En modifiant l’adhésion et la contractilité des cellules, on peut contrôler où l’embryon va s’attacher, souligne Jean-Léon Maître. Ces découvertes pourraient trouver des applications dans l’aide à la fertilité. »
Une nouvelle approche : la théramécanique
Au niveau des pistes thérapeutiques issues de la mécanobiologie, Yves Rémond regarde loin vers l’avenir. Ce professeur émérite à l’université de Strasbourg et à l’École européenne de chimie, polymères et matériaux, membre du laboratoire ICube4, a consacré sa carrière à l’étude des propriétés mécaniques de matériaux composites et polymères, auxquels il a progressivement ajouté des matériaux biologiques. « Les principes physiques et mécaniques restent les mêmes selon que le matériau soit inerte ou vivant », note-t-il. Avec Rachele Allena, maîtresse de conférences à l’université Côte d’Azur et membre du Laboratoire Jean-Alexandre Dieudonné5, Yves Rémond a développé le concept de théramécanique : des thérapies pensées autour de l’évolution des propriétés mécaniques des cellules, tissus, os et organes.
« Les cellules cancéreuses se répandent notamment grâce à deux grandes actions nocives d’ordre mécanique, détaille Yves Rémond. Elles forment des métastases en se déplaçant, selon une vitesse et une direction qui changent en fonction de la rigidité des surfaces biologiques, comme les tissus, qu’elles rencontrent. Et en passant d’un tissu à un autre, les cellules cancéreuses doivent se frayer un chemin dans des milieux très confinés, et doivent donc fortement se déformer. »
C’est sur cette dernière contrainte qu’Yves Rémond pense que la recherche peut faire la différence. Car qui dit milieu confiné et complexe, dit aussi contorsion extrême pour les cellules. Selon le chercheur, si l’on parvenait à « rigidifier les noyaux de ces cellules, alors on pourrait les empêcher de progresser », et par conséquent limiter leur propension à métastaser.
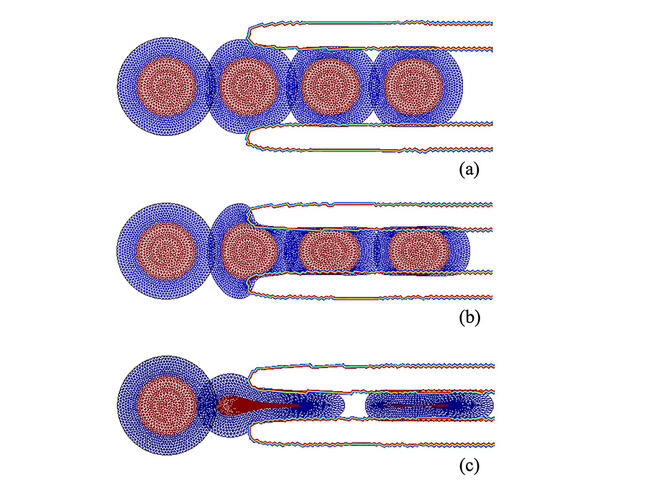

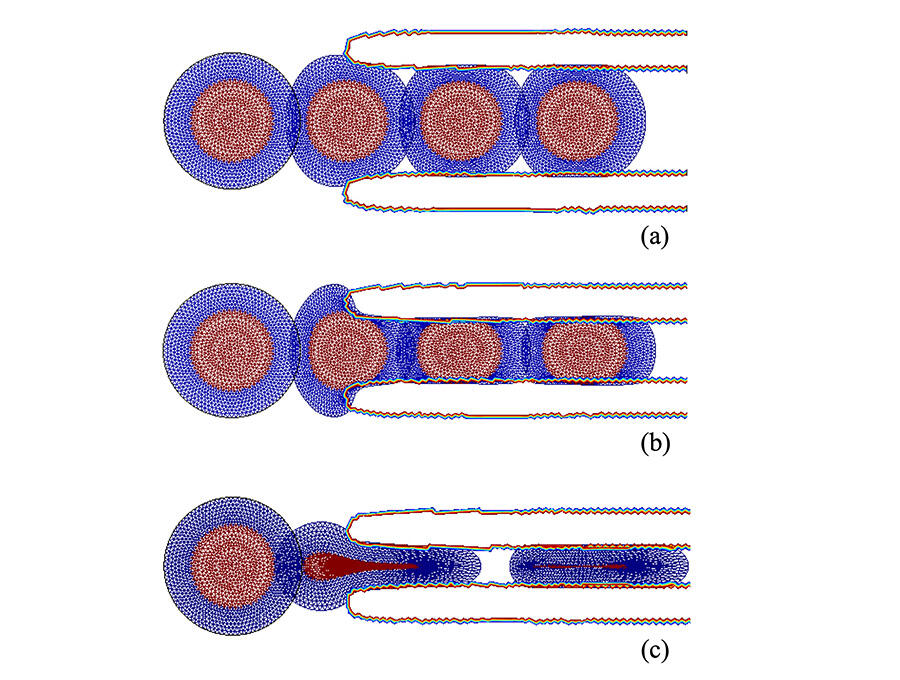
Yves Rémond estime aussi que les propriétés mécaniques devraient être incluses dans les travaux sur les jumeaux numériques biologiques. Ces modèles d’organes, réalisés pour chaque patient, sont au cœur du développement de la médecine personnalisée. Ils pourraient permettre de mieux prendre en compte l’histoire, l’âge et les spécificités des malades. Ces différentes pistes sont encore loin du stade des essais cliniques, mais la mécanobiologie en pose déjà les bases. « La mécanobiologie est pour l’instant surtout étudiée in vitro, elle doit développer les approches in vivo, conclut Jean-Léon Maître. Nous manquons encore d’outils bien adaptés, mais, tout comme la biochimie a révolutionné la biologie, notre discipline va bénéficier de l’émergence de chercheurs et de chercheuses formés en tant que biophysiciens purs et durs. » ♦
À lire sur notre site
Mécanobiologie : les cellules sous pression
Mots-clés
Partager cet article
Auteur
Diplômé de l’École supérieure de journalisme de Lille, Martin Koppe a notamment travaillé pour les Dossiers d’archéologie, Science et Vie Junior et La Recherche, ainsi que pour le site Maxisciences.com. Il est également diplômé en histoire de l’art, en archéométrie et en épistémologie.










Commentaires
Connectez-vous, rejoignez la communauté
du journal CNRS