Eau de Javel et cathéters : les nouveaux inséparables
A la une

L’eau de Javel est connue pour ses vertus anti-microbiennes. Afin de lutter contre les infections dans les établissements de soins, des chercheurs du CNRS, en collaboration avec l’Établissement français du sang [3] (EFS), ont développé une façon de produire en continu le composé chimique de l’eau de Javel à la surface de cathéters urinaires.
Les infections par les cathéters urinaires représentent 30 % des infections nosocomiales, infections qui sont contractées pendant un séjour dans un établissement de santé. « Aujourd’hui, il existe des cathéters recouverts d’antibiotiques mais ça ne marche pas toujours, il existe des résistances », explique Claire Stines-Chaumeil, enseignante-chercheuse dans l’équipe BIO2.0 du Centre de recherche Paul Pascal [4]1 (CRPP).
Dans le but de trouver cette alternative aux antibiotiques, son équipe se lie à l’équipe Colloïdes, interfaces, assemblages (CIA) pour imaginer la formulation de nouveaux matériaux aux propriétés microbicides. Depuis 2017, ces deux équipes CNRS portent le projet MicrobicidalEnzyme [5] basé sur l’activité de l’enzyme myéloperoxydase (MPO), avec la participation de l’EFS de Nouvelle-Aquitaine et le soutien de l’Agence nationale de la recherche.
Une des protagonistes de l’immunité innée
La myéloperoxydase (MPO), c’est ce qui donne l’aspect jaunâtre à notre peau lorsqu’on se blesse. Son action anti-microbienne est due à son pouvoir de convertir le peroxyde d’hydrogène (H2O2), substrat de la réaction, en acide hypochlorique (HClO), produit de la réaction et plus communément appelé eau de Javel.
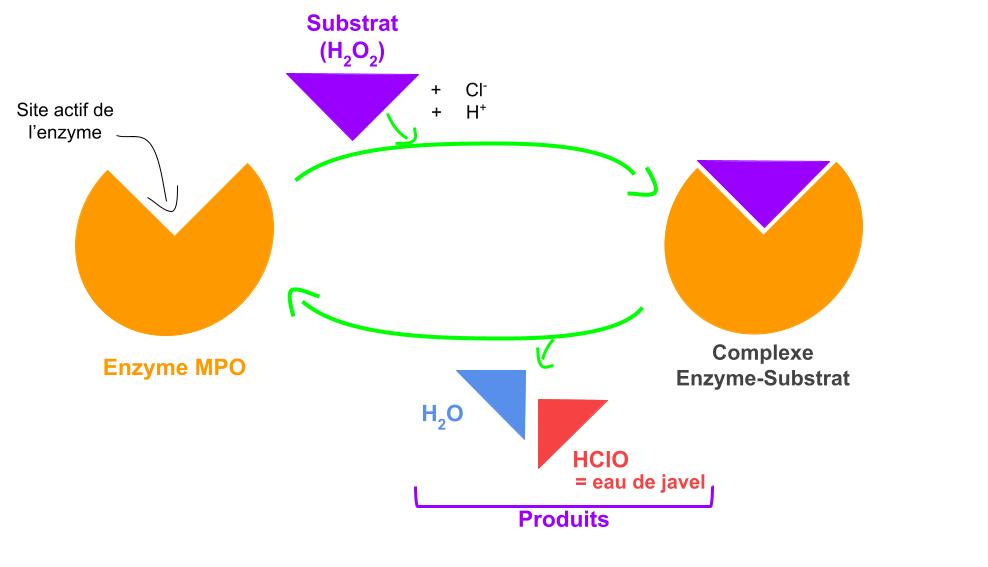 Figure 1. Schéma simplifié du fonctionnement de l’enzyme myéloperoxydase (MPO). Le substrat, ce dont l’enzyme a besoin pour fonctionner (ici le peroxyde d’hydrogène H2O2), se fixe sur le site actif de l’enzyme MPO. Cela génère une réaction enzymatique : l’enzyme « se met en marche » et est capable de transformer le substrat en produits. Dans cette réaction, les produits libérés par l’enzyme sont l’eau (H2O) et l’eau de Javel (HClO).
Figure 1. Schéma simplifié du fonctionnement de l’enzyme myéloperoxydase (MPO). Le substrat, ce dont l’enzyme a besoin pour fonctionner (ici le peroxyde d’hydrogène H2O2), se fixe sur le site actif de l’enzyme MPO. Cela génère une réaction enzymatique : l’enzyme « se met en marche » et est capable de transformer le substrat en produits. Dans cette réaction, les produits libérés par l’enzyme sont l’eau (H2O) et l’eau de Javel (HClO).
Située dans les globules blancs du sang, cette protéine participe à notre immunité innée. Même si le corps humain en produit environ 500 mg/jour, l’accès au sang est limité. « Le sang c’est précieux et rare, il n’y a pas assez de donneurs » rappelle C. Stines-Chaumeil.
Dans le but de trouver un homologue bactérien de l’enzyme, la chercheuse interroge les bases de données bioinformatiques et sélectionne celle de Rhodopirellula baltica, encore jamais testée expérimentalement. « L’homologue bactérien a levé le verrou d’obtenir du sang humain », affirme-t-elle. La première étape du projet a été de caractériser en profondeur cette enzyme. Quelle est son activité ? Est-elle stable ? À quel pH ? Après validation de ces caractéristiques fonctionnelles, la seconde étape a été de répondre à la question : est-ce que les produits de la réaction de l’enzyme sont microbicides ? C’est-à-dire, est-ce que l’enzyme produit correctement et suffisamment de l’eau de Javel ? Les tests ont été réalisés sur une souche de la bactérie E. coli, une référence pour les scientifiques dans la réalisation d’antibiogrammes en microbiologie (figure 2).
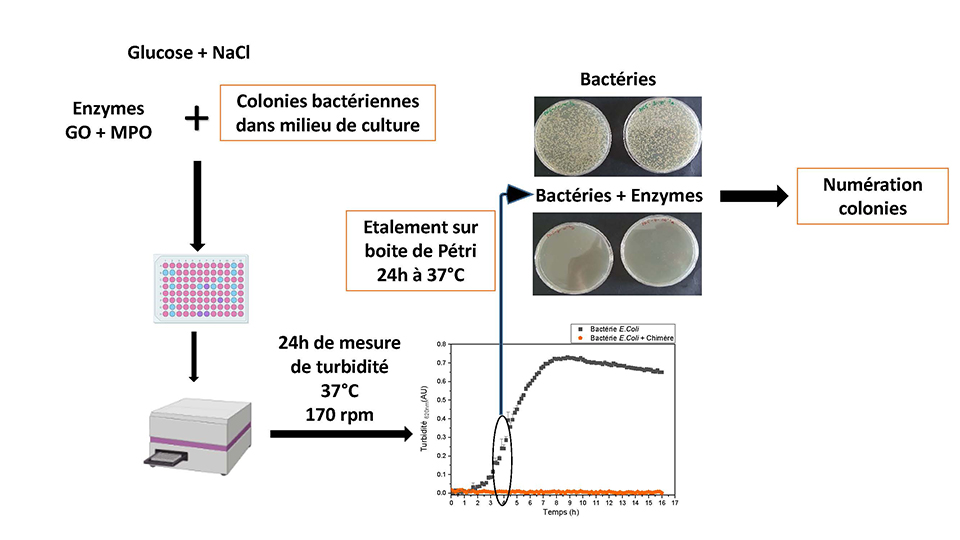 Figure 2. Principe de réalisation des tests de microbicidie © Centre de recherche Paul Pascal
Figure 2. Principe de réalisation des tests de microbicidie © Centre de recherche Paul Pascal
Cette étape a nécessité de l’optimisation car « a contrario d’un antibiogramme où on peut doser le taux d’antibiotiques, avec une enzyme on ne peut pas contrôler son activité car elle fonctionne jusqu’à épuisement de ses substrats » explique C. Stines-Chaumeil. Trouver les bons ratios de substrats de l’enzyme, ce dont elle a besoin pour fonctionner, s’est avéré être un nouveau challenge au projet.
À deux on est plus forts
Dans le corps, c’est l’enzyme NADH oxydase qui fournit le substrat de la MPO, le peroxyde d’hydrogène (H2O2). Cependant, ce dernier n’est pas stable. Cela signifie qu’au cours du temps, son état va se dégrader. Pour pallier ce deuxième verrou au projet, l’équipe BIO2.0 a imaginé le couplage d’une autre enzyme à la MPO, la glucose-oxydase (GO), capable de produire elle-même le peroxyde d’hydrogène à partir de glucose et d’oxygène disponibles dans le corps comme les sels pour la MPO. En somme, la seconde enzyme (MPO) consomme ce que produit la première (GO) et produit à son tour l’eau de Javel (figure 3). De cette manière, l’équipe se délaisse du problème de l’instabilité du substrat puisque l’enzyme GO le produit de manière continue.
La fabrication de cette enzyme bi-fonctionnelle (GO+MPO) a été rendue possible par un véritable travail de design et d’ingénierie protéique. En effet, la technique de l’ajout des deux enzymes à la même concentration dans le milieu s’est trouvée limitée. L’autre stratégie a donc été de lier les deux protéines par un linker, qui n’est autre qu’un morceau de protéine, choisi méthodiquement par les scientifiques pour assurer la stabilité de la protéine finale.
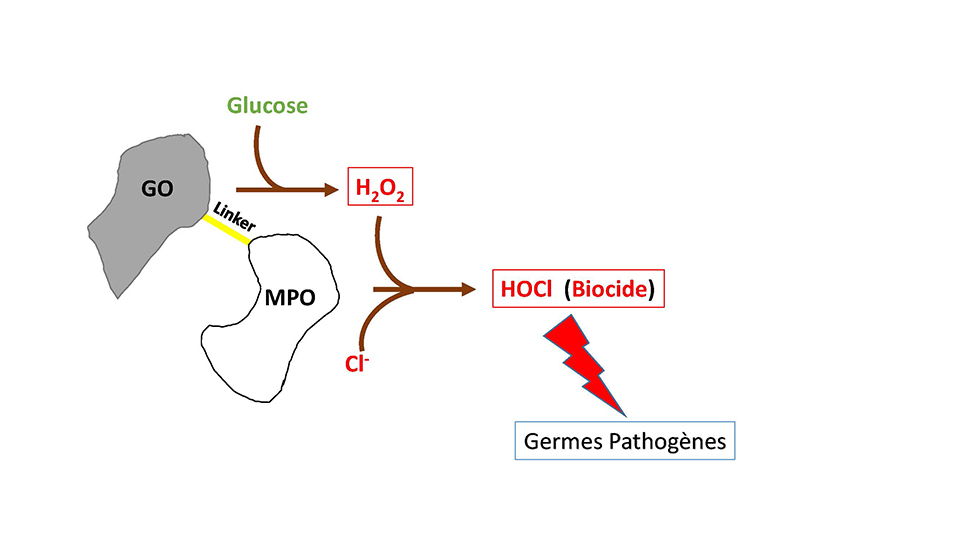 Figure 3. Représentation schématique du couplage entre la glucose-oxydase (GO) et la myéloperoxydase (MPO).
Figure 3. Représentation schématique du couplage entre la glucose-oxydase (GO) et la myéloperoxydase (MPO).
Les deux enzymes sont reliées par un linker peptidique et produisent de l’HOCl (eau de Javel) à partir de glucose et de sel. Le sel est un solide constitué d’ions sodium (Na+) et d’ions chlorure (Cl-).
Mais cette « grosse » protéine est-elle tout autant efficace pour tuer les microbes que la MPO seule ? Les tests de microbicidie avec l’enzyme chimérique (présence de deux ADNs) ont révélé tout le potentiel des travaux de l’équipe. « Le fait de rapprocher les deux enzymes augmente la concentration locale de peroxyde d’hydrogène autour de la MPO et améliore considérablement l’efficacité de l’enzyme chimérique », poursuit fièrement C. Stines-Chaumeil. De cette façon, l’objet en lui-même devient microbicide. En 2022, l’équipe BIO2.0 dépose deux brevets pour protéger l’ingénierie de l’enzyme bi-fonctionnelle, l’un pour protéger les ratios nécessaires de GO et de MPO et le second pour protéger la nature des linkers.
Accroche-moi si tu peux
Une fois que l’enzyme est assurément stable et fonctionnelle, l’enjeu suivant est qu’elle puisse se fixer sur un matériau tout en conservant ses précieuses propriétés. Dans le domaine médical, de nombreux outils sont en silicone « car le corps humain le supporte très bien » affirme la chercheuse. Le défi fut donc de trouver une technique pour immobiliser l’enzyme sur des films minces de silicone. Avec l’aide de l’équipe CIA, les chercheurs testent trois techniques : la physisorption, l’encapsulation dans un hydrogel et enfin la fixation covalente sur un gel PNIPAM2. La dernière technique se distingue des deux premières par son ingéniosité.
En utilisant le gel PNIPAM, les chercheurs souhaitent fabriquer ce qu’on appelle des neutrophiles artificiels. Ces derniers seraient ainsi capables de réaliser la nétose (ou NET pour Neutrophiles Extracellular Trap) qui est « le dernier rempart des neutrophiles face au pathogène pour lutter contre l’infection » précise-t-elle. Ce processus cellulaire se base sur la libération d’ADN et de protéines capables de piéger les micro-organismes pathogènes et de les détruire. En se « suicidant », le neutrophile détruit alors l’agent infectieux. Mais pourquoi est-ce si avantageux d’utiliser cette technique avec la MPO ? La MPO est chargée positivement tandis que l’ADN libéré est chargé négativement. De cette manière, la MPO se colle à l’ADN avec la bactérie. Ce couplage artificiel va donc permettre à l'enzyme, qui produit ses composés microbicides, de tuer la bactérie plus efficacement.
Le PNIPAM forme un cœur colloïde, qui est le mélange d’un gel et de particules en suspension à un état stable, entouré de cheveux d’anges s’apparentant à de fins filaments (figure 4, image de gauche). Lorsque l’enzyme est immobilisée sur le PNIPAM, elle se greffe au bout des cheveux d’anges et permet d’obtenir le neutrophile artificiel (figure 4, image de droite).
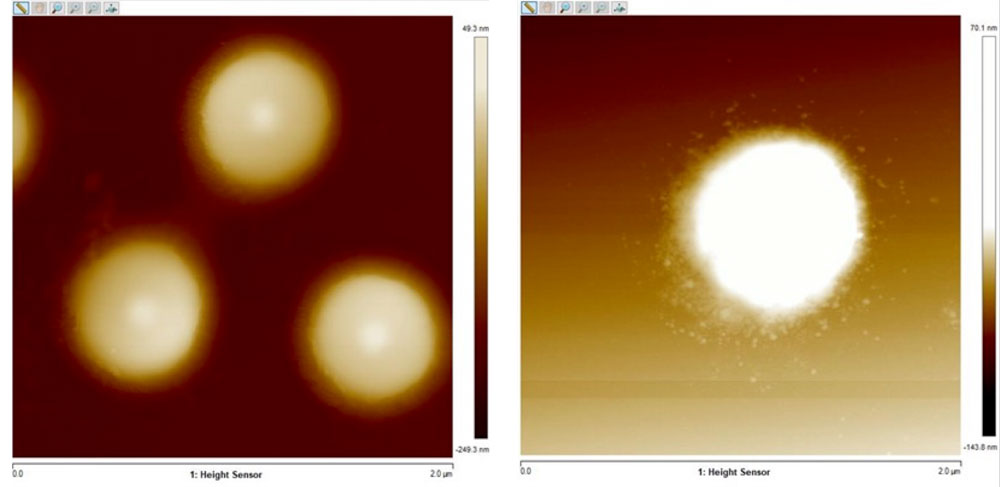 Figure 4. Clichés de microscopie à force atomique (AFM). Images réalisées par Gilles Pecastaing au CRPP. Cœur colloïde formé par le polymère PNIPAM (à gauche) fonctionnalisé avec l’enzyme (à droite).
Figure 4. Clichés de microscopie à force atomique (AFM). Images réalisées par Gilles Pecastaing au CRPP. Cœur colloïde formé par le polymère PNIPAM (à gauche) fonctionnalisé avec l’enzyme (à droite).
Les tests de microbicidie réalisés par l'EFS sont prometteurs, le protocole a fonctionné pour quatre souches d'agents infectieux : le staphylocoque doré3, la bacille pyocyanique4, la bacille du foin5 et l'espèce de levure la plus importante : Candida albicans.
En route vers l’industrialisation
Les deux équipes du CRPP et l’EFS maintiennent le cap pour permettre l’industrialisation de leur technologie. Le design de la protéine chimérique et l’optimisation de la technique d’immobilisation de l’enzyme sur matériau a déjà permis aux trois partenaires de propulser le projet MicrobicidalEnzyme au-delà de la preuve de concept.
La suite s’annonce tout aussi riche. Actuellement, les tests sur matériaux se poursuivent. « En ce moment, l’enjeu est de caractériser les matériaux par leur dynamique, la rhéologie et leur stabilité » confie C. Stines-Chaumeil. Les équipes souhaitent démontrer leur procédé sur des cathéters urinaires en vue de l’enjeu pour la lutte contre les maladies nosocomiales. Cependant, elles sont tout autant convaincues du potentiel de la technique pour d’autres matériaux et donc d’autres utilisations médicales. « Notre travail est de caractériser les objets et nous avons besoin d’un industriel qui va co-maturer le projet avec nous pour nous proposer un matériau qui soit biodégradable, moins coûteux ou moins toxique » ajoute la chercheuse.
Le pouvoir de produire de l’eau de Javel en continu sur des matériaux à usage médical ne s’arrêterait pas à l’élimination d’agents infectieux isolés. En effet, les perspectives de ce projet sont plurielles comme le souligne Claire Stines-Chaumeil : « Nous savons que les produits de l’enzyme sont microbicides pour les agents infectieux en solution mais nous n’avons pas encore testé leur adhérence en biofilm », « nous aimerions également tester l’enzyme sur des souches multirésistantes isolées de patients de l’EFS ».
Les directions du projet MicrobicidalEnzyme sont donc nombreuses et chacune pourrait apporter des solutions inédites dans le domaine biomédical. Avec deux thèses dans les équipes mobilisées, C. Stines-Chaumeil conclut : « c’est un projet vivant et passionnant ».
Ces résultats font l’objet d’un article paru dernièrement dans la revue Journal of Biotechnology : https://doi.org/10.1016/j.jbiotec.2025.01.018 [6].
_________________________
Ces recherches ont été financées en tout ou partie, par l’Agence nationale de la recherche (ANR) au titre du projet ANR- [7]MicrobicidalEnzyme [5]-AAPG2018 [5]. Cette communication est réalisée et financée dans le cadre de l’appel à projet Sciences Avec et Pour la Société - Culture Scientifique Technique et Industrielle pour les projets JCJC et PRC des appels à projets génériques 2018/2019 (SAPS-CSTI-JCJC et PRC AAPG 18/19).
- 1. Unité CNRS, Université de Bordeaux
- 2. PNIPAM est l'abréviation de poly(N-isopropylacrylamide). C’est un polymère (une grosse molécule composée de plusieurs petites molécules) sensible à la chaleur.
- 3. Staphylocoque doré (nom scientifique : Staphylococcus aureus)
- 4. Bacille pyocyanique (nom scientifique: Pseudomonas aeruginosa)
- 5. Bacille du foin (nom scientifique : Bacillus subtilis)
