Plongée dans l’ultrarapide moléculaire
A la une
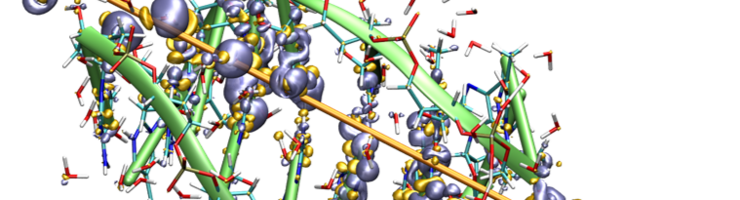
Comprendre les effets de l’irradiation passe par l’exploration des phénomènes ultrarapides. En modélisant les mouvements atomiques et électroniques à des échelles de temps infimes, les scientifiques lèvent le voile sur la dynamique moléculaire qui se joue juste après l’impact d’un rayonnement intense sur des molécules biologiques (ADN, protéines…).
Un milliard de fois plus rapide qu’un clignement d’œil : c’est l’échelle de temps sur laquelle se joue l’impact d’un rayonnement intense sur une molécule biologique. C’est ce qui arrive, par exemple, à une molécule d’ADN en radiothérapie. Ce laps de temps ultra-court, encore peu exploré, est pourtant clé pour comprendre les dommages radiatifs causés au vivant.
C’est là qu’intervient le projet RUBI, financé par l’Agence nationale de la recherche (ANR) qui soutient l’excellence de la recherche et l’innovation française sur le plan national, européen et international. L’objectif ici : modéliser ces réactions grâce à des supercalculateurs et suivre, à l’échelle atomique, comment l’énergie se redistribue dans une molécule irradiée.
Une onde de choc moléculaire
Un rayon X, gamma ou un proton est un rayonnement si énergétique qu’elle peut arracher des électrons aux molécules touchées, modifiant ainsi leur structure. « Jusqu’ici, nous connaissions les effets des radiations à partir de la picoseconde (10⁻¹² secondes), l’échelle maximale à laquelle nous observons actuellement les effets des rayonnements intenses sur les atomes, explique Aurélien de la Lande, directeur de recherche CNRS à l’Institut de chimie physique[1] et responsable du projet. Mais entre la femtoseconde (10-15 secondes) où l’irradiation a lieu et cette picoseconde, il y a un gouffre de six ordres de grandeur encore inexploré. »
Une femtoseconde correspond à un millionième de milliardième de seconde. Bref, c’est plus court que le temps qu’il faut à la lumière pour traverser un cheveu. Et l’écart entre la picoseconde et la femtoseconde est aussi vertigineux que celui qui sépare la lenteur d’un escargot de la vitesse d’une fusée ! Le temps donc pour de nombreux phénomènes moléculaires de faire leur chemin.
Aujourd’hui, des observations de plus en plus pointues permettent aux scientifiques d’observer de nouveaux phénomènes jusqu’à présent imperceptibles à ces échelles de temps. La modélisation de ces derniers permet, quant à elle, d’aller plus loin dans la compréhension de la dynamique atomique qui explique ces observations.
Des simulations pour voir l’invisible
En irradiant virtuellement des bases d’ADN, des acides aminés ou des protéines entières, les scientifiques ont découvert que plus une molécule est grande, plus les mouvements d’électrons diffèrent entre sa surface et son cœur. Dans une petite molécule, chaque atome a la même probabilité de perdre un électron. Mais dans une protéine plus complexe comme l’insuline, les électrons internes rebondissent sur leurs voisins avant d’être réabsorbés. Ceux en périphérie s’échappent plus facilement. Résultat : certaines zones sont plus vulnérables que d’autres aux irradiations.
Autre révélation : le phénomène d’ionisation ne se limite pas à une perte d’électrons par la molécule. « Elle induit une réorganisation structurelle. On parle de repliement de la protéine, un phénomène déjà connu en biologie. Ici, nous avons fourni pour la première fois une explication mécanistique de ce qui se passe à l'échelle moléculaire. En fait, la création d'une charge positive quelque part dans la protéine modifie immédiatement la position des acides aminés voisins en quelques centaines de femtosecondes », explique Aurélien de la Lande.
Des échos jusque dans l’espace interstellaire
Ces réactions ultrarapides jouent aussi un rôle fondamental dans l’espace. Deux autres équipes de RUBI ont étudié la glycine, un acide aminé retrouvé sur des comètes et impliqué dans l’apparition de la vie sur Terre. « Ces molécules prébiotiques ne voyagent pas intactes : elles subissent des transformations sous l’effet des radiations cosmiques », précise Aurélien de la Lande. Mais ces rayonnements favorisent-ils la formation de ces molécules prébiotiques ou les détruisent-elles ?
En modélisant la glycine piégée dans des glaces interstellaires irradiées, les scientifiques ont notamment découvert que les électrons arrachés restent principalement confinés dans la molécule. Ils oscillent en son sein plutôt que de se disperser dans la glace. Un phénomène qui pourrait influencer la chimie organique de l’espace.
Et maintenant ? « Nous allons modéliser l’apparition des premières cassures de liaisons chimiques causées par l’irradiation qui surviennent après quelques centaines de femtosecondes. Pas à pas, nous nous rapprochons des questions de dommages radiatifs sur le vivant », confie Aurélien de la Lande.
