A la une
Pendant plus d’un siècle, il a été considéré que la structure du cerveau adulte demeurait fixe et que les cellules nerveuses n’étaient pas remplacées, contrairement aux autres cellules du corps. Néanmoins, après 50 ans de débat, il est aujourd’hui admis que le cerveau de nombreux mammifères adultes, y compris les primates, génère de nouveaux neurones : on parle de neurogenèse adulte. Cette neurogenèse adulte a été mise en évidence dans de rares zones du cerveau, incluant l’hippocampe, une structure cérébrale jouant un rôle important dans certains processus cognitifs et émotionnels.
Mais, coup de théâtre, une nouvelle étude publiée dans la revue Nature suggère que la neurogenèse s’interromprait après l’âge de 13 ans dans l’hippocampe humain1 ! Ces observations représentent donc un véritable séisme pour ce champ d’investigation, qui suscite beaucoup d’espoirs dans le domaine de la médecine régénérative. Et si c’était une bonne nouvelle ? Explications.
Détection de la neurogenèse adulte
Tout d’abord, comment détecte-t-on les nouveaux neurones générés dans le cerveau adulte ? La neurogenèse adulte désigne l’ensemble des processus qui, à partir de la division des cellules souches* neurales, donne naissance à des cellules capables de se différencier en neurones et de s’intégrer dans les circuits préexistants du cerveau. La stratégie la plus couramment utilisée repose sur le marquage indélébile des nouvelles cellules produites lorsqu’une cellule souche se divise, permettant ainsi l’observation des cellules neurales qui en découlent. Une de ces stratégies repose sur l’utilisation de la bromodésoxyuridine (BrdU), un analogue structurel de la thymidine (une des 4 bases qui constituent l’ADN*), qui comporte un atome de brome facilement détectable. Elle consiste à injecter dans l’organisme la BrdU, qui est alors utilisée par la machinerie moléculaire lors de la synthèse de l’ADN des nouvelles cellules au cours de la division cellulaire. Par la suite, la détection de la BrdU permet de visualiser facilement les cellules nouvellement produites à un instant donné dans l’organisme, y compris dans le cerveau. Cette technique permet à la fois de visualiser les nouvelles cellules produites, mais aussi de dater précisément leur âge, étant donné que la BrdU « libre » (non utilisée pour la synthèse de l’ADN) ne reste que quelques heures dans l’organisme. Après plusieurs heures, jours ou semaines, il est donc possible de visualiser les cellules dont l’ADN a été marqué avec la BrdU. Pour aller plus loin, il est possible de coupler cette technique avec la visualisation de l’expression de marqueurs immunohistochimiques* spécifiques tels que des marqueurs de cellules souches, des marqueurs de neurones immatures comme la doublecortine (DCX), ou encore de neurones matures tels que la protéine Neuronal nuclei (NeuN), afin de déterminer la nature des cellules et leurs stades de maturation (Figure 1). Ainsi, l’utilisation de la BrdU avec ces différents marqueurs immunohistochimiques permet de mesurer avec précision l’âge et le degré de maturation de ces nouveaux neurones.
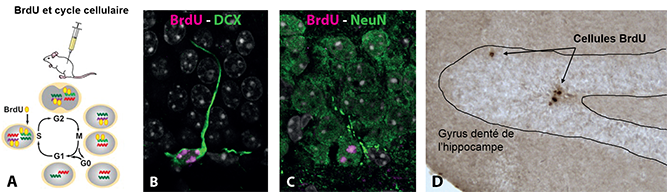
Figure 1 : A) Incorporation de la BrdU dans l’ADN lors de la phase S – synthèse de l’ADN – au cours de la division cellulaire. Extrait de Ming & Song, 2005. B) Exemple d’une nouvelle cellule marquée à la BrdU exprimant DCX (microscopie confocale), indiquant que cette nouvelle cellule est un neurone immature. C) Exemple d’une nouvelle cellule marquée à la BrdU exprimant NeuN (microscopie confocale), indiquant un nouveau neurone mature. D) Visualisation des cellules marquées à la BrdU en microscopie optique dans l’hippocampe d’une souris. Extrait de Veyrac A., Gros A. et al., 2013.
Mise en évidence de la neurogenèse adulte chez l’humain
L’étude de la neurogenèse adulte chez l’humain connaît de nombreuses limitations telles que la disponibilité et la qualité des échantillons cérébraux, ainsi que l’impossibilité d’utiliser les mêmes techniques que chez l’animal pour des raisons éthiques. La première étude à mettre en évidence l’existence d’une neurogenèse adulte chez l’humain fut réalisée en 1998 chez des patients atteints de cancer injectés avec de la BrdU pour visualiser la prolifération des cellules cancéreuses4. Les auteurs de cette étude furent ainsi capables de démontrer l’existence de neurones matures générés dans l’hippocampe adulte humain et ce jusqu'à 2 ans après l’injection de BrdU. Depuis cette étude pionnière, plus d’une vingtaine de travaux ont décrit l’existence d’une neurogenèse adulte chez l’humain. À ce jour, la démonstration la plus convaincante a mis à profit la présence élevée dans l’atmosphère de carbone 14 (14C, un isotope radioactif du carbone) suite aux essais nucléaires des années 1960 pour dater l’âge des cellules de l’hippocampe chez des individus nés avant, pendant et après ces essais nucléaires5. Les auteurs ont ainsi mesuré l’âge relatif des cellules de l’hippocampe en comparant leur teneur en carbone radioactif avec celui présent dans l’atmosphère à la naissance de l’individu. L’utilisation de cette technique particulièrement originale a permis de démontrer que de nombreuses cellules sont produites dans l’hippocampe à l’âge adulte et ce tout au long de la vie des individus.
La neurogenèse adulte chez l’humain n’existerait finalement pas ?
Avec cette dernière étude, nous pensions que la présence d’une neurogenèse adulte chez l’humain était actée. Mais le nouveau travail de Sorrells et collègues remet cette certitude en question ! Dans cette nouvelle étude, les auteurs ont utilisé des échantillons de tissu cérébral récupéré sur 29 individus à différents âges allant de 14 semaines de gestation à 77 ans. En utilisant la visualisation de l’expression des marqueurs immunohistochimiques tels que DCX, les auteurs montrent une production de neurones très tôt durant le développement (14 semaines de gestation) jusqu’à l’âge de 13 ans, mais ont été incapables de mettre en évidence une neurogenèse à partir de 18 ans. La diminution de la production de nouveaux neurones au cours du vieillissement est un phénomène bien connu chez les mammifères. Cependant, l’absence complète de neurogenèse chez les humains à l’âge adulte est une observation inattendue. Pour ces raisons, cette nouvelle étude a suscité de nombreuses réactions dans la communauté scientifique et d’importantes discussions en ont découlé. Pour une lecture plus approfondie, nous invitons les lecteurs à consulter le billet de Jason Snyder (en anglais) qui liste les différents points de discussions qu’ouvre le travail de Sorrells et collègues.
Ici, nous ne résumerons que quelques-uns de ces points. Tout d’abord, il faut saluer le travail rigoureux des auteurs : la qualité des tissus et les analyses immunohistochimiques sont exemplaires. Les auteurs ont appliqué les mêmes analyses sur des échantillons humains à différents âges, ce qui rend l’analyse d’autant plus convaincante. Les critères de détection des cellules immatures sont rigoureux et précis. Les auteurs ont même inclus des données obtenues chez le macaque pour corroborer leurs observations. Néanmoins, l’expression des marqueurs utilisés par les auteurs pour visualiser la neurogenèse peut être sujette à une dégradation rapide après la mort de l’individu, ce qui n’est pas favorable à la détection des nouveaux neurones, en particulier dans les conditions de collection des tissus humains. De plus, la neurogenèse adulte est majoritairement étudiée chez les rongeurs, dont la vitesse de maturation des nouveaux neurones est bien plus rapide que chez le singe6. Il n’est donc pas inenvisageable que chez l’humain, les neurones immatures puissent le rester pour une durée indéterminée, avec des profils d’expression des marqueurs immunohistochimiques différents de ceux observés chez les rongeurs (Figure 2). Ces neurones immatures pourraient ainsi échapper à la détection immunohistochimique tout en continuant à influencer les circuits neuronaux.
Comme le souligne Jason Snyder, le travail de Sorrells et de ses collègues est donc une contribution importante à ce domaine de recherche ; il remet en question les travaux antérieurs sans toutefois apporter la preuve absolue que la neurogenèse n’existe pas dans l’hippocampe adulte chez l’humain. L’absence de preuve est une condition nécessaire mais pas suffisante pour prouver l’absence d’un phénomène.
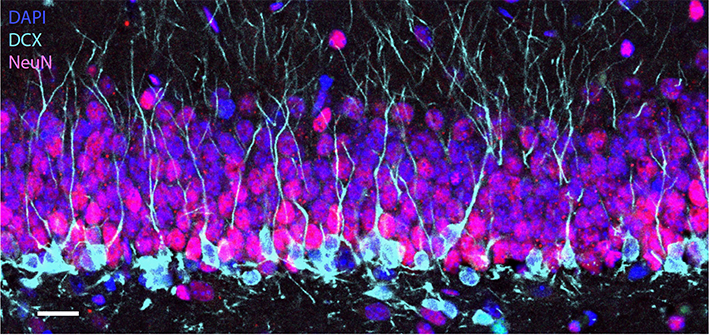
Figure 2 : Dans cette coupe d’hippocampe de souris, les neurones immatures (DCX) s’intègrent dans le circuit préexistant de l’hippocampe composé de neurones matures (NeuN). Échelle : 20 µm © Alexia Zagouras (Sahay lab)
Quel avenir pour la neurogenèse adulte chez l’humain ?
Ces travaux illustrent bien la difficulté et la limitation des outils utilisés dans la mise en évidence de la neurogenèse adulte chez l’humain. Qu’elles reposent sur des marqueurs immunohistochimiques, ou de manière plus originale sur la détection 14C, toutes ces techniques ne fournissent une information qu’à un instant donné, à la manière d’une photographie figée dans le temps. De plus, de récentes études montrent que l’hippocampe humain est sujet à de nombreuses mutations au cours du vieillissement normal et pathologique7. Ces observations sont importantes car l’incorporation de BrdU ou 14C dans l’ADN pourrait survenir lorsque les cellules se divisent mais aussi lorsque l’ADN subit des réparations, même si Spalding et collègues estiment que ce phénomène ne permettrait pas d’expliquer les taux élevés d’incorporation de 14C dans l’hippocampe5.
Une alternative à ces approches pourrait reposer sur la visualisation de la neurogenèse en temps réel. Imaginons que nous soyons capables de « filmer » ce processus chez le même individu à différents moments ; il deviendrait alors possible de mesurer et de comparer les effets de l’âge, du stress, de l’activité physique ou même de composés pharmacologiques, connus pour moduler positivement ou négativement les niveaux de neurogenèse chez les modèles animaux. Ce genre d’approche a déjà été mis en place : il est désormais possible de combiner des outils génétiques et optiques afin de suivre la prolifération et la maturation des nouveaux neurones dans l’hippocampe adulte de souris en temps réel8. Bien évidemment, ces approches ne sont pas applicables en l’état chez l’humain. Une alternative à ces stratégies pourrait consister à identifier des biomarqueurs de la neurogenèse qu’il serait possible d’observer avec des outils d’imagerie non invasive. Ainsi, en 2007, une étude identifiait un biomarqueur de la neurogenèse chez l’humain9. Néanmoins, ces résultats nécessitent d’être confirmés avant qu’il ne soit possible de clamer l’existence ou l’absence de la neurogenèse chez l’humain.
Pas de nouvelles, bonne nouvelle
Pour conclure, le travail de Sorrells et de ses collègues représente un nouveau chapitre dans l’histoire de la découverte de la neurogenèse adulte, marquée par de nombreux rebondissements, d’observations inattendues et de désillusions. La rigueur de l’analyse et l’intégrité de la démarche qui ont abouti à la publication de ces résultats dits « négatifs » doivent être accueillies avec enthousiasme. Cependant, il est aujourd’hui impossible de déterminer exactement comment et pourquoi cette nouvelle étude aboutit à des conclusions radicalement opposées aux études précédentes. Le débat n’est donc pas clos, bien au contraire. De nouvelles études sont ainsi nécessaires afin de multiplier les observations basées sur différentes approches, voire de développer de nouvelles méthodologies afin de confirmer ou d’infirmer l’existence de la neurogenèse adulte dans l’hippocampe humain. Et si les observations de Sorrells et de ses collègues étaient confirmées, de nouvelles questions tout aussi fascinantes s’offriraient à nous : pourquoi et comment l’hippocampe humain diffère de celui de nombreux autres mammifères ? Peut-on restaurer les niveaux de neurogenèse dans le cerveau humain âgé ? Pour toutes ces raisons, l’absence de neurogenèse dans l’hippocampe humain décrite par Sorrells et ses collègues est donc une bonne nouvelle pour la recherche portant sur les cellules souches dans le cerveau adulte. Quoi qu’il en soit, l’avenir de ce champ de recherche promet d’être passionnant !
*Un peu de vocabulaire
Cellules souches = Cellules indifférenciées capables de générer des cellules différenciées par spécialisation cellulaire et de se maintenir dans l’organisme en se divisant.
ADN = L’acide désoxyribonucléique contient toute l’information génétique des êtres vivants. Les molécules d’ADN sont formées de doubles brins enroulés l’un autour de l’autre pour former une double double hélice. Chaque brin est un polymère de nucléotides (polynucléotide) constitués de bases nucléiques – adénine, thymine, cytosine, guanine – liées à un ose lui-même lié à un groupe phosphate.
Immunohistochimie = Méthode de détection d’une protéine sur une coupe de tissu basée sur la détection d’antigènes par un ou des anticorps
-------------------------------------------------------------------------------------------------------------------------------- Références :
1 Human hippocampal neurogenesis drops sharply in children to undetectable levels in adults. Sorrells S.F., Paredes M.F., Cebrian-Silla A., Sandoval K., Qi D., Kelley K.W., James D., Mayer S., Chang J., Auguste K.I., Chang E.F., Gutierrez A.J., Kriegstein A.R., Mathern G.W., Oldham M.C., Huang E.J., Garcia-Verdugo J.M., Yang Z., Alvarez-Buylla A. Nature. 2018;555(7696):377-381.
2 Adult neurogenesis in the mammalian central nervous system. Ming G.L and Song H. Annual review of neurosciences 2005;28:223-50.
3 Zif268/egr1 gene controls the selection, maturation and functional integration of adult hippocampal newborn neurons by learning. Veyrac A., Gros A., Bruel-Jungerman E., Rochefort C., Kleine Borgmann F.B., Jessberger S., Laroche S. Proc Natl Acad Sci U S A. 2013;110(17):7062-7.
4 Neurogenesis in the adult human hippocampus. Eriksson P.S., Perfilieva E., Björk-Eriksson T., Alborn A.M., Nordborg C., Peterson D.A., Gage F.H. Nat Med. 1998;4(11):1313-7
5 Dynamics of hippocampal neurogenesis in adult humans. Spalding KL, Bergmann O, Alkass K, Bernard S, Salehpour M, Huttner HB, Boström E, Westerlund I., Vial C., Buchholz B.A., Possnert G., Mash D.C., Druid H., Frisén J. Cell. 2013;153(6):1219-1227.
6 Maturation time of new granule cells in the dentate gyrus of adult macaque monkeys exceeds six months. Kohler S.J., Williams N.I., Stanton G.B., Cameron J.L., Greenough WT. Proc Natl Acad Sci U S A. 2011;108(25):10326-31.
7 Aging and neurodegeneration are associated with increased mutations in single human neurons. Lodato M.A., Rodin R.E., Bohrson C.L., Coulter M.E., Barton A.R., Kwon M., Sherman M.A., Vitzthum C.M., Luquette L.J., Yandava C.N., Yang P., Chittenden T.W., Hatem N.E., Ryu S.C., Woodworth M.B., Park P.J., Walsh C.A. Science. 2018;359(6375):555-559.
8 Live imaging of neurogenesis in the adult mouse hippocampus. Pilz G.A., Bottes S., Betizeau M., Jörg D.J., Carta S., Simons B.D., Helmchen F., Jessberger S. Science. 2018;359(6376):658-662.
9 Magnetic resonance spectroscopy identifies neural progenitor cells in the live human brain. Manganas L.N., Zhang X., Li Y., Hazel R.D., Smith S.D., Wagshul M.E., Henn F., Benveniste H., Djuric P.M., Enikolopov G., Maletic-Savatic M. Science. 2007;318(5852):980-5.
-------------------------------------------------------------------------------------------------------------------------------- Alexandra Gros est docteure en neurosciences (Institut des neurosciences Paris-Saclay). Au cours de sa thèse, elle s’est intéressée au rôle de la neurogenèse adulte hippocampique dans les processus d’apprentissage et de mémoire, notamment épisodique. Alexandra est actuellement chercheuse post-doctorante à l’université d’Édimbourg où elle étudie comment la mise en mémoire et la persistance de souvenirs d’événements de la vie courante peuvent être affectées par un apprentissage ultérieur. Pour cela, elle cherche à élucider les mécanismes moléculaires et cellulaires sous-tendant ces processus, notamment via des mécanismes de « tagging » des neurones et synapses en utilisant l’expression des gènes immédiats précoces.
Antoine Besnard est docteur en neurosciences (2011, UPMC). Durant son doctorat, il a étudié les mécanismes moléculaires qui contrôlent les adaptations du cerveau en réponse à la cocaïne sous la direction de la Dr Jocelyne Caboche. En 2012, Antoine rejoint l’équipe du Dr Amar Sahay située au Massachusetts General Hospital (Boston). Il utilise des techniques optogénétiques afin de visualiser et contrôler l’activité des cellules du cerveau. Son travail vise à décoder les circuits neuronaux qui contrôlent la peur et l’anxiété. Ces études sont importantes puisque de nombreuses maladies psychiatriques perturbent ces circuits ainsi que ces comportements. Restaurer l’activité de ces circuits pourrait donc un jour permettre de soigner ou même prévenir ces maladies du cerveau. Twitter : @AntoineBesnard3