A la une
La neurogenèse adulte, un processus permettant la production de nouveaux neurones au sein du cerveau adulte, est étudiée depuis plusieurs dizaines d’années et est maintenant bien démontrée chez un certain nombre de mammifères. Néanmoins, une controverse fait rage pour savoir si les humains possèdent véritablement une neurogenèse adulte, et ce malgré l’observation de nouveaux neurones dans le cerveau adulte des humains dès 1998.
Il y a un an, deux articles relançaient cette polémique et ont entraîné de nombreux commentaires de la part de la communauté scientifique. L’un1 en montrant qu’il existerait bien une neurogenèse adulte chez l’humain1(pour plus de détail, voir notre précédent billet sur cet article), et ce même chez l’humain âgé. Et le second2, qui a montré, au contraire, une absence de neurogenèse chez l’adulte, avec un arrêt de production de nouvelles cellules dans le cerveau adulte dès la fin de l’adolescence (pour plus de détails, voir notre précédent billet sur cet article). Mais d’importantes différences méthodologiques séparent ces deux articles scientifiques, notamment les méthodes de détection et de quantification des nouveaux neurones, ce qui rend impossible une conclusion définitive sur l’absence ou la présence d’une neurogenèse adulte chez l’humain.
On aurait pu en rester là, mais c’était sans compter sur l’obstination des chercheur·se·s pour résoudre ce mystère ! Et voici qu’un nouvel article3 vient relancer la controverse. Mais la relance-t-elle vraiment ? Ce nouvel article, publié dans la revue Nature Medecine, montre sans ambiguïté la présence d’une neurogenèse adulte chez l’humain et ce même chez le sujet très âgé ! Est-ce la fin de la polémique pour autant ? Il semblerait ! En effet, ce travail de longue haleine a été réalisé dans des conditions méthodologiques rigoureuses et extrêmement bien pensées. Décryptage.
Conservation des tissus humains
Classiquement, l’étude de la neurogenèse adulte chez les mammifères est réalisée sur des cerveaux fixés, c’est-à-dire plongés très rapidement dans une solution de formol afin de conserver l’intégrité du cerveau et de ces caractéristiques au fil du temps, en empêchant ainsi la dégradation du tissu et des marqueurs cellulaires que l’on souhaite observer et quantifier. Cette étape est facilement contrôlable lorsque l’on travaille sur l’animal mais elle se complique grandement chez l’humain. En effet, une des difficultés majeures est l’accès au tissu humain ainsi qu’au contrôle de sa conservation au cours du temps, du fait notamment de sa rareté.
Or, dans cette étude, les auteur·e·s ont parfaitement contrôlé ces étapes en fixant rapidement les prélèvements afin de ne pas compromettre l’étude de la neurogenèse adulte. Ils sont même allés jusqu’à faire varier le temps de conservation dans la solution de formol de 1h à 6 mois, ainsi que le type de solution de fixation, afin d’étudier l’impact de la fixation sur la reconnaissance de différents marqueurs cellulaires utilisés pour quantifier la production de nouveaux neurones dans le cerveau adulte. Les auteur·e·s montrent ainsi que le temps passé par le tissu dans la solution de conservation, ainsi que le type de solution utilisée influence grandement la détection des nouveaux neurones dans le cerveau par la suite. Ce dernier point explique en partie pourquoi dans les diverses études réalisées ces dernières années sur la neurogenèse adulte chez l’humain utilisant cette méthodologie, les résultats étaient inconsistants, montrant soit l’absence d’une neurogenèse adulte, soit sa présence avec des niveaux plus ou moins variables de nouveaux neurones.
Détection de la neurogenèse adulte
L’étude de la neurogenèse adulte chez les mammifères passe par la détection de certains marqueurs qui sont maintenant bien décrits et étudiés, notamment chez les rongeurs. On peut par exemple citer la doublecortine (DCX), une protéine dont l’expression est enrichie dans les nouveaux neurones encore immatures, couramment utilisée pour détecter les nouveaux neurones chez les mammifères. Néanmoins, la cinétique d’expression de ces marqueurs qui permettent d’étudier la neurogenèse adulte, n’est pas très bien définie chez l’humain, du fait notamment de la rareté de ce tissu.
Dans cette nouvelle étude, les auteur·e·s ont utilisé différents types de marqueurs afin d’étudier dans un premier temps l’absence ou la présence de nouveaux neurones dans certaines structures cérébrales et dans un deuxième temps la maturation de ces nouveaux neurones. Ils montrent que, comme chez les autres mammifères, les nouveaux neurones sont produits dans le gyrus denté de l’hippocampe, structure impliquée dans les processus de mémoire et connu pour petre le siège de la neurogenèse hippocampique chez d’autres mammifères.
Afin d’éviter les biais de détection, les auteur·e·s ont utilisé des “détecteurs” différents, à des concentrations variables et ce dans les diverses conditions de fixation du tissu, et montrent que la production de nouveaux neurones est bien présente dans cette structure. Par ailleurs, les auteur·e·s ont étudié la maturation de ces nouveaux neurones via l’expression de divers marqueurs, ainsi que leur morphologie et montrent que les nouveaux neurones migrent au sein du gyrus denté de l’hippocampe en fonction de leur degré de maturation, comme observé chez d’autres mammifères.
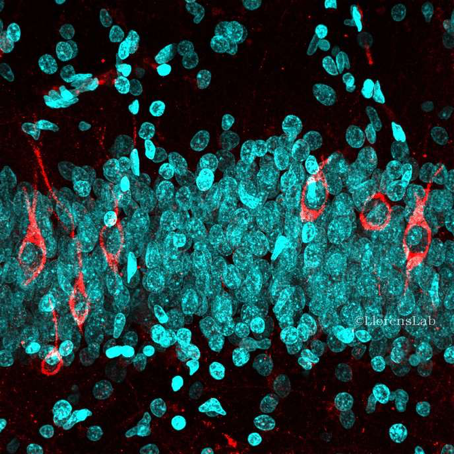
© Llorens lab
Cette image, prise au microscope confocal, montre les nouveaux neurones immatures qui expriment le marqueurs DCX (en rouge) au sein des neurones (DAPI, en magenta) du gyrus denté de l’hippocampe humain.
Neurogenèse adulte, âge et maladies neurodégénératives
Une question importante qui se pose avec la neurogenèse adulte est son rôle dans les fonctions cognitives et son rôle au cours du vieillissement. Est-elle toujours présente à un âge avancé ? Le processus est-il stable au cours du vieillissement ? Joue-t-elle un rôle dans le développement des maladies neurodégénératives ? Il est plutôt bien documenté que la neurogenèse adulte diminue avec l’âge chez les mammifères, et ce de façon assez rapide chez les rongeurs par exemple. Dans cette nouvelle étude, les tissus sont issus de patients âgés de 43 à 87 ans. Et malgré l’âge des patients, les auteur·e·s ont bien mis en évidence une production de nouveaux neurones au sein de l’hippocampe, et ce uniquement au sein du gyrus denté, comme observé chez d’autres mammifères, et une absence de neurogenèse dans les autres zones de l’hippocampe.
Ces données semble indiquer que la neurogenèse adulte est un processus qui se conserve au cours du vieillissement chez l’humain Néanmoins, une des critiques qui peut être faite sur cette étude est l’absence de sujets jeunes qui permettraient de comparer directement les niveaux de neurogenèse chez l’adulte au cours du vieillissement, des sujets jeunes aux sujets âgés. Par ailleurs, les auteur·e·s ont étudié la neurogenèse adulte chez des patients atteints de la maladie d’Alzheimer à différents stades de la maladie. Ils mettent en évidence une corrélation entre l’avancée de la maladie et le niveau de production et de maturation des nouveaux neurones dans l’hippocampe, ouvrant ainsi de nouvelles voies de recherche sur la compréhension de cette maladie.
L’observation d’un déclin modéré de la neurogénèse dans l’hippocampe chez l’adulte sain, même âgé, n’est pas nouvelle. Une étude récente1utilisant des marqueurs cellulaires similaires avait aboutit à la même conclusion. De même, une autre étude4utilisant une approche de datation au carbone 14 (14C) avait également permis de démontrer que de nombreuses cellules sont produites dans l’hippocampe à l’âge adulte et ce tout au long de la vie des individus.Grâce à une méthodologie impeccable, véritable cas d’école, cette nouvelle étude de la neurogenèse adulte chez l’humain semble bien mettre un terme à 20 ans de controverse sur sa présence ou non au sein de l’hippocampe des humains. Cela ouvre de toutes nouvelles problématiques à étudier, notamment le rôle de la neurogenèse adulte dans les processus mnésiques chez l’humain et son rôle dans les maladies neurodégénératives. Quelle est la proportion de nouveaux neurones produits au sein de l’hippocampe ? Comment s’intègrent-ils dans les réseaux préexistants de l’hippocampe ? Remplacent-ils d’anciens neurones ou s’additionnent-ils aux réseaux ? Comment participent-ils aux fonctions de l’hippocampe ? Qu’en est-il dans d’autres aires cérébrales ? Autant de questions qui ne manqueront pas d’animer les futures recherches sur ce sujet.
--------------------------------------------------------------------------------------------------------------------------------
Références
1 Human Hippocampal Neurogenesis Persists throughout Aging. Boldrini M, Fulmore CA, Tartt AN, Simeon LR, Pavlova I, Poposka V, Rosoklija GB, Stankov A, Arango V, Dwork AJ, Hen R, Mann JJ. Cell Stem Cell. 2018 Apr 5;22(4):589-599.e5. doi: 10.1016/j.stem.2018.03.015.
2 Human hippocampal neurogenesis drops sharply in children to undetectable levels in adults. Sorrells SF, Paredes MF, Cebrian-Silla A, Sandoval K, Qi D, Kelley KW, James D, Mayer S, Chang J, Auguste KI, Chang EF, Gutierrez AJ, Kriegstein AR, Mathern GW, Oldham MC, Huang EJ, Garcia-Verdugo JM, Yang Z, Alvarez-Buylla A. Nature. 2018 Mar 15;555(7696):377-381. doi: 10.1038/nature25975. Epub 2018 Mar 7.
3 Adult hippocampal neurogenesis is abundant in neurologically healthy subjects and drops sharply in patients with Alzheimer's disease. Moreno-Jiménez EP, Flor-García M, Terreros-Roncal J, Rábano A, Cafini F, Pallas-Bazarra N, Ávila J, Llorens-Martín M. Nat Med. 2019 Apr;25(4):554-560. doi: 10.1038/s41591-019-0375-9. Epub 2019 Mar 25.
4 Dynamics of hippocampal neurogenesis in adult humans. Spalding KL, Bergmann O, Alkass K, Bernard S, Salehpour M, Huttner HB, Boström E, Westerlund I, Vial C, Buchholz BA, Possnert G, Mash DC, Druid H, Frisén J. Cell. 2013 Jun 6;153(6):1219-1227. doi: 10.1016/j.cell.2013.05.002.
--------------------------------------------------------------------------------------------------------------------------------
Alexandra Gros est docteure en neurosciences (Institut des neurosciences Paris-Saclay). Au cours de sa thèse, elle s’est intéressée au rôle de la neurogenèse adulte hippocampique dans les processus d’apprentissage et de mémoire, notamment épisodique. Après un premier post-doctorant à l’université d’Edimbourg, elle est actuellement chercheuse post-doctorante au Centre de Recherche en Neurosciences de Lyon. Dans ses recherches, Alexandra explore les mécanismes qui sous-tendent la mise en mémoire et la rétention à très long terme des souvenirs, ainsi que le rôle d’évènements modulateurs de la mémoire sur ces processus, chez le rongeur adulte sain ou dans un contexte de vieillissement.
Antoine Besnard est docteur en neurosciences (2011, UPMC). Durant son doctorat, il a étudié les mécanismes moléculaires qui contrôlent les adaptations du cerveau en réponse à la cocaïne sous la direction de la Dr Jocelyne Caboche. En 2012, Antoine rejoint l’équipe du Dr Amar Sahay située au Massachusetts General Hospital (Boston). Il utilise des techniques optogénétiques afin de visualiser et contrôler l’activité des cellules du cerveau. Son travail vise à décoder les circuits neuronaux qui contrôlent la peur et l’anxiété. Ces études sont importantes puisque de nombreuses maladies psychiatriques perturbent ces circuits ainsi que ces comportements. Restaurer l’activité de ces circuits pourrait donc un jour permettre de soigner ou même prévenir ces maladies du cerveau. Twitter : @AntoineBesnard3