A la une
Dans un récent billet, nous discutions des récents travaux qui remettaient en question l’hypothèse selon laquelle l’hippocampe humain produirait des nouveaux neurones à l’âge adulte1.
Quelques semaines plus tard, la revue Cell Stem Cell publiait le travail de la docteure Maura Boldrini et collègues (Université de Columbia, New York) dont les conclusions s’opposent à ce récent travail2. Alors, produisons-nous vraiment de nouveaux neurones à l’âge adulte ? Pour répondre à cette question, nous avons interrogé la chercheuse Maura Boldrini qui a dirigé cette nouvelle étude.
La neurogenèse adulte : preuve et absence de preuve chez l’humain
Comme nous l’avons détaillé dans notre précédent billet, l’existence d’une neurogenèse adulte dans l’hippocampe humain a d’abord été mise en évidence en 1998 grâce à l’utilisation de la BrdU afin de visualiser la production de nouvelles cellules3 . Ces observations ont été par la suite répliquées par plus d’une vingtaine de travaux reposant sur des techniques d’immunohistochimie* mais également de datation au carbone 14 (14C)4. Mais très récemment, le travail de Sorrells et collègues a remis en question ces observations en montrant une absence de production de nouveaux neurones dans l’hippocampe humain chez l’adulte. Les auteurs ont utilisé la visualisation de l’expression de divers marqueurs immunohistochimiques pour démontrer une production de neurones très tôt durant le développement (14 semaines de gestation) jusqu’à l’âge de 13 ans mais ont été incapables de mettre en évidence une neurogenèse à partir de l’âge de 18 ans1 .
Mais quelques semaines après cette dernière publication, l’étude de Boldrini et collègues montre cette fois-ci une production de nouveaux neurones dans l’hippocampe chez l’adulte sain, même âgé ! Les auteurs de cette étude ont utilisé des techniques de détection immunohistochimiques similaires à celles de Sorrells et collègues. Pour cela ils ont utilisé des échantillons de tissus cérébraux récupérés sur 28 individus sains (11 femmes et 17 hommes décédés subitement alors qu’ils étaient en bonne santé) à différents âges allant de 14 à 79 ans. En utilisant la visualisation de l’expression de nombreux marqueurs immunohistochimiques, les auteurs montrent que les cellules souches* présentes dans l’hippocampe peuvent engendrer de nouveaux neurones (neurogenèse) mais également de nouveaux vaisseaux sanguins (angiogenèse). Les auteurs ont ainsi découvert que l’angiogenèse s’épuise tandis que la neurogenèse persiste au fil des années, et ce même après 70 ans !
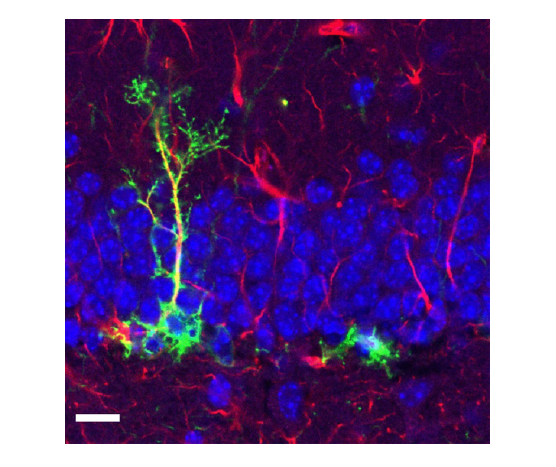
Figure 1 : Observation de cellules souches (vert) parmi des cellules matures dont les noyaux sont visibles en bleu (DAPI – marquage de l’ADN) dans une coupe d’hippocampe de souris. Echelle : 20 µm © Alexia Zagouras (Sahay lab)
Dr. Boldrini, merci d’avoir accepté de répondre à nos questions. Tout d’abord, vous avez décrit très précisément les sujets inclus dans votre étude. Pourquoi est-ce important et comment cela permettrait d’expliquer des résultats divergents avec les précédentes études ?
Maura Boldrini (MB) : Les études précliniques menées chez les rongeurs indiquent que la neurogenèse est sensible à différents facteurs tels que la prise de drogues, le stress, l’exercice et la stimulation cognitive. Ainsi, à la différence de nombreuses études s’intéressant à la neurogenèse dans l’hippocampe humain, nous avons exclu tout sujet présentant un déclin cognitif, atteint de maladies psychiatriques ou autres conditions neurologiques pouvant potentiellement compromettre l’interprétation de nos résultats.
Vous avez mesuré systématiquement les marqueurs immunohistochimiques dans l’intégralité de l’hippocampe. Pouvez-vous expliquer l’importance d’évaluer la neurogenèse de cette façon et notamment dans certaines sous-régions spécifiques de l’hippocampe ?
MB : D’abord, je pense qu’il est indispensable d’utiliser des méthodes mathématiques afin de quantifier la neurogenèse de manière rigoureuse dans une structure aussi grande que l’hippocampe humain. L’estimation précise du nombre total de cellules dans l’hippocampe n’est possible qu’en utilisant des techniques de stéréologie* et en analysant l’intégralité de l’hippocampe. L’analyse restreinte à une petite partie de l’hippocampe peut ainsi conduire à une sous estimation de la population de cellules étudiée, ici, les nouveaux neurones.
Ensuite, l’hippocampe humain est connecté à de nombreuses régions du cerveau qui accomplissent une multitude de tâches différentes. L’hippocampe antérieur jouerait un rôle prépondérant dans les processus émotionnels tandis que l’hippocampe postérieur serait impliqué dans des tâches cognitives. Mesurer les taux de neurogenèse dans ces différentes sous-régions permet de comprendre plus spécifiquement quelles fonctions pourraient être affectées par les changements cellulaires observés dans chaque région, lorsqu’il y en a.
Votre travail suggère que la neurogenèse adulte dans l’hippocampe humain est très différente de celles observée chez les rongeurs ou les primates. A-t-on une idée de ce qui rend l’hippocampe humain si spécial ?
MB : En effet, nos travaux (ainsi que ceux de Spalding et collègues4) suggèrent qu’à la différence des rongeurs ou des primates, la neurogenèse adulte ne décline que très modestement dans l’hippocampe humain au cours du vieillissement. De nombreuses études ont montré que la neurogenèse adulte dans l’hippocampe des rongeurs est impliquée dans les capacités d’apprentissage et les réponses émotionnelles. Les nouveaux neurones dans l’hippocampe humain pourraient donc jouer un rôle important dans la flexibilité cognitive ainsi que nos comportements guidés par nos émotions chez les individus jeunes, mais également âgés.
L’importance de votre travail a plusieurs dimensions : vous fournissez l’évidence que la neurogenèse adulte persiste tandis que l’angiogenèse (production de nouveaux vaisseaux sanguins) diminue dans l’hippocampe au fil des années. Pourquoi avez-vous étudié ces deux phénomènes en parallèle ?
MB : Des études d’imagerie cérébrale avaient rapporté que la taille de l’hippocampe humain diminue avec l’âge. Par ailleurs, des travaux d’imagerie fonctionnelle chez l’humain montrent que l’exercice produit une augmentation de la vascularisation dans l’hippocampe et que cet effet est largement atténué chez les sujets âgés. Pour toutes ces raisons, nous avons voulu analyser en parallèle les niveaux de neurogenèse et d’angiogenèse dans l’hippocampe humain à différents âges.
Est-il difficile de distinguer la neurogenèse de l’angiogenèse avec des marqueurs immunohistochimiques ?
MB : Les capillaires (petits vaisseaux sanguins) et les cellules/neurones ont des morphologies bien différentes, il est donc très facile de les distinguer au microscope. Nous avons d’ailleurs précédemment publié une liste de marqueurs avec lesquels il est possible de distinguer les capillaires dans la niche neurogénique*.
Votre travail suggère-t-il que restaurer les niveaux d’angiogenèse (mais pas de neurogenèse) dans l’hippocampe âgé pourrait limiter les effets du déclin cognitif ?
MB : En effet, la restauration des niveaux d’angiogenèse pourrait être bénéfique pour des individus qui ne présentent pas d’altérations cognitives spécifiques, tels que les individus inclus dans notre étude. Les capillaires sont importants car ils approvisionnent les circuits du cerveau en métabolites* nécessaires à leur bon fonctionnement. Ainsi, il est envisageable que la restauration des niveaux d’angiogenèse dans l’hippocampe âgé pourrait préserver le bon fonctionnement de l’hippocampe et donc les fonctions cognitives, notamment la mémoire.
Par ailleurs, nous nous intéressons aux mécanismes par lesquels les neurones prolifèrent, deviennent matures et survivent au sein des réseaux neuronaux. Ces mécanismes impliquent de très nombreux facteurs tels que des hormones*, des facteurs trophiques* ou des facteurs de transcription *. L’identification de ces divers facteurs et leur mécanisme d’action est donc importante pour développer de nouveaux traitements afin de traiter le déclin cognitif ou la démence. C’est pourquoi nous cherchons à comparer les individus âgés et sains avec des sujets présentant un déclin cognitif, atteints de maladies psychiatriques ou autres conditions neurologiques tel que la maladie d’Alzheimer.
« Le diable se cache dans les détails »
Le travail de Boldrini et collègues paru seulement trois semaines après celui de Sorrells et collègues soulève autant de questions qu’il n’en résout. En effet, il est a priori difficile d’expliquer une telle différence de conclusion sur deux études dont les méthodologies employées semblent en tout point identiques. Et c’est pourtant dans les détails des méthodes que se dissimule probablement la réponse à cette question, ou du moins une partie. En effet, les tissus cérébraux utilisés n’ont pas subi exactement le même traitement avant l’étape de détection immunohistochimique. Par exemple, le délai de prélèvement du cerveau après la mort des individus est en moyenne plus long dans le travail de Sorrells et collègues. Or, de nombreux marqueurs tels que DCX sont rapidement dégradés après la mort de l’individu, ce qui rend leurs détection plus difficile, voire impossible, lorsque le tissu n’est pas prélevé dans des conditions optimales. De plus, les différences dans les étapes de fixation, de conservation et de traitement des tissus entre les deux études sont autant d’éléments qui pourraient également expliquer pourquoi Boldrini et collègues mais pas Sorrells et collègues, ont été capables de détecter des nouveaux neurones dans le tissu adulte. Par ailleurs, Sorrells et collègues ont analysé uniquement une petite fraction de l’hippocampe alors que Boldrini et collègues ont analysé la totalité de l’hippocampe en utilisant des techniques de stéréologie. Cette différence de méthodologie est très importante, particulièrement pour la quantification de populations de cellules discrètes telles que de nouveaux neurones. Enfin, comme décrit précédemment, Boldrini et collègues ont restreint leur analyse aux sujets sains uniquement, tandis que Sorrells et collègues n’ont pas décrit les antécédents médicaux de leurs sujets, ce qui pourrait potentiellement compromettre l’interprétation de leurs résultats.
Les enseignements des résultats « positifs » et « négatifs »
Ces deux études illustrent l’importance de la méthodologie employée dans le but de tester une hypothèse scientifique. De manière générale, le questionnement scientifique bénéficie tout autant d’un résultat que l’on peut qualifier de « négatif » que d’un résultat dit « positif ». Dans le cas de la neurogenèse adulte, le résultat « positif » de Boldrini et collègues vient étayer l’hypothèse et les nombreuses observations en faveur d’une production de nouveaux neurones dans l’hippocampe humain adulte. Le résultat « négatif » de Sorrells et collègues est tout aussi important car il permet de mettre en évidence que de subtiles variations de méthodologies peuvent conduire à un résultat drastiquement différent, ici, l’absence d’observation de neurogenèse dans l’hippocampe adulte.
L’ensemble de ces travaux va permettre de mieux comprendre les données discordantes du passé et de guider les futures études afin d’une part de répliquer les observations de Boldrini et collègues, et d’autre part d’aller plus loin dans la compréhension du rôle de la neurogenèse adulte dans les fonctions cognitives chez les sujets jeunes et âgés.
Un peu de vocabulaire
Cellules souches = Cellules indifférenciées capables de générer des cellules différenciées par spécialisation cellulaire et de se maintenir dans l’organisme en se divisant.
Immunohistochimie = Méthode de détection d’une protéine sur une coupe de tissu basée sur la détection d’antigènes par un ou des anticorps
Facteur trophique = facteur relatif à la nutrition des organes ou des tissus (facteur de croissance par exemple)
Facteur de transcription = protéine nécessaire à l’expression de certains gènes
Hormone = substance chimique, biologiquement active, et permettant de transmettre des messages chimiques dans l’organisme
Métabolite = composé organique issu du métabolisme tel que le glucose
Niche neurogénique = microenvironnement favorable à la production de nouvelles cellules
Stéréologie = méthode d’analyse statistique permettant l’estimation de quantités telles que le nombre de cellules dans une structure
--------------------------------------------------------------------------------------------------------------------------------
Références
1 Human hippocampal neurogenesis drops sharply in children to undetectable levels in adults. Sorrells S.F., Paredes M.F., Cebrian-Silla A., Sandoval K., Qi D., Kelley K.W., James D., Mayer S., Chang J., Auguste K.I., Chang E.F., Gutierrez A.J., Kriegstein A.R., Mathern G.W., Oldham M.C., Huang E.J., Garcia-Verdugo J.M., Yang Z., Alvarez-Buylla A. Nature. 2018;555(7696):377-381.
2 Human Hippocampal Neurogenesis Persists throughout Aging. Boldrini M., Fulmore C.A., Tartt A.N., Simeon L.R., Pavlova I., Poposka V., Rosoklija G.B., Stankov A., Arango V., Dwork A.J., Hen R., Mann J.J. Cell Stem Cell. 2018 Apr 5;22(4):589-599.e5.
3 Neurogenesis in the adult human hippocampus. Eriksson P.S., Perfilieva E., Björk-Eriksson T., Alborn A.M., Nordborg C., Peterson D.A., Gage F.H. Nat Med. 1998;4(11):1313-7
4 Dynamics of hippocampal neurogenesis in adult humans. Spalding KL, Bergmann O, Alkass K, Bernard S, Salehpour M, Huttner HB, Boström E, Westerlund I., Vial C., Buchholz B.A., Possnert G., Mash D.C., Druid H., Frisén J. Cell. 2013;153(6):1219-1227.
--------------------------------------------------------------------------------------------------------------------------------
Alexandra Gros est docteure en neurosciences (Institut des neurosciences Paris-Saclay). Au cours de sa thèse, elle s’est intéressée au rôle de la neurogenèse adulte hippocampique dans les processus d’apprentissage et de mémoire, notamment épisodique. Alexandra est actuellement chercheuse post-doctorante à l’université d’Édimbourg où elle étudie comment la mise en mémoire et la persistance de souvenirs d’événements de la vie courante peuvent être affectées par un apprentissage ultérieur. Pour cela, elle cherche à élucider les mécanismes moléculaires et cellulaires sous-tendant ces processus, notamment via des mécanismes de « tagging » des neurones et synapses en utilisant l’expression des gènes immédiats précoces.
Antoine Besnard est docteur en neurosciences (2011, UPMC). Durant son doctorat, il a étudié les mécanismes moléculaires qui contrôlent les adaptations du cerveau en réponse à la cocaïne sous la direction de la Dr Jocelyne Caboche. En 2012, Antoine rejoint l’équipe du Dr Amar Sahay située au Massachusetts General Hospital (Boston). Il utilise des techniques optogénétiques afin de visualiser et contrôler l’activité des cellules du cerveau. Son travail vise à décoder les circuits neuronaux qui contrôlent la peur et l’anxiété. Ces études sont importantes puisque de nombreuses maladies psychiatriques perturbent ces circuits ainsi que ces comportements. Restaurer l’activité de ces circuits pourrait donc un jour permettre de soigner ou même prévenir ces maladies du cerveau. Twitter : @AntoineBesnard3