A la une
La maladie de Parkinson est une maladie neurodégénérative qui touche le système nerveux central et plus particulièrement un petit noyau au sein du cerveau, la substance noire ou locus niger. Elle fut décrite avec précision pour la première fois en 1817 par le médecin, géologue et paléontologue britannique James Parkinson dans son essai Essay on Shaking Palsy. Initialement appelé Paralysis agitans (Paralysie agitante), la maladie fut renommée plus tard maladie de Parkinson par le neurologue français Jean-Martin Charcot. La maladie de Parkinson est la deuxième maladie neurodégénérative la plus fréquente après la maladie d’Alzheimer (200000 personnes en France).
Cette maladie débute habituellement entre 45 et 70 ans et se caractérise par la présence d’un ensemble de symptômes progressifs : mouvements ralentis, tremblements, rigidité puis troubles cognitifs. Le diagnostic de la maladie est basé sur le constat des symptômes spécifiques des syndromes parkinsoniens : hypertonie musculaire (aspect penché en avant), tremblements à repos des extrémités (notamment du pouce), akinésie (lenteur d’initiation des mouvements avec une tendance à l’immobilité) ; mais aussi un panel d’autres symptômes moins spécifiques : dépression, difficulté dans la marche, altération de l’odorat, hypersalivation, micrographie (diminution de l’amplitude de la calligraphie), douleurs, chutes, dysarthrie (troubles de la parole), troubles du comportement en sommeil paradoxal, fatigue, insomnie et somnolence, troubles de la pression artérielle, troubles urinaires, troubles de la déglutition et troubles cognitifs voire une démence chez les patients âgés. Le diagnostic définitif de la maladie est obtenu par l’étude du cerveau via une scintigraphie cérébrale pour visualiser l’atteinte de structures cérébrales particulières comme le striatum.
Cette maladie induit la dégénération des neurones dopaminergiques de la substance noire, provoquant ainsi un déficit de dopamine, qui est un neurotransmetteur modulateur essentiel des fonctions motrices et psychiques (en renforçant certains comportements et jouant un rôle dans la motivation notamment). Elle est notamment indispensable au contrôle des mouvements du corps, de façon automatique, ce qui oblige les patients atteints de la maladie de Parkinson, de « penser » leurs mouvements. Ces neurones dopaminergiques modulent également l’activité d’un certain nombre de zones du cerveau, dont le fonctionnement se retrouvent alors altéré et entraine les symptômes observés. Etant donné l’atteinte progressive de la substance noire, les atteintes sur le reste du cerveau sont également progressives avec une compensation possible au départ, expliquant l’apparition progressive des symptômes. Néanmoins, lorsque la dégénération des neurones est trop importante, les compensations ne sont plus possibles et des symptômes apparaissent. Par exemple, les symptômes moteurs apparaissent lorsque 70% des neurones de la substance noire sont détruits. Les causes de la maladie sont encore mal connues et semblent être une combinaison entre prédisposition génétique (plusieurs gènes identifiés) et facteurs environnementaux.
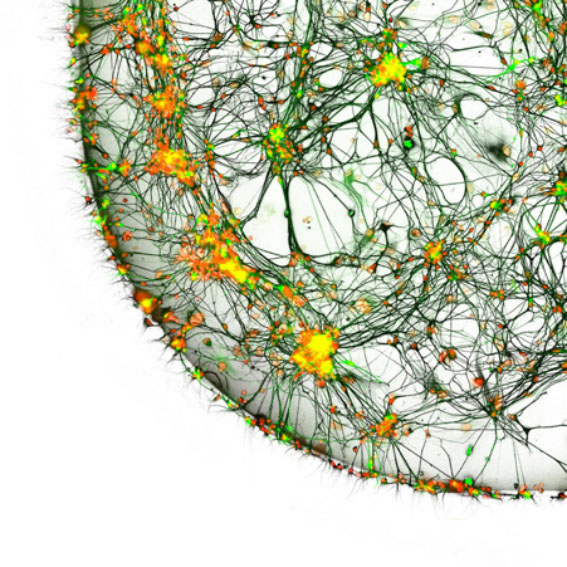
© Dr. Regis Grailhe, Nasia Antoniou & Dr. Rebecca Matsas, Institut Pasteur Korea, Department of Screening Sciences & Novel Assay Technology, Seongnam, South Korea / Nikon Small World
Cette image montre une culture de neurones provenant d’un patient atteint de la maladie de Parkinson, observée en microscopie confocale. Ces genre de cultures neuronales peuvent permettre d’étudier les modifications moléculaires et cellulaires liées à la pathologie, ainsi que de pouvoir tester de nouvelles molécules en vue du développement futur de traitement.
Aujourd’hui, la plupart des traitements disponibles traitent les symptômes de la maladie et visent à pallier le manque de dopamine. Les symptômes moteurs sont le plus souvent traités par de la L-DOPA qui est transformé en dopamine dans l’organisme, qu’il peut alors utiliser pour pallier le déficit induit par la destruction des neurones, mais qui s’accompagne d’un certain nombre d’effets secondaires (nausées, vomissements, troubles des comportements addictifs). Il existe aussi des agonistes de la dopamine, souvent utilisés avant la L-DOPA. Outre les traitements médicamenteux, la pratique régulière d’exercices, mais aussi la rééducation, sont également essentiels pour maintenir l’équilibre, la flexibilité et la motricité, car ces activités favoriseraient la sécrétion naturelle de dopamine. Depuis 1993, il existe également un traitement chirurgical mis au point à Grenoble, la stimulation cérébrale profonde (notamment connue comme DBS, deep brain stimulation), efficace sur les trois symptômes moteurs de la maladie mais qui n’est pratiquée que sur 5-10% des patients. Elle consiste en l’implantation de deux électrodes dans une région cérébrale précise, le noyau sous-thalamique, structura profonde impliquée dans les comportements moteurs. Grace à un stimulateur, de faibles impulsions électriques sont générées permettant d’interrompre les signaux provoquant les symptômes, sans effets secondaires. Néanmoins, ce traitement reste complémentaire aux traitements médicamenteux puisqu’il ne permet pas de traiter les autres symptômes de la maladie. Aujourd’hui, un grand nombre de nouvelles thérapies sont à l’étude pour de nouveaux traitements de la maladie (thérapie génique, cellules souches, chélateur de fer, antioxydants, voie sérotoninergique, voie cholinergique, stimulation magnétique transcrânienne).
--------------------------------------------------------------------------------------------------------------------------------
Alexandra Gros est docteure en neurosciences (Institut des neurosciences Paris-Saclay). Au cours de sa thèse, elle s’est intéressée au rôle de la neurogenèse adulte hippocampique dans les processus d’apprentissage et de mémoire, notamment épisodique. Alexandra est actuellement chercheuse post-doctorante à l’université d’Édimbourg où elle étudie comment la mise en mémoire et la persistance de souvenirs d’événements de la vie courante peuvent être affectées par un apprentissage ultérieur. Pour cela, elle cherche à élucider les mécanismes moléculaires et cellulaires sous-tendant ces processus, notamment via des mécanismes de « tagging » des neurones et synapses en utilisant l’expression des gènes immédiats précoces.