A la une
Lorsque l’on pense recherche scientifique en neurosciences, on se figure le plus souvent des études menées chez l’homme (le plus souvent en imagerie cérébrale) ou bien chez l’animal. Et l’animal en question, dans la plupart des études, se résume le plus souvent aux rongeurs, rats et souris. Ce ne sont pourtant pas les seuls modèles animaux étudiés, d’autres espèces ont bien des choses à nous apprendre sur le fonctionnement du cerveau. Parmi ces espèces figurent notamment les oiseaux.
On dénombre quelque 9 000 espèces d’oiseaux dans le monde dont près de la moitié appartiennent au groupe des oiseaux chanteurs. Mésange, chardonneret, étourneau, moineau, rouge-gorge, merle en sont quelques exemples que l’on croise régulièrement dans nos jardins et parcs. Dans les volières des laboratoires, on rencontre le plus souvent les canaris domestiques et les diamants mandarin. Ces deux espèces s’accommodent aisément à la vie en captivité : elles s’y reproduisent sans problème et les mâles y chantent facilement.
De grandes différences selon les espèces
A l’oreille humaine, les chants des canaris et des diamants mandarin sonnent très différemment. En effet, alors que le chant du canari est très mélodieux et peut durer plusieurs dizaines de secondes, celui du mandarin est plus court et plus bruité (figure 1). Le chant d’un canari est composé d’une suite de notes répétées, constituant des phrases et un individu donné est capable de connîitre plusieurs dizaines de notes différentes. Bien que l’enchaînement des phrases d’un chant ne soit pas totalement fixe, il n’est pour autant pas aléatoire. Un canari peut par ailleurs modifier son chant d’une année à l’autre, ce qui démontre une plasticité saisonnière de ce comportement, caractéristique fréquente chez les oiseaux des milieux tempérés.
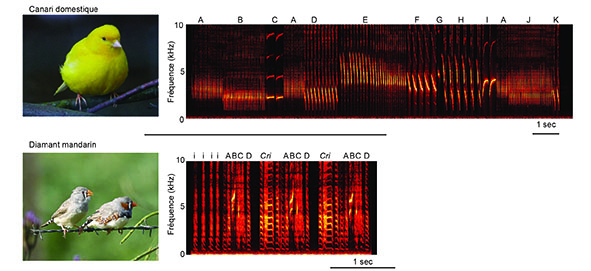
Figure 1 :
En haut : Canari domestique (© photo CC-BY-SA-3.0 4028mdk09) et spectrogramme d’un chant (fréquence en fonction du temps, l’énergie étant donnée par le gradient de couleur allant du noir – pas d’énergie – vers le jaune – énergie maximale). Ce chant est composé de 11 phrases différentes (A à K), chacune étant composée de la répétition de plusieurs notes.
En bas : Couple de diamants mandarin (femelle à gauche et mâle à droite. © photo CC BY-SA 2.0 Lip Kee Yap) et spectrogramme d’un chant de diamant mandarin composé de 4 notes (ABCD) précédées de notes introductives (i). Ce chant est reproduit deux fois en alternance avec des cris.
En comparaison, le chant d’un diamant mandarin est acoustiquement beaucoup plus simple. Il est généralement constitué d’une suite de 4 à 8 notes non répétées et produites dans une séquence très stéréotypée (figure 1) qui reste fixe pendant toute la vie de l’oiseau. Contrairement au canari, le diamant mandarin ne présente donc pas de plasticité saisonnière de son chant, même s’il peut le modifier subtilement dans certaines conditions.
Si chez les canaris comme chez les diamants mandarins, seuls les mâles chantent, chez certaines espèces d’oiseaux chanteurs, comme l’étourneau sansonnet, les femelles chantent autant que les mâles. Pour autant, toute espèce d’oiseaux chanteurs confondus, le comportement de chant reste plus fréquent chez les mâles et a été associé à des fonctions de défense territoriale et d’attirance des femelles. Au-delà de ses fonctions, le chant des oiseaux chanteurs est un comportement particulier puisqu’il est appris socialement : en effet, un jeune apprend son chant en imitant ses congénères.
Chanter, tout un apprentissage
Le plus souvent, un oiseau juvénile apprend à imiter le chant d’un adulte. Par exemple, l’apprentissage du chant des diamants mandarins s’opère en trois mois environ. Pendant les premières semaines, le juvénile mémorise le chant de son tuteur, généralement son père. Puis, il commence à pratiquer son chant. Lors des premiers essais, le chant ressemble à une forme de babillage. À force de répétitions, le juvénile produira un chant qui progressivement ressemblera de plus en plus à celui de son tuteur. À l’âge adulte, le chant du diamant mandarin se cristallise : il se fixe et ne sera plus modifié en conditions normales.

Figure 2 : Phases d’apprentissage du chant chez le diamant mandarin (crédit : Nicolas Giret).
A. Phase de mémorisation du chant du tuteur : le juvénile (oiseau de gauche) écoute son tuteur (oiseau de droite) produire un chant (représenté en haut, sous la forme d’un spectrogramme). Le chant est composé des notes A à F.
B. Phase de pratique sensorimotrice du chant : le juvénile commence à chanter aux alentours de son 40e jour post-éclosion. Deux exemples de chant sont montrés : un chant produit à son 40e jour (à gauche) et un chant produit à son 70e jour. On peut voir que le premier chant produit est très différent de celui du tuteur et que petit à petit il se rapproche de celui du tuteur.
C. Cristallisation du chant : devenu adulte, l’oiseau produit un chant cristallisé qui ressemble en partie à celui de son tuteur. Après 4 notes introductives (i), l’oiseau produit les notes C, D, E, et F copiées de son tuteur et réorganisées dans une nouvelle séquence.
Le chant des oiseaux est donc un comportement appris socialement impliquant un apprentissage vocal sensorimoteur, ce qui correspond à la capacité de modifier les vocalisations produites (le versant moteur) en fonction des sons perçus (le versant sensoriel). Si cette capacité est très répandue chez les oiseaux – elle concerne non seulement les oiseaux chanteurs, mais aussi les perroquets, perruches et les colibris – elle est en revanche largement moins répandue chez les mammifères. Hormis les humains, seuls quelques mammifères marins (cétacés, dauphins, phoques), les chauves-souris, les éléphants et dans une moindre mesure quelques primates (notamment le Ouistiti à toupets blancs) montrent cette capacité.
Qui plus est, en dépit des différences anatomiques du cerveau des oiseaux et de celui des humains (absence de couche corticale notamment chez les oiseaux), le cerveau des oiseaux comprend un réseau de structures cérébrales spécialement dédiées au comportement de chant, à son apprentissage, sa perception et sa production. Depuis les travaux pionniers de Fernando Nottebohm dans les années 1970 ayant mis en lumière ce réseau de structures cérébrales, couramment appelé « système du chant », de considérables avancées ont été réalisées et permettent de mieux comprendre les mécanismes neuronaux impliqués dans le comportement du chant.
Le HVC (acronyme utilisé comme nom propre) par exemple est une structure qui joue un rôle critique dans la production du chant. Il se place à l’interface des structures impliquées dans la perception et la production du chant (figure 3). Des enregistrements électrophysiologiques ont pu mettre en évidence que certains neurones constitutifs de cette structure s’activent de façon très précise et le plus souvent à un moment particulier du chant, ces neurones restant inactifs lorsque l’oiseau ne chante pas. En multipliant les enregistrements, les études récentes ont démontré que chaque neurone du HVC s’active à des moments différents les uns des autres, couvrant ainsi l’ensemble du chant. Cela suggère que les neurones du HVC s’activent successivement, selon une chaîne synchronisée (« synfire chain »). Cette propriété particulière des neurones du HVC s’acquiert lors de l’apprentissage du chant.
Neurones miroirs
De plus, plusieurs études ont mis en évidence que les neurones du HVC sont essentiels pour générer la commande motrice permettant la production du chant. Une étude surprenante a notamment mis en évidence qu’en réduisant la température du HVC, les diamants mandarin se mettaient à chanter au ralenti, démontrant ainsi, non seulement, le rôle du HVC dans la production du chant, mais aussi, dans la régulation du tempo du chant. Plus étonnant, si les neurones du HVC génèrent les messages moteurs permettant la production du chant, ils peuvent aussi s’activer en réponse à la diffusion acoustique de chants. Ces activations ont été enregistrées chez des oiseaux anesthésiés, endormis ou éveillés mais n’étant pas en train de chanter. De plus, ces réponses sont spécifiques du propre chant de l’oiseau.
Il a par ailleurs été établi que certains neurones du HVC s’activent de façon similaire lorsque l’oiseau chante ou écoute son propre chant (sans le chanter), révélant ainsi une propriété de neurone miroir. Ces neurones miroirs ont été initialement identifiés chez des macaques et ont pour particularité de s’activer lorsqu’un individu effectue une action ou observe un autre individu réaliser la même action. La découverte de neurones miroirs dans le HVC des oiseaux chanteurs a alors soulevé une hypothèse importante selon laquelle l’apprentissage du langage chez l’homme pourrait lui aussi impliquer des neurones miroirs. Bien qu’aucune étude à l’heure actuelle n’ait pu valider ou invalider cette hypothèse, des neurones miroirs ont été identifiés dans différentes structures cérébrales du cerveau des humains, laissant la porte ouverte à cette hypothèse. On comprend aisément que les recherches sur les oiseaux représentent un enjeu important pour appréhender les mécanismes neurobiologiques qui sous-tendent l’apprentissage du langage chez l’homme.
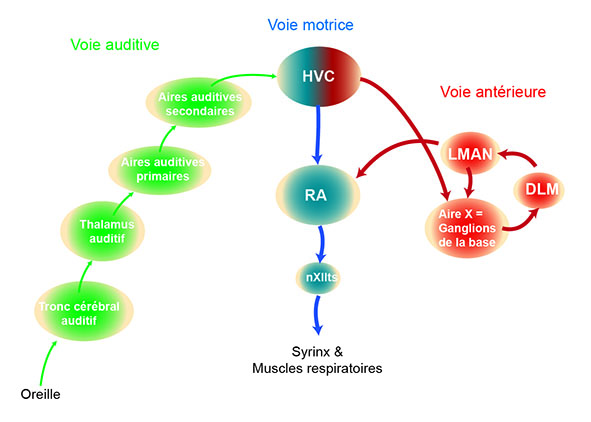
Figure 3 : Schéma montrant les structures principales impliquées dans la perception, la production et l’apprentissage du chant. (crédit : Nicolas Giret).
En vert : structures de la voie auditive impliquées dans le traitement auditif, c’est-à-dire dans le traitement des sons en provenance de l’extérieur et captés par l’oreille.
En rouge : structures de la voie antérieure impliquées notamment dans l’apprentissage et la variabilité du chant (LMAN : Noyau latéral du nidopallium antérieur, Aire X : Aire X, DLM : noyau dorso-latéral du thalamus).
En bleu : structures de la voie motrice impliquées notamment dans la production du chant (HVC : HVC, RA : noyau robuste de l’arcopallium, nXIITS : noyau trachéosyringé). Ces structures projettent sur les muscles de l’organe de production du chant, appelé syrinx, et sur les muscles respiratoires.
Les aires auditives (en vert) convergent sur le HVC qui est à la base de la voie antérieure (en rouge) et de la voie motrice (en bleu).
Depuis les toutes premières découvertes de Fernando Nottebohm, de nombreuses études menées chez les oiseaux chanteurs se sont intéressées à d’autres structures cérébrales que le HVC et ont ainsi permis de mettre en évidence l’existence de multiples mécanismes impliqués dans ce comportement de chant. Que soit le rôle de la dopamine ou de la noradrénaline, du sommeil, des interactions entre différentes structures cérébrales, l’intrication des traitements auditifs et des processus moteurs, les études chez les oiseaux chanteurs permettent de mieux comprendre le fonctionnement du cerveau en lien avec l’expression d’un comportement faisant appel à des processus cognitifs complexes (par ex. : mémorisation, imitation, sensorimotricité). Les oiseaux n’ont pas fini de nous étonner et de nous aider dans notre compréhension du cerveau.
L’émission « Sur les épaules de Darwin » de Jean-Claude Ameisen du 11 février 2017 a été consacrée à ce sujet : https://www.franceinter.fr/emissions/sur-les-epaules-de-darwin/sur-les-epaules-de-darwin-11-fevrier-2017
--------------------------------------------------------------------------------------------------------------------------------
Pour plus d’informations :
Hahnloser, R.H.R., Kozhevnikov, A.A., Fee, M.S., 2002. An ultra-sparse code underlies the generation of neural sequences in a songbird. Nature 419, 65–70. doi:10.1038/nature00974
Hamaguchi, K., Tschida, K.A., Yoon, I., Donald, B.R., Mooney, R., 2014. Auditory synapses to song premotor neurons are gated off during vocalization in zebra finches. Elife 3, e01833.
Nottebohm, F., Stokes, T.M., Leonard, C.M., 1976. Central control of song in the canary, Serinus canarius. J. Comp. Neurol. 165, 457–486. doi:10.1002/cne.901650405
Long, M.A., Fee, M.S., 2008. Using temperature to analyse temporal dynamics in the songbird motor pathway. Nature 456, 189–194. doi:10.1038/nature07448
Okubo, T.S., Mackevicius, E.L., Payne, H.L., Lynch, G.F., Fee, M.S., 2015. Growth and splitting of neural sequences in songbird vocal development. Nature advance online publication. doi:10.1038/nature15741
Prather, J.F., Peters, S., Nowicki, S., Mooney, R., 2008. Precise auditory-vocal mirroring in neurons for learned vocal communication
--------------------------------------------------------------------------------------------------------------------------------
Nicolas Giret est chargé de recherche (CR2) du CNRS dans l’équipe de Catherine Del Negro et Jean-Marc Edeline à l’Institut des Neurosciences Paris-Saclay. Durant son doctorat, il a étudié les capacités cognitives des perroquets en lien avec leur système de communication sous la direction de Dalila Bovet et Michel Kreutzer. En 2010, il rejoint l’équipe de Richard Hahnloser à l’université de Zürich où il a étudié les mécanismes neurobiologiques impliqués dans l’apprentissage et la production du chant des oiseaux chanteurs. Il poursuit aujourd’hui ces études en associant des analyses comportementales à des méthodes électrophysiologie, des approches lésionnelles ou encore des stimulations électriques.