A la une
Surprise dans le domaine des neurosciences : une petite région enfouie profondément dans le cerveau, l’amygdale centrale (Figure 1), largement étudiée pour son implication dans les réponses de peur, vient de se voir attribuer une nouvelle fonction completement inattendue. En effet, dans une récente étude, l’équipe du Dr. de Araujo (Yale University, New Haven) vient de démontrer chez la souris son implication dans le comportement de prédation (Han et al., Cell, 2017). Si la peur et la prédation semblent diamétralement opposées, elles remplissent néanmoins une fonction convergente : la survie de l’individu.
Le travail présenté dans ce billet décrit comment l’amygdale centrale contribue à la coordination des muscles qui initient la pourchasse de la proie et de ceux qui délivrent la morsure fatale. Les auteurs ont utilisé des outils génétiques, pharmacologiques, électrophysiologiques et optiques qui permettent d’étudier les circuits du cerveau avec une précision inégalée. Ces techniques incluent les approches d’ablation sélectives, d’optogénétique, de pharmacogénétique et de traçage des circuits qui feront l’objet d’un nouveau billet la semaine prochaine.
Figure 1 : L’amygdale centrale est une petite région cérébrale hétérogène impliquée dans les réponses de peur et de prédation © Giuseppe Gangarossa
Les auteurs ont dans un premier temps utilisé des approches optogénétiques et pharmacogénétiques afin de stimuler ou d’inhiber spécifiquement et sélectivement les neurones de l’amygdale centrale. De manière surprenante, la stimulation de ces neurones induit immédiatement un comportement de chasse de proies vivantes (criquets) et artificielles (non comestibles). Les auteurs ont également observé une augmentation de l’activité des muscles de la mâchoire et du cou accompagnée de postures typiquement observée lorsqu’une souris chasse un insecte.
La question qui se pose alors est : comment l’amygdale centrale, une structure composée exclusivement de neurones inhibiteurs, favorise ce comportement de prédation (et ne l’inhibe pas) ? Pour répondre à cette question, les auteurs ont alors mené des études de traçage de circuit. Ils ont ainsi identifiés deux régions d’intérêts : la formation réticulaire parvocellulaire située dans le tronc cérébral (Figure 2) et la substance grise périaqueducale située en amont de la moelle épinière (Figure 3). De manière intéressante, les auteurs ont observés que les neurones inhibiteurs de l’amygdale centrale (neurones bleus) projettent directement à la fois sur des neurones excitateurs (neurones rouges) et inhibiteurs dans chacune de ces deux régions. Les auteurs ont donc cherché à comprendre la contribution spécifique de ces deux différentes projections de l’amygdale centrale.
Pour cela, ils ont dans un premier temps combiné des approches d’optogénétique, de pharmacogénétique et d’ablation ciblée entre l’amygdale centrale et la formation réticulaire parvocellulaire (Figure 2). Ils ont ainsi découvert que dans cette première structure l’amygdale centrale contrôle les muscles qui délivrent la morsure fatale, mais pas le comportement de pourchasse. Plus fort encore, ce mécanisme implique un processus de désinhibition. En effet, en atténuant l’activité des neurones inhibiteurs situés dans la formation réticulaire parvocellulaire, les neurones inhibiteurs de l’amygdale centrale lèvent ainsi le frein pesant sur les motoneurones du tronc cérébral (neurones verts) qui mobilisent les muscles de la mâchoire et du cou au repos (comparer la situation au repos Figure 2A et la situation de morsure Figure 2B, l’épaisseur des lignes indique la prédominance de l’un ou l’autre des systèmes). Les auteurs rapportent aussi que les neurones de l’amygdale centrale projettent également sur les neurones excitateurs mais ceux-ci semblent ne pas prendre part à l’initiation de la morsure.
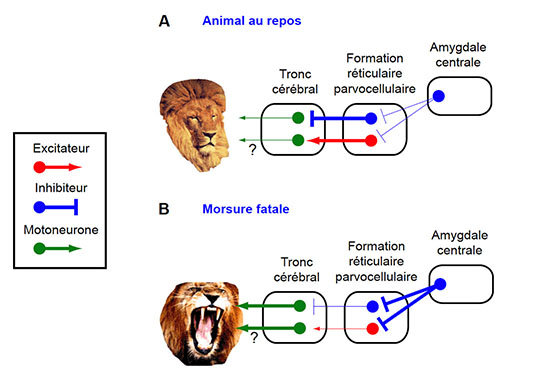
Figure 2 : L’amygdale centrale contrôle les muscles qui délivrent la morsure fatale © Antoine Besnard
Dans une série d’expériences analogues conduites cette fois entre l’amygdale centrale et la substance grise périaqueducale, les auteurs ont découvert que ce circuit contrôle les muscles qui initient la pourchasse de la proie, mais pas la morsure fatale (Figure 3). A nouveau, un mécanisme de désinhibition permet l’initiation de la pourchasse de la proie, mais cette fois en inhibant les neurones excitateurs localisés dans la substance grise périaqueducale. Ces neurones excitateurs préviennent l’initiation de la pourchasse de la proie en contrôlant une autre population de neurones non-identifiée (neurones gris) et localisée dans la région locomotrice mésencéphalique qui semble à son tour inhiber les motoneurones localisés dans la moelle épinière (comparer la situation au repos Figure 3A et la situation de pourchasse Figure 3B, l’épaisseur des lignes indique la prédominance de l’un ou l’autre des systèmes).
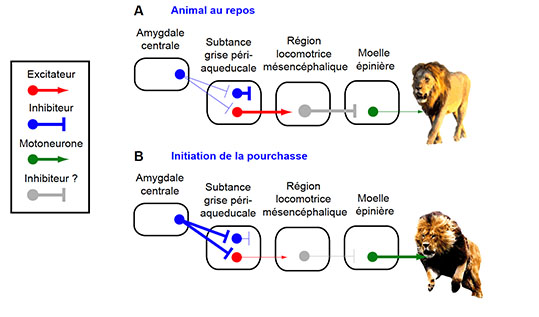
Figure 3 : L’amygdale centrale contrôle les muscles qui initient la pourchasse de la proie © Antoine Besnard
Les auteurs se sont ensuite posés la question suivante : est-ce que les neurones de l’amygdale centrale, qui contrôlent la morsure fatale, sont les mêmes que ceux qui initient la pourchasse de la proie ?
Pour répondre à cette question, les auteurs ont mené une série d’études de traçage, d’optogénétiques et d’ablation ciblée de ces deux circuits dans les mêmes souris afin de confirmer leur contribution exclusive à l’une ou l’autre des fonctions. De manière intéressante, ces deux circuits impliquent des populations de neurones différents dans l’amygdale centrale. L’activation conjointe de ces deux circuits résulte en une activation dramatique du comportement de prédation (Figure 4).
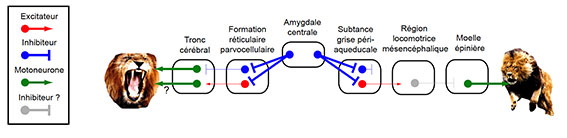
Figure 4 : Les circuits qui initient la morsure et la pourchasse ont des origines différentes dans l’amygdale centrale © Antoine Besnard
Grâce à une combinaison de techniques innovantes, les auteurs de cette étude ont mis en évidence dans l’amygdale centrale l’implication de deux circuits neuronaux inhibiteurs distincts dans le comportement de prédation. Un premier circuit contrôlant indirectement l’activité des neurones moteurs dans le tronc cérébral via la formation réticulaire parvocellulaire est responsable de la coordination des muscles du cou et de la mâchoire qui permet de délivrer la morsure fatale. Le second circuit contrôlant indirectement les neurones moteurs dans la moelle épinière via la substance grise périaqueducale est lui responsable de l’initiation de la pourchasse de la proie.
Néanmoins, cette étude remarquable soulève autant de questions qu’elle n’apporte de réponses et ouvre de nombreuses pistes de réflexions. En effet, l’amygdale centrale a longtemps été décrite comme le siège de la génération des réponses de peur. Une étude récente publiée dans la revue Nature décrit notamment l’implication d’un circuit amygdale centrale-substance grise périaqueducale-moelle épinière dans la génération des réponses de peur (Tovote et al., Nature, 2016). Il serait donc très intéressant de déterminer si ces deux circuits communiquent ensemble, puisque leurs fonctions semblent a priori opposées.
Une autre observation frappante concerne la spécificité du comportement étudié. Comme le soulignent les auteurs, la manipulation de l’amygdale centrale induit la prédation, mais pas l’agression. En effet, les attaques ne sont dirigées que vers des proies vivantes (criquets) ou factices, mais jamais envers des congénères. Ces résultats contrastent fortement avec la récente démonstration du rôle de l’amygdale médiale dans l’agression (Hong et al., Cell, 2014). Ces observations indiquent qu’une région du cerveau telle que l’amygdale peut remplir des fonctions bien distinctes selon la nature des populations neuronales qu’elle innerve. La division de ces tâches est parfois organisée en subdivisions anatomiques facilement identifiables (telles que l’amygdale centrale et médiale) mais implique parfois des populations de neurones indiscernables à l’œil nu (tels que les neurones de l’amygdale centrale projetant vers la substance grise et la formation réticulaire parvocellulaire).
Enfin, comme le rappellent les auteurs de cette étude, l’apparition de la mâchoire articulée a permis de placer les vertébrés au sommet de la chaine alimentaire. Ces transformations morphologiques se sont ainsi accompagnées de l’apparition de nouveaux circuits neuronaux capables de coordonner les muscles de la tête et du corps. Il n’est donc pas surprenant de constater que l’amygdale centrale est une structure présente chez toutes les espèces de vertébrés à l’exception de la lamproie, ce poisson dépourvu de mâchoire mobile.
--------------------------------------------------------------------------------------------------------------------------------
Références d’intérêt
1. Integrated Control of Predatory Hunting by the Central Nucleus of the Amygdala.
Han W, Tellez LA, Rangel MJ Jr, Motta SC, Zhang X, Perez IO, Canteras NS, Shammah-Lagnado SJ, van den Pol AN, de Araujo IE.
Cell. 2017 Jan 12;168(1-2):311-324.e18. doi: 10.1016/j.cell.2016.12.027.
2. Midbrain circuits for defensive behaviour.
Tovote P, Esposito MS, Botta P, Chaudun F, Fadok JP, Markovic M, Wolff SB, Ramakrishnan C, Fenno L, Deisseroth K, Herry C, Arber S, Lüthi A.
Nature. 2016 Jun 9;534(7606):206-12. doi: 10.1038/nature17996.
3. Antagonistic control of social versus repetitive self-grooming behaviors by separable amygdala neuronal subsets.
Hong W, Kim DW, Anderson DJ.
Cell. 2014 Sep 11;158(6):1348-61. doi: 10.1016/j.cell.2014.07.049
--------------------------------------------------------------------------------------------------------------------------------
Antoine Besnard est Docteur en Neurosciences (2011, UPMC). Durant son doctorat, il a étudié les mécanismes moléculaires qui contrôlent les adaptations du cerveau en réponse à la cocaïne sous la direction de la Dr. Jocelyne Caboche. En 2012, Antoine rejoint l’équipe du Dr. Amar Sahay situé au Massachusetts General Hospital (Boston). Il utilise des techniques optogénétiques afin de visualiser et contrôler l’activité des cellules du cerveau. Son travail vise à décoder les circuits neuronaux qui contrôlent la peur et l’anxiété. Ces études sont importantes puisque de nombreuses maladies psychiatriques perturbent ces circuits ainsi que ces comportements. Restaurer l’activité de ces circuits pourrait donc un jour permettre de soigner ou même prévenir ces maladies du cerveau. Twitter : @AntoineBesnard3