A la une
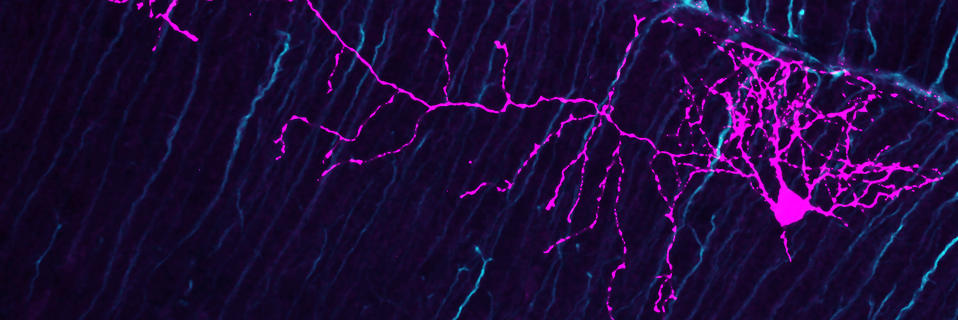
En microscopie optique classique, l’obtention d’une image nette suppose que l’on puisse faire la mise au point sur l’objet analysé et nécessite donc qu’il se situe dans le plan focal du système optique. Lorsqu’un objet est épais, il n’est possible d’obtenir la mise au point que sur une partie de l’objet, laissant le reste flou. De plus, lors de l’observation de coupes de tissus en fluorescence, la lumière émise par le plan focal est noyée dans la fluorescence totale du tissu, rendant impossible la localisation précise de l’émission initiale. À la fin des années 1980, un nouveau type de microscopie est apparu, appelé microscopie confocale, révolutionnant l’exploration de l’anatomie cellulaire et moléculaire et rendant possible l’observation précise, en 2D et en 3D, des cellules et des molécules au sein d’un tissu.
La particularité de ce type de microscopie est de réaliser des images de très faible épaisseur (< 1µm) afin de localiser très précisément la position d’une cellule au sein d’un tissu, mais aussi d’une molécule au sein d’une cellule. Pour cela, la microscopie confocale utilise non pas la lumière blanche mais un faisceau laser qui permet d’obtenir une image nette en tout point et d’épaisseur définie correspondant uniquement au plan focal. En faisant varier ce dernier, on obtient une succession d’images nettes et précises permettant d’avoir une image en 3D de l’objet observé. La microscopie permet l’observation de tissus fixés, c’est-à-dire qui n’évoluent plus dans le temps, mais aussi de phénomènes dynamiques (dynamique cellulaire, moléculaire, processus d’interaction, etc.) via le suivi d’un même tissu ou d’une même cellule au cours du temps. L’utilisation de plusieurs lasers de longueurs d’ondes différentes permet également d’analyser jusqu’à 4 molécules fluorescentes simultanément, rendant possible l’observation au même endroit de plusieurs molécules et ainsi l’étude des fonctions physiologiques et des interactions biologiques.
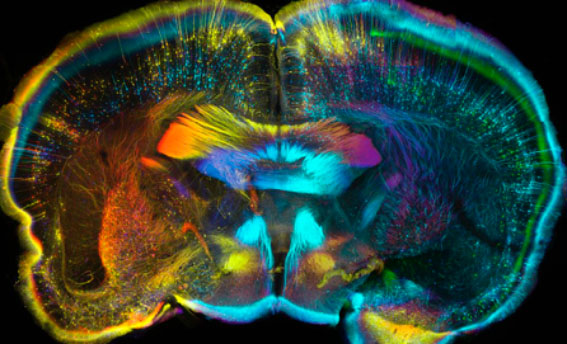
© Luis de la Torre-Ubieta, Geschwind Laboratory, UCLA
L’image présentée ci-dessus est une section de cerveau de souris. Pour créer cette image, l’auteur a, dans un premier temps, rendu le tissu optiquement transparent (voir le billet L’image de la semaine « Et s’il devenait possible de regarder à travers les organes ? ») afin de pouvoir regarder dans la profondeur du tissu. L’expression de la protéine GFP permet de visualiser, en microscopie confocale à fluorescence, la localisation d’une certaine population de neurones au sein de la section de cerveau observée. Environ 140 images individuelles de 5,3 µm d’épaisseur ont été réalisées à travers la section épaisse de 751 µm, pour ensuite être combinées en une image unique visible ci-dessus. La position des neurones au sein de la section est codée en couleur – la couleur donne donc la profondeur des neurones dans l’échantillon, du rouge (= haut de la section) au vert (= bas de la section).
--------------------------------------------------------------------------------------------------------------------------------
Alexandra Gros est docteure en neurosciences (Institut des neurosciences Paris-Saclay). Au cours de sa thèse, elle s’est intéressée au rôle de la neurogenèse adulte hippocampique dans les processus d’apprentissage et de mémoire, notamment épisodique. Alexandra est actuellement chercheuse post-doctorante à l’université d’Édimbourg où elle étudie comment la mise en mémoire et la persistance de souvenirs d’événements de la vie courante peuvent être affectées par un apprentissage ultérieur. Pour cela, elle cherche à élucider les mécanismes moléculaires et cellulaires sous-tendant ces processus, notamment via des mécanismes de « tagging » des neurones et synapses en utilisant l’expression des gènes immédiats précoces.