A la une
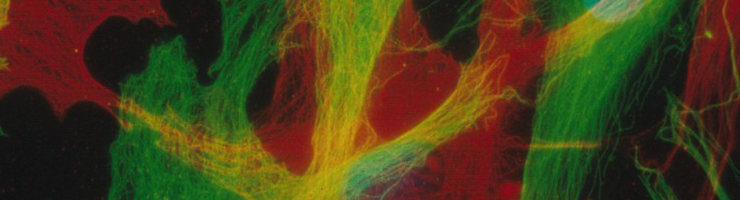
En combinant une approche par modélisation numérique et des expérimentations en biologie à la fois structurale et cellulaire, le projet APERTuRe a permis de mieux comprendre la dynamique d’un réseau de protéines dans le cytoplasme de nos cellules. Des résultats qui pourraient être utiles pour développer de nouveaux médicaments.
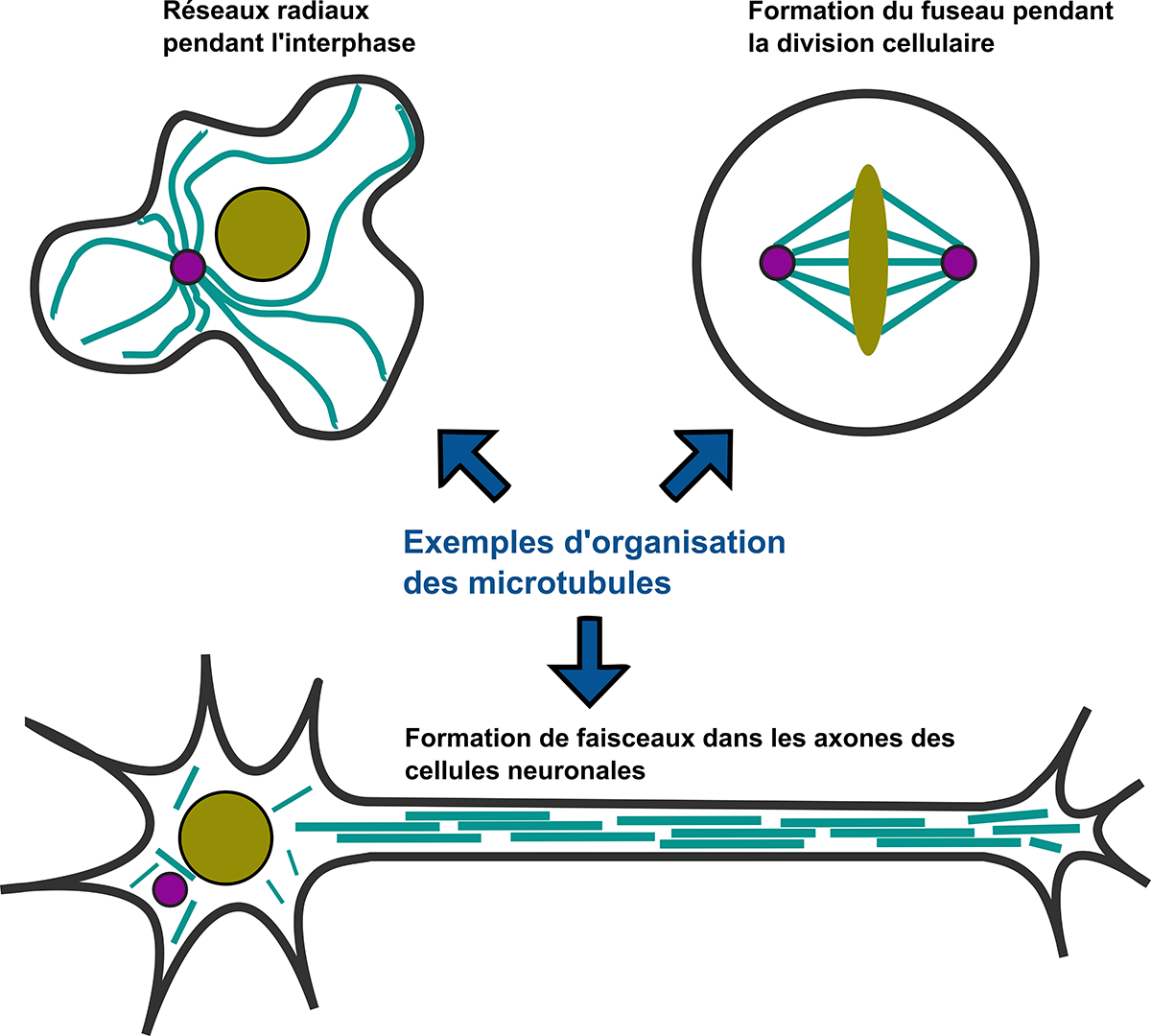
Omniprésents dans notre corps, les microtubules font partie du squelette des cellules, le cytosquelette. Ces tubes fins jouent un rôle essentiel dans le fonctionnement de notre organisme, tant au niveau de la division cellulaire que de la migration et du transport cellulaire. Constitués de tubuline, l’une des protéines les plus abondantes de nos cellules, ces filaments polymériques creux mesurent quelques dizaines de micromètres de long et forment des réseaux complexes d’architectures variées pour remplir leurs différentes fonctions cellulaires.
À ce titre, les microtubules sont des cibles privilégiées pour traiter des cancers et des maladies neurodégénératives : le Taxol, par exemple, médicament le plus répandu pour lutter contre le cancer du sein, s’attache à stabiliser les microtubules, de manière à perturber la division cellulaire. En plus d’être une question centrale de biologie cellulaire, comprendre la dynamique des microtubules apparaît donc comme un enjeu majeur dans le domaine de la santé.
Depuis trente ans, la recherche s’est surtout concentrée sur les phénomènes de croissance et de raccourcissement qui se produisent par l’accrochage ou le décrochage de dimères (des molécules composées de deux unités) aux extrémités des microtubules. Mais que se passe-t-il au niveau des parois ? Telle est la question soulevée par les expériences d’une doctorante au Commissariat à l’énergie atomique et aux énergies alternatives (CEA) de Grenoble, Laura Schaedel, qui observe l’incorporation spontanée de tubuline dans la paroi d’un microtubule : cela signifie que les microtubules sont capables de renouveler leurs propres éléments constitutifs et de s’autoréparer loin de leurs extrémités. De cette « nouvelle perspective sur la régulation des microtubules » est né le projet APERTuRe (acronyme de « A new PERspective on microTubule Regulation ») : coordonné par Karin John, chercheuse en biophysique au Laboratoire Interdisciplinaire de Physique (LIPHy)[1], il est retenu et financé par l’Agence nationale de la recherche de 2019 à 2024.
Interdisciplinarité fructueuse
Alors qu’elle-même travaille sur la modélisation mathématique du cytosquelette, Karin John collabore avec Denis Chrétien, spécialiste de biologie structurale à l’Institut de Génétique et de Développement de Rennes (IGDR), et Manuel Théry, chercheur en biologie cellulaire au CEA de Grenoble, de manière à réaliser des expériences dans ces deux domaines. « Mener un travail de recherche collaborative était indispensable pour étudier la dynamique d’un réseau de microtubules le long de leurs parois car il est difficile d’observer les échanges à la fois de manière dynamique et à la bonne échelle », explique Karin John.
En effet, la cryo-microscopie, méthode de référence pour étudier la structure des microtubules, qui consiste à refroidir un échantillon en le plongeant dans une solution de nitrogène liquide, ne permet d’examiner la structure du microtubule que de façon statique. La dynamique du réseau, elle, peut être observée grâce à la microscopie en fluorescence mais seulement à l’échelle de quelques centaines de nanomètres, alors que le diamètre d’un microtubule mesure une vingtaine de nanomètres. D’où l’intérêt de combiner les deux approches et de compléter les expériences par la modélisation car, indique Karin John, « l’étape numérique permet de vérifier quelles hypothèses sont cohérentes avec les observations expérimentales de ces deux approches. »
Spécialiste de microscopie en fluorescence, l’équipe de Manuel Théry au CEA de Grenoble a suivi l’incorporation spontanée de tubuline dans la paroi du réseau de microtubules. Concrètement, la manipulation consiste à colorer le microtubule dans une teinte, et la tubuline libre dans une autre. « Si la résolution n’est pas assez précise pour suivre l’incorporation de la molécule seule dans la paroi, nous avons réussi à visualiser l’incorporation localisée de plusieurs dizaines de dimères de tubuline, se félicite Karin John : après une dizaine de minutes, des taches colorées de tubuline se retrouvent dans le microtubule, signe de son incorporation dans la paroi. »
Responsable scientifique de la plateforme MRIc-TEM de Rennes, Denis Chrétien avait, de son côté, déjà observé que plus la croissance d’un microtubule est rapide, plus le nombre de défauts topologiques sur sa paroi augmente. Les expériences de cryo-microscopie réalisées dans le cadre du projet ANR ont permis d’aller plus loin, en montrant que le nombre d’incorporations de tubuline dans la paroi augmente lui aussi avec la vitesse de croissance, et donc qu’il existe un lien indirect entre la quantité de défauts du réseau de microtubules et le renouvellement spontané de la tubuline.
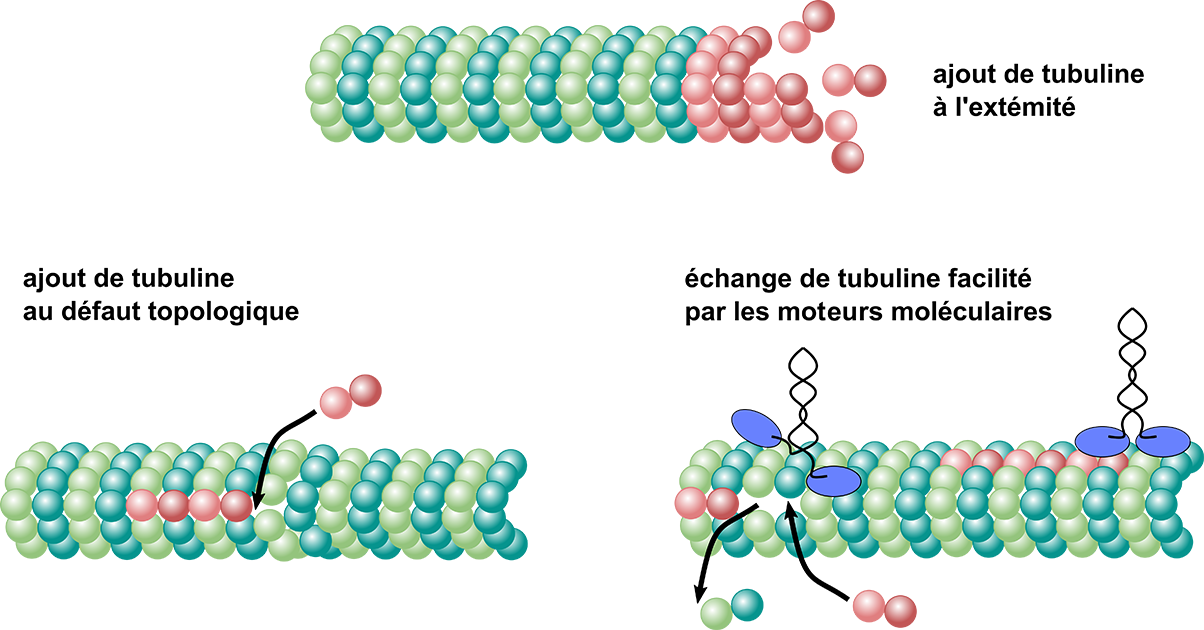
À partir de ces résultats, les simulations numériques ont permis de proposer un modèle dans lequel la dynamique du réseau est accélérée par la structure perturbée du réseau dans le voisinage d’un défaut. C’est ainsi qu’en associant approche théorique et expériences, le projet APERTuRe a démontré l’existence d’échanges de tubuline localisés dans les parois des microtubules, liés aux défauts topologiques.
À la suite de cette découverte, la recherche sur la dynamique de réseau dans les microtubules s'est intensifiée, tant au niveau structurel qu'au niveau dynamique. Ainsi, d'autres expériences et simulations, également dans le cadre du projet APERTuRe, ont permis d'établir que la structure du réseau et la dynamique dans la paroi des microtubules sont bien plus variées qu'on ne l’imaginait. Par exemple, des structures de trous inédites et spécifiques aux microtubules ont été découvertes. De plus, il a été constaté que les moteurs moléculaires qui se déplacent le long des microtubules peuvent générer une dynamique de réseau indépendante des structures de défauts topologiques.
Perspectives théoriques et thérapeutiques
S’ils ont ouvert de nouvelles perspectives de recherche, les résultats du projet APERTuRe demandent aujourd’hui à être approfondis. En raison de leurs nombreuses fonctions, les microtubules interagissent en effet avec une multitude d'autres protéines dans la cellule, appelées protéines associées aux microtubules. La course est maintenant ouverte pour savoir laquelle de ces protéines influence la dynamique du réseau.
De façon plus globale se pose aussi la question du rôle de ces échanges dans le processus biologique : servent-ils à améliorer la stabilité d’un microtubule à long terme ? Ont-ils une utilité à l’échelle de la cellule ? Des interrogations sur lesquelles de nombreuses équipes de recherche devraient travailler à l’avenir car cette thématique nouvelle intéresse de plus en plus les scientifiques.
Savoir dans quelle mesure les échanges de tubuline sont nécessaires pour régénérer les microtubules a en effet un intérêt majeur dans le domaine de la santé. Aujourd’hui, certaines recherches visent à expliquer la dynamique de l’architecture de microtubules, en réponse à un stress mécanique qui peut survenir, par exemple, dans le cas d’un cancer. « Comprendre la différence entre une cellule saine et une cellule cancéreuse est essentiel pour déterminer à quel moment et à quel niveau un médicament peut agir », souligne Karin John. Autre exemple : expliquer comment la molécule Tau, dont on sait qu’elle joue un rôle crucial dans le développement de la maladie d’Alzheimer, interagit avec des microtubules pourrait donner lieu à des avancées thérapeutiques. La prudence reste bien sûr de mise mais d’après la chercheuse, « dans la mesure où ils sont impliqués dans de nombreux processus, les microtubules présentent peut-être plusieurs points d’accès pour développer de nouveaux traitements ».
_ _ _
Ces recherches ont été financées en tout ou partie, par l’Agence nationale de la recherche (ANR) au titre du projet ANR-APERTuRe-AAPG2018. Cette communication est réalisée et financée dans le cadre de l’appel à projet Sciences Avec et Pour la Société - Culture Scientifique Technique et Industrielle pour les projets JCJC et PRC des appels à projets génériques 2018-2019 (SAPS-CSTI-JCJC et PRC AAPG 18/19).
_ _ _
[1] Le LIPhy est une unité mixte de recherche CNRS / Université Grenoble Alpes (UMR 5588).



