A la une

La pandémie de Covid-19 que nous traversons nous a tous mis en alerte sur les mesures que nous avons prises, aurions pu ou aurions dû prendre. À côté des mesures sanitaires pour éviter l’engorgement de l’ensemble des systèmes de soins, il est indispensable de disposer de traitements préventifs, tels que des vaccins si le virus apparait de manière récurrente. Mais lorsque l’ennemi est inconnu, difficile d’élaborer un vaccin dans l’urgence. Il faut alors se tourner vers des traitements curatifs tels que des sérums ou des médicaments qui permettent, après que l’infection soit survenue, de traiter leurs symptômes ou d’éradiquer l’agent pathogène. Dans le cas du Covid-19, si certains anti-inflammatoires puissants permettent dans la plupart des cas de sauver les patients, les plus fragiles peuvent succomber. La découverte de nouveaux médicaments empêchant spécifiquement le virus d’infecter les humains ou de se multiplier reste alors la seule voie efficace. Comment s’y prend-on pour découvrir de nouveaux médicaments ?
Des hommes et des virus : les leçons de l’histoire
Grâce à des chercheurs tels que Louis Pasteur, l’histoire de France est riche de luttes couronnées de succès contre les virus. Ainsi, la rage, la variole, la rougeole ou la poliomyélite sont des maladies que l’on est parvenu à maîtriser grâce aux vaccins, à tel point que pour certaines d’entre elles, les campagnes de vaccination ont été stoppées. Pour d’autres virus comme le VIH, les coronavirus (agent causal du SRAS en 2002, du MERS en 2012 et du Covid-19 fin 20191 et certaines hépatites (hépatite C), les tentatives de développement de vaccins se sont soldées par des échecs dont les causes ne sont pas toujours bien identifiées : capacité inouïe de certains virus à produire des mutations à une telle cadence que le système immunitaire du patient n’a pas le temps de s’adapter, obsolescence d’un vaccin avant sa mise sur le marché.
Contre le virus VIH, ainsi que contre le virus de l’hépatite C, des médicaments bloquant la fonction des enzymes permettant la multiplication du virus, prescrits en combinaisons par trois, se sont montrés efficaces dans la lutte contre la maladie et contre l’émergence de résistances. Dans le cas des coronavirus, il n’existe à ce jour aucun vaccin efficace chez l’homme contre aucune des formes connues depuis le SRAS de 2002, et ce malgré des efforts ininterrompus. L’absence de vaccin et la difficulté à en produire impliquent de déployer des stratégies alternatives basées sur l’usage de médicaments.
Tester les médicaments déjà connus : 2 500 molécules
Sir James Black, prix Nobel de médecine en 1988 et inventeur du premier anti-hypertenseur, avait coutume de clamer haut et fort que la meilleure façon de découvrir est nouveau médicament est de partir d'un médicament existant. En situation d'urgence sanitaire comme celle que nous connaissons, cette stratégie dite de repositionnement prend tout son sens. Elle consiste à identifier, parmi les 2 500 principes actifs des médicaments existants, ceux qui permettent de traiter les patients.
Dans le cas du Covid-19, l’exploitation d’anti-inflammatoires puissants est fondamentale car c’est une « marque » du SARS-Cov-2 que de provoquer une inflammation généralisée. Mais on peut aussi cibler plus spécifiquement le virus en concevant un test biologique « sur mesure » qui permet d’identifier des molécules capables de bloquer une fonction importante du virus, telle que sa capacité à infecter les cellules ou à s’y multiplier.
C’est la méthode considérée la plus rapide si elle est fructueuse car les molécules testées sont des médicaments qui ont déjà obtenu l’autorisation de mise sur le marché, c’est-à-dire testées avec succès chez des humains. Ces médicaments peuvent alors faire l’objet d’une étude clinique rapide sur les patients atteints du Covid-19. Il faut toutefois qu’ils se montrent très efficaces car les effets pour lesquels ils ont été initialement mis en vente sont toujours exercés sans pour autant être désirés dans une nouvelle indication thérapeutique.
30 millions de molécules à la disposition de la recherche française
Si l’on est amené à innover totalement, c’est-à-dire à découvrir des molécules tout à fait nouvelles, dépourvues des effets secondaires qui rendent la prescription impossible, on peut puiser dans des collections de molécules déjà synthétisées mais jamais testées dans les modèles Covid-19. L’investissement financier, humain et industriel devient rapidement énorme et nécessairement long. On estime à environ 30 millions le nombre de molécules disponibles et compatibles avec un développement pharmaceutique dans l’ensemble des collections privées de l’industrie pharmaceutique mondiale, chez les fournisseurs privés de composés et dans les collections publiques des laboratoires de recherche académique.

La recherche académique française a montré qu’elle est capable de relever ce défi rapidement. À travers la Chimiothèque nationale, elle dispose d’une collection de bientôt 100 000 molécules et d’un réseau de plateformes technologiques équipées de robots qui ont réalisé la manipulation de ces molécules sur des modèles biologiques en quelques semaines à peine, mais sur un nombre réduit (quelques milliers) de composés. Les molécules actives qui sont identifiées à cette étape entrent dans un processus de développement qui prend trois à cinq années avant d’entreprendre une étude clinique. Ce développement requiert l’optimisation des molécules par les chimistes pour les rendre plus puissantes, plus sélectives et qu’elles puissent être administrées sous forme de médicament. La durée des phases cliniques qui s’ensuivent en cas de succès s’étale encore sur plusieurs années (trois à cinq pour une pathologie infectieuse). L’ensemble de ce processus peut ainsi s’étaler sur près de dix ans et coûter de 1 à 2 milliards d'euros.
Modéliser et explorer l’espace chimique : 1,5 milliard de molécules
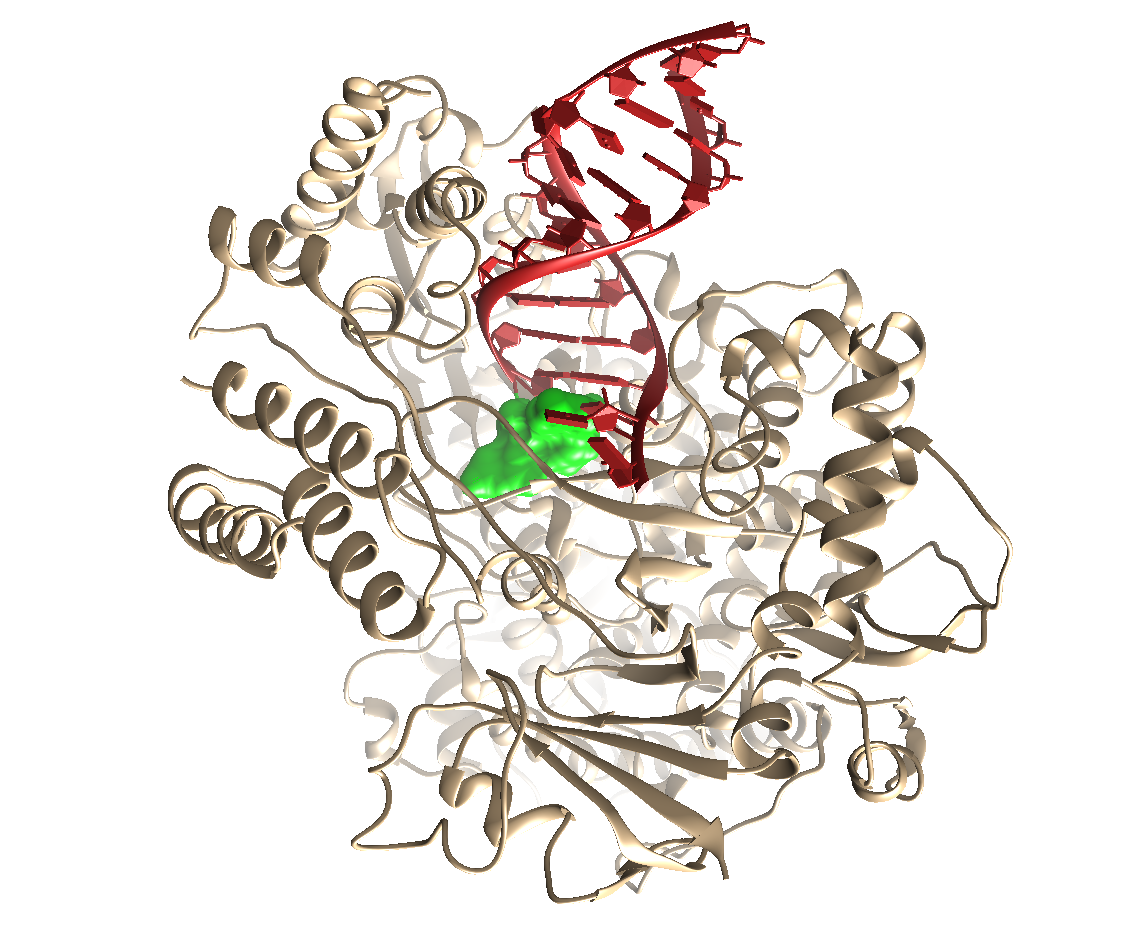
Dans le processus de recherche de nouveaux médicaments, le test expérimental de molécules sur des modèles biologiques est relativement onéreux. Son coût varie en effet entre un et dix euros par molécule en fonction de la complexité de l’essai biologique. Pour augmenter leurs chances de succès tout en réduisant le temps investi, les chimistes et biologistes ont exploité les outils de l’intelligence artificielle pour développer des logiciels capables d’assembler « virtuellement » une cible thérapeutique (par exemple la polymérase d’ARN du SARS-Cov-2 qui permet sa prolifération) avec une molécule chimique pour déterminer leur propension à faire un complexe de forte affinité, et de faire cela à très haut débit.
La démarche étant virtuelle, les molécules peuvent l’être aussi. Les chimistes ont donc imaginé des structures chimiques plausibles et synthétisables à peu de frais. La collection ainsi conçue comprend 1,5 milliard de molécules. Elle peut être considérée comme très largement virtuelle puisque seulement 10 % des molécules qu’elle contient ont réellement été synthétisées. Son criblage informatique, réalisé au moyen de 40 000 ordinateurs calculant en parallèle 5, a duré à peine deux semaines, alors qu’il faudrait au moins vingt ans à une grande industrie pharmaceutique pour réaliser ce même criblage en réel. Les molécules sont ensuite classées par ordre décroissant de potentiel d’activité réelle et les plus intéressantes sont synthétisées. Ce processus très rapide permet aussi d’économiser des sommes considérables puisque seuls quelques milliers de molécules seront réellement synthétisées puis testées sur les modèles biologiques.
L’utilisation de médicaments existants reste un premier choix dans le traitement d’une nouvelle pathologie en situation d'urgence sanitaire. Elle permet de proposer des traitements en attendant que les vaccins soient développés. Si de nouvelles molécules doivent être étudiées, la combinaison de méthodes théoriques et expérimentales devient la norme car elle permet une plus grande exhaustivité tout en contenant le temps et la dépense. La possibilité de saisir des réseaux de plateformes technologiques distribués sur les territoires nationaux à proximité des centres d’expertise, par exemple dans deux plateformes marseillaise2 et lilloise3 qui ont identifié des candidats médicaments pour le Covid-19, est un atout majeur de la réactivité nécessaire pour valider les médicaments existants ou pour entreprendre une recherche de nouveaux médicaments. ♦
À lire sur le site du journal
Covid-19 : 1,5 milliard de molécules passées au criblage virtuel
Les auteurs
Florence Mahuteau-Betzer est directrice de recherche CNRS et directrice adjointe du laboratoire Chimie, modélisation pour la biologie du cancer (CNRS/Inserm/Institut Curie/Université Paris-Saclay). Après avoir dirigé le GIS Chimiothèque nationale, elle est aujourd'hui responsable du pilier Chimiothèque nationale de l’infractructure nationale Chembiofrance.
Didier Rognan est directeur de recherche CNRS, directeur du Laboratoire d'innovation thérapeutique (CNRS/Université de Strasbourg) à Illkirch. Il est responsable notamment du pilier Chéminformatique de l'infrastructure nationale ChemBioFrance, et membre nommé de la section 16 (Chimie et Vivant) du comité national de la recherche scientifique. Il est co-fondateur de la société BIODOL Therapeutics.
Jean-Luc Galzi est directeur de recherche CNRS, directeur du laboratoire Biotechnologie et signalisation cellulaire (CNRS/Université de Strasbourg) à Illkirch. Il a développé le réseau académique français des plateformes de criblage et de développement préclinique de nouveaux candidats médicaments. Il est le directeur de l’Infrastructure nationale de recherche ChemBioFrance, dédiée à la découverte de molécules bioactives.
- 1. SRAS, syndrome respiratoire aigü dû à SARS-Cov ; MERS, Middle East Respiratory Syndrome, dû à MERS-Cov ; Covid-19 dû à SARS-Cov-2.
- 2. Unité des Virus émergents (Aix-Marseille Univ./IRD/Inserm/IHU Méditerranée Infection) et unité Architecture et fonction des macromolécules biologiques (CNRS/Aix-Marseille Univ.).
- 3. Unité Médicaments et molécules pour agir sur les systèmes vivants (Inserm/Institut Pasteur de Lille/Univ. de Lille) et Centre d'infection et d'immunité de Lille (CNRS/Inserm/Univ. de Lille 1/Institut Pasteur de Lille).