A la une
Le cerveau est probablement l’organe le plus complexe du corps humain. C’est un immense réseau formé de près de 100 milliards de neurones interconnectés, distribués dans différentes aires cérébrales et classés en différents sous-types selon le neurotransmetteur qu’ils libèrent en réponse à une stimulation. Une mauvaise communication neuronale est à l’origine de troubles neuropsychiatriques comme la schizophrénie et l’autisme. Etudier comment l’information est transmise dans les réseaux de neurones est donc primordial pour mieux comprendre le fonctionnement du cerveau en conditions physiologiques et pathologiques.
Pour cela, il est essentiel de pouvoir contrôler spécifiquement les différents types cellulaires qui composent les réseaux de neurones. Ceci a été rendu possible il y a maintenant un peu plus de dix ans par le développement de l’optogénétique, véritable révolution technologique dans le domaine des neurosciences. Cette technique consiste à modifier génétiquement des neurones afin qu’ils deviennent sensibles à la lumière grâce à l’expression d’une protéine : l’opsine.
En 2002, Georg Nagel, Ernst Bamberg et Peter Hegemann identifient la channelrhodopsine, une protéine photosensible issue d’une algue verte appelée Chlamydomonas reinhardtii. Chez ce micro-organisme unicellulaire, la channelrhodopsine est nécessaire à la phototaxie, processus par lequel certains organismes se dirigent dans l’espace par rapport à la lumière présente dans l’environnement, par exemple pour favoriser la photosynthèse. En 2003, ces mêmes chercheurs découvrent et caractérisent la channelrhodopsine-2, qui est aujourd’hui la protéine la plus utilisée pour les approches d’optogénétique.
Comment une protéine issue du monde unicellulaire pourrait-elle être utile en neurosciences ?
D’un point de vue mécanistique, la channelrhodopsine-2 est un canal ionique activé par la lumière bleue. Son activation se traduit par l’ouverture du canal qui permet alors l’entrée dans la cellule d’ions positifs (Figure 1). En 2005, Edward Boyden, Feng Zhang et Karl Deisseroth, de l’université de Stanford en Californie, montrent qu’exposer des neurones exprimant la channelrhodopsine-2 à de la lumière bleue permet leur activation en déclenchant des potentiels d’action (message électrique des neurones).
La puissance de cette approche est basée sur une précision spatiale mais aussi temporelle du contrôle des neurones. Précision spatiale puisqu’il est possible, par génie génétique, de cibler une population neuronale spécifique dans une région cérébrale bien définie de façon à ce que la channelrhodopsine ne soit produite que par les neurones que l’on souhaite activer (pour plus de détails, lire le billet « Des outils innovants pour étudier les circuits neuronaux »). De plus, des développements technologiques sont en cours afin de restreindre l’application de la lumière à une zone très localisée du cerveau. Précision temporelle, également, puisque l’activation des neurones est transitoire et n’a lieu que lorsque l’expérimentateur allume la lumière.
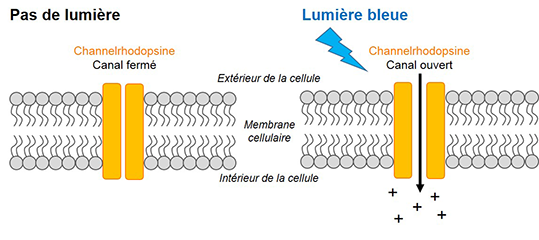
Figure 1 : La lumière bleue ouvre la channelrhodopsine. Si l’entrée d’ions positifs est suffisante, le neurone émet alors des potentiels d’action.
L’optogénétique ne se limite pas à la channelrhodopsine. Au fil des années, la modification par génie génétique des protéines existantes, ainsi que la découverte d’autres protéines sensibles à la lumière, ont permis aux chercheurs d’avoir accès à toute une panoplie d’outils pour contrôler l’activation des neurones. Par exemple, l’insertion de mutations dans la channelrhodopsine a permis de générer des protéines activées par la lumière rouge (Figure 2). À l’opposé, l’halorhodopsine, issue d’une bactérie appelée Halobacteria, permet non pas d’activer mais d’inhiber les neurones.

Figure 2 : Axones et terminaisons présynaptiques (fibres moussues) provenant de deux noyaux du tronc cérébral et projetant dans le cervelet. Les fibres moussues expriment la channelrhodopsine (vert) ou Chrimson (rouge), un variant de la channelrhodopsine active par la lumière rouge. (Image : Frédéric Lanore, UCL, Londres)
L’inception grâce à l’optogénétique ?
Grace à l’optogénétique, générer de faux souvenirs est maintenant possible chez le rongeur, ce qui permet une meilleure compréhension de la mémoire et de ces mécanismes. En 2013, l’équipe du professeur Susumu Tonegawa (prix Nobel de physiologie ou médecine, 1987) au Massachussetts Institute of Technology (Boston) a montré qu’il était possible d’implanter de faux souvenirs chez des souris en activant des neurones par optogénétique dans l’hippocampe, une structure cérébrale essentielle dans les processus de mémorisation. En effet, lorsque les souris découvrent un nouvel environnement, certaines cellules de cette région sont spécifiquement activées et participent de façon spécifique à la mémorisation du contexte spatial. Dans l’expérience conduite par le laboratoire de Susumu Tonegawa, des souris ont été, dans un premier temps, placées dans une cage A (Figure 3). L’exploration de cet environnement entraîne l’activation sélective d’une population de cellules de l’hippocampe (neurones A) qui, couplée à une approche de génie génétique, permet d’exprimer la channelrhodopsine spécifiquement dans ces neurones.
Ces mêmes souris ont ensuite été placées dans une cage B, dans laquelle les neurones A ne sont pas naturellement activés car le contexte est différent de celui de la cage A. Mais les chercheurs ont activé artificiellement les neurones A en projetant de la lumière bleue dans l’hippocampe grâce à une petite fibre optique. Simultanément, dans cette cage B, les souris ont reçu de faibles chocs électriques qui induisent alors une réponse de peur. Par la suite, lorsque les souris ont été replacées dans la cage initiale A, elles ont montré une réaction de peur alors que cet environnement spatial n’avait jamais été associé à des chocs électriques. Les chercheurs ont ainsi réussi à associer de façon artificielle l’activation des neurones A à la réaction de peur et ainsi créer un faux souvenir.
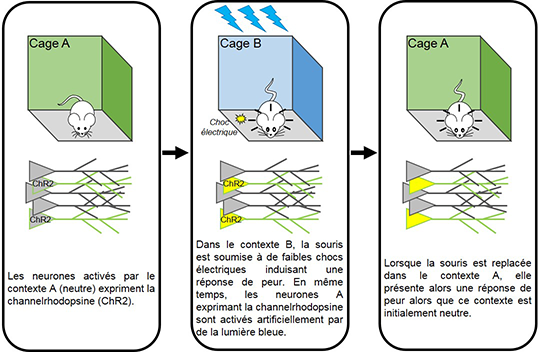
Figure 3 : L’optogénétique pour mieux comprendre comment les souvenirs se forment.
Cette étude a donc permis de montrer qu’il est possible de manipuler la mémoire grâce à l’optogénétique (voir le billet « Une plongée dans les infidélités de notre mémoire »).
L’optogénétique pour faire aimer les choux de Bruxelles à nos enfants ?
L’optogénétique a également été utilisée pour mieux comprendre les circuits neuronaux associés à la soif et au goût. En particulier, le laboratoire de Charles Zuker à l’université de Columbia (New York) a montré en 2015 qu’il était possible de déclencher la sensation de soif chez des souris en activant par optogénétique une population de neurones de l’hypothalamus, et ceci même quand les souris étaient parfaitement bien hydratées. Cette même équipe s’est également intéressée au système gustatif. Le goût est représenté par cinq saveurs : sucrée, salée, amère, acide et « umami » (qui signifie « savoureux » en japonais et qui décrit un goût appétissant de bouillon ou de viande généré par la présence de glutamate). Nombre d’entre nous pensent que ces différentes saveurs sont détectées au niveau de zones bien définies sur la langue mais il semblerait que cela soit un mythe. En effet, on sait aujourd’hui que les récepteurs responsables de la détection des différentes saveurs sont distribués de façon uniforme à la surface de la langue au niveau des papilles gustatives. Celles-ci sont innervées par des fibres nerveuses qui transmettent les informations jusqu’au cortex gustatif.
Dans cette structure, les différentes saveurs sont représentées au niveau de champs topographiques bien distincts les uns des autres, ce qui permet de cibler très spécifiquement les neurones activés par telle ou telle saveur. C’est l’approche qu’a utilisée l’équipe de Charles Zuker en induisant l’expression de la channelrhodopsine soit dans les neurones codant pour la saveur amère, soit dans ceux codant pour la saveur sucrée. De façon naturelle, les souris ont une attraction pour les substances sucrées et une aversion pour les substances amères. Cependant, si on stimule spécifiquement les neurones codant pour la saveur amère dans le cortex gustatif, on déclenche alors chez les souris une réponse de répulsion si intense que les souris refusent alors les substances sucrées. Inversement, lorsque les neurones de la saveur sucrée sont spécifiquement activés, les souris présentent une réponse d’attraction qui va même jusqu’à masquer leur aversion pour les substances amères. Les neurones codant pour la saveur amère pourraient donc être baptisés « neurones du dégoût » et ceux codant pour la saveur sucrée, « neurones de la gourmandise ».
Des applications thérapeutiques de l’optogénétique dans un futur proche ?
Comme l’illustrent les études précédemment décrites, l’optogénétique est un outil incomparable pour améliorer notre compréhension du fonctionnement cérébral. Mais peut-on imaginer des applications thérapeutiques chez l’humain à court terme ? Ceci paraît peu probable, car c’est une technique qui reste pour l’instant très invasive. En effet, son application nécessite des approches de thérapie génique qui consistent à modifier des neurones en injectant un virus codant pour la channelrhodopsine dans l’aire cérébrale ciblée. Quelles doses de virus doit-on administrer ? Existe-il des effets secondaires à long terme ? Autant de questions auxquelles on doit préalablement répondre avant d’envisager concrètement une application chez l’homme.
Par ailleurs, cette technique nécessite l’implantation d’une fibre optique dans le cerveau pour illuminer et activer les neurones modifiés dans l’aire cérébrale ciblée, ce qui reste à ce jour difficile, notamment pour les aires cérébrales profondes. En effet, la lumière bleue traverse assez mal les tissus. Des recherches sont en cours pour développer des outils optogénétiques activables par la lumière infrarouge, beaucoup plus efficace pour pénétrer dans les tissus, en vue de remplacer l’implantation de fibres optiques par des diodes électroluminescentes (LED) disposées à la surface du crâne. Le développement de nouvelles opsines, de plus en plus performantes est fulgurant. Injecter aujourd’hui une opsine chez un patient âgé de 30 ans c’est un peu comme l’envoyer sur Pluton avec les technologies aérospatiales des années 70. Il paraitrait donc plus sage d’attendre d’avoir des outils optogénétiques optimisés avant de se lancer dans des essais cliniques chez l’homme.
Les études présentées dans cet article ne reflètent qu’une infime partie des travaux employant l’optogénétique. À ce jour, ce serait plus de 1 000 laboratoires dans le monde qui utiliseraient cette approche pour améliorer notre compréhension du fonctionnement du cerveau. Les six inventeurs de l’optogénétique, Ernst Bamberg, Edward Boyden, Karl Deisseroth, Peter Hegemann, Gero Miesenböck et Georg Nagel, ont reçu en 2013 le très convoité « Brain Prize » pour « l’invention et le développement de l’optogénétique. Cette technique révolutionnaire permet d’allumer et d’éteindre avec de la lumière des populations de neurones génétiquement modifiés, permettant ainsi non seulement d’étudier le fonctionnement des circuits neuronaux mais également de développer de nouvelles approches thérapeutiques pour les troubles neurologiques et psychiatriques. »
--------------------------------------------------------------------------------------------------------------------------------
Références
-
Boyden E. S., Zhang F., Bamberg E., Nagel G., Deisseroth K., « Millisecond-timescale, genetically targeted optical control of neural activity », Nature Neuroscience, 2005, vol. 8 (9) : 1263-8. doi: 10.1038/nn1525.
-
Nagel G., Ollig D., Fuhrmann M., Kateriya S., Musti A., Bamberg E. et al., « Channelrhodopsin-1: A Light-Gated Proton Channel in Green Algae », Science, 2002, vol. 296 (5577) : 2395-8. doi: 10.1126/science.1072068.
-
Nagel G., Szellas T., Huhn W., Kateriya S., Adeishvili N., Berthold P. et al., « Channelrhodopsin-2, a directly light-gated cation-selective membrane channel », Proceedings of the National Academy of Sciences of the United States of America, 2003, vol. 100 (24) : 13940-5. doi: 10.1073/pnas.1936192100.
-
Oka Y., Ye M., Zuker C. S., « Thirst driving and suppressing signals encoded by distinct neural populations in the brain », Nature, 2015, vol.520 (7547) : 349-52. doi: 10.1038/nature14108.
-
Peng Y., Gillis-Smith S., Jin H., Tränkner D., Ryba N. J. P., Zuker C. S., « Sweet and bitter taste in the brain of awake behaving animals », Nature, 2015, vol. 527 (7579) : 512-5. doi: 10.1038/nature15763.
-
Ramirez S., Liu X., Lin P.-A., Suh J, Pignatelli M., Redondo R. L. et al., « Creating a False Memory in the Hippocampus », Science, 2013, vol. 341 (6144) : 387-91. doi: 10.1126/science.1239073.
--------------------------------------------------------------------------------------------------------------------------------
Lucie Bard est docteure en Neurosciences. Elle cherche à comprendre comment l’information est transmise dans les réseaux de neurones par des approches de microscopie optique et d’électrophysiologie. Elle a effectué sa thèse sous la direction de Laurent Groc à l’université de Bordeaux au cours de laquelle elle s’est intéressée aux mécanismes moléculaires qui contrôlent l’ancrage des récepteurs du glutamate de type NMDA dans les synapses. Depuis 2011, elle est en post-doctorat dans le laboratoire de Dmitri Rusavov à l’University College London au Royaume-Uni et s’intéresse au dialogue entre neurones et astrocytes et son rôle dans la physiologie synaptique. Sur Twitter @LucieBard.