A la une
Une étude récente vient de mettre en évidence une fonction surprenante de l’amygdale centrale, le contrôle de la prédation (Han et al., Cell, 2017). Ce travail a surpris la communauté des neurobiologistes car cette petite région du cerveau est bien connue pour son implication dans les réponses de peur, qui semblent a priori opposées au comportement de prédation. Ce travail dirigé par le Dr de Araujo est détaillé dans le billet «La prédation : une affaire de circuits neuronaux».
Alors, si l’amygdale centrale a fait l’objet d’intenses recherches par le passé, comment expliquer qu’une découverte de cette ampleur survienne si tardivement ? La réponse à cette dernière question repose principalement dans la révolution méthodologique que le monde des neurosciences traverse actuellement. Le développement de nouvelles technologies qui combinent les outils génétiques, moléculaires, pharmacologiques, électrophysiologiques et optiques permet d’étudier les circuits du cerveau avec une précision inégalée.
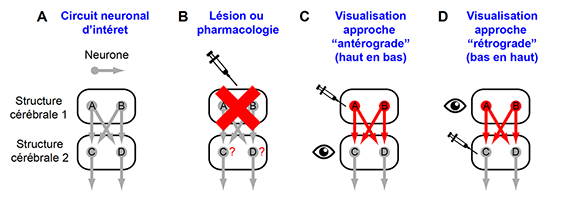
Figure 1 : Évolution méthodologique de l’étude des circuits du cerveau © Antoine Besnard
Afin d’illustrer l’évolution méthodologique de l’étude des circuits du cerveau, prenons l’exemple d’un système simple comprenant deux structures cérébrales incluant quatre populations de neurones A, B, C et D (Figure 1A). Nous souhaitons comprendre comment les neurones A dans la structure 1 contrôlent les neurones C et D dans la structure 2. Pour répondre à cette question, il est possible d’éliminer, d’inactiver ou au contraire de stimuler les neurones A, et d’évaluer l’impact de ces manipulations sur les neurones C et D. Les approches traditionnelles reposent principalement sur des approches lésionnelles (induction d’une lésion) ou de blocage pharmacologique (Figure 1B). Le problème de ce type de démarches est le manque de spécificité, puisque les neurones B voisins sont également affectés par cette manipulation. Il est alors impossible de formuler une conclusion définitive sans exclure la contribution potentielle des neurones B.
Plus récemment, l’étude plus fine des circuits neuronaux a été rendue possible en utilisant des agents capables de marquer les neurones ainsi que leurs projections (axones) dans le cerveau. Pour ce faire, il est possible d’injecter un traceur dans la structure 1 et de visualiser ensuite les terminaisons des neurones A et B dans la structure 2. Cette approche est dite antérograde (haut en bas) car elle suit le chemin naturel des axones dans le cerveau (Figure 1C). À l’inverse, il est possible d’injecter un traceur rétrograde (bas en haut) dans la structure 2 qui va être cette fois-ci capturé par les terminaisons des neurones A et B pour marquer les neurones depuis leurs origines dans la structure 1 (Figure 1D). Ensemble, ces approches ont permis d’identifier de nombreux circuits neuronaux tels que les circuits de l’amygdale qui contrôlent les réponses de peur.
Cependant, l’impossibilité de restreindre l’utilisation de ces outils (activation, inhibition, traçage antérograde, traçage rétrograde) à des populations de neurones sélectives (par exemple comparer les neurones A aux neurones B dans la même structure) a très longtemps limité la caractérisation fonctionnelle de ces circuits.
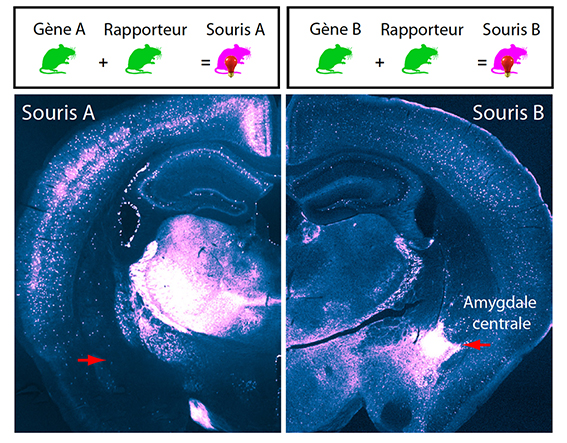
Figure 2 : Le génie génétique au service de l’étude des circuits du cerveau. Cette stratégie repose sur la création de lignées de souris transgéniques (souris A et B) qui permettent une investigation précise et ponctuelle des circuits neuronaux (cellules roses). Noter la différence de localisation des populations de neurones dans les coupes de cerveaux de la souris A et B. © Antoine Besnard
C’est dans ce contexte que les innovations de génie génétique ont permis de révolutionner l’étude des circuits du cerveau (Figure 2). En effet, il est désormais possible de contrôler l’expression d’une protéine telle qu’une protéine fluorescente qui n’existe normalement pas dans le cerveau (Figure 2, ampoule rouge) afin de visualiser l’anatomie des neurones, et par extension, les circuits qu’ils composent. Différentes populations de neurones se distinguent par les différents gènes qu’ils expriment (exemple : les neurones A expriment le gène A et les neurones B expriment le gène B). Il est ainsi possible de croiser une souris dont le gène A (ou B) a été modifié avec une souris qui n’exprime la protéine fluorescente que lorsque le gène A (ou B) est modifié (Figure 2, souris vertes « Rapporteur »). Les souris issues de ce croisement auront donc une population de neurones A ou B exprimant la protéine fluorescente (Figure 2, souris roses). L’observation des coupes de cerveau issues des souris A et B avec un microscope à fluorescence permet l’illumination de ces populations de neurones fluorescents (de couleur rose) dans un océan de neurones invisibles qui n’expriment pas la protéine fluorescente. Dans la figure 2, la souris B (mais pas la souris A) permet la visualisation de l’amygdale centrale (flèche rouge). Pour une description plus précise de cette technologie, consulter le billet: «Les 100 couleurs du Brainbow» .
Les applications de cette technologie sont sans limites ! Il est désormais possible de restreindre l’expression de la protéine fluorescente aux neurones A exclusivement dans la structure 1 (au contraire de la figure 2, où les cellules roses ne sont pas restreintes à l’amygdale centrale puisqu’elles se trouvent également dans le cortex ou le thalamus). Pour ce faire, il suffit d’injecter dans la structure 1 de la souris dont le gène A est modifié (Figure 3A, souris verte), un vecteur viral (Figure 3A, virus rouge) qui permet l’expression de la protéine fluorescente (Figure 3A, ampoule rouge) que lorsque le gène A est modifié. Avec cette stratégie, il devient donc possible de distinguer les neurones A des neurones B uniquement dans la structure 1 (Figure 3A, neurone rouge). De plus, il est désormais possible d’observer les terminaisons des neurones A dans la structure 2 en étant certain qu’ils proviennent de la structure 1, puisque l’expression a été restreinte par le virus.
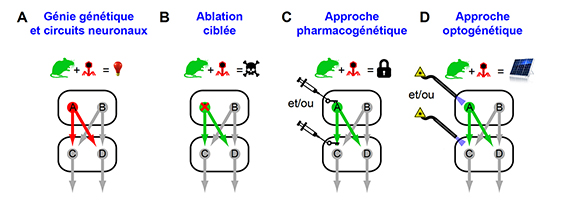
Figure 3 : Révolution méthodologique de l’étude des circuits du cerveau © Antoine Besnard
En utilisant cette stratégie, il est alors possible d’étudier la fonction d’un circuit spécifique dans un océan de neurones. Reprenons la question initiale : comment la population de neurones A dans la structure 1 contrôle les neurones C et D dans la structure 2 ? La même stratégie de génie génétique peut être employée afin de permettre l’expression d’une protéine capable cette fois-ci d’induire la mort cellulaire des neurones A (Figure 3B, neurone vert). Cette manipulation permet ainsi d’étudier directement l’impact de la population des neurones A sur les neurones C et D sans affecter les neurones B. Cependant, des études récentes indiquent que l’ablation définitive de neurones conduit à la mise en place de mécanismes de compensation au sein de la structure 1, affectant potentiellement les neurones B. Ces observations ont ainsi inspiré le développement de techniques permettant de contrôler plus spécifiquement l’activité des neurones de façon à les stimuler ou au contraire à les inhiber de manière transitoire. Grâce à cette approche, l’activité des neurones devient sensible soit à une molécule pharmacologique spécifique (Figure 3C, pharmacogénétique), soit à la lumière (Figure 3D, optogénétique). Il devient donc possible de contrôler spécifiquement le corps cellulaire des neurones A. Cette prouesse technique peut être réalisée en injectant une molécule pharmacologique inerte (Figure 3C, clef) conçue pour lier un récepteur spécifique (Figure 3C, verrou) exprimé par la population de neurones A. De même, l’application d’une source lumineuse (Figure 3D, laser) au voisinage de neurones A exprimant des récepteurs d’origine bactérienne sensibles à la lumière (Figure 3D, panneaux photovoltaïques) va permettre de contrôler l’activité de cette population de neurones de manière spécifique. L’utilisation de ces techniques a permis de repousser les limites de l’étude fonctionnelle des circuits du cerveau car il est désormais possible d’étudier directement les connexions entre les neurones A et C. Il suffit simplement d’injecter la molécule pharmacologique ou placer la source de lumière au niveau des terminaisons nerveuses des neurones A situées à proximité des neurones C dans la structure 2 (Figure 3C et D). La description détaillée de ces nouvelles technologies fera l’objet d’un prochain billet.
Enfin, il existe aujourd’hui de nouveaux types de vecteurs viraux qui permettent de combiner les approches antérogrades et rétrogrades (Figure 1C et D) avec les outils pharmacogénétiques et optogénétiques. La puissance de ces approches a déjà permis de revisiter un certain nombre de questions neurobiologiques que l’on pensait élucidées depuis longtemps. La caractérisation des circuits de la prédation orchestrés par l’amygdale centrale en est l’illustration parfaite (Han et al., Cell, 2017).
Au fil des innovations et découvertes, les nouvelles technologies permettent de disséquer les circuits du cerveau avec une précision de plus en plus fine. Il est aujourd’hui possible d’étudier les circuits qui gouvernent la prédation mais également la mémoire, la satiété, la peur et bien d’autres comportements. La caractérisation de ces circuits est importante puisque de nombreuses maladies psychiatriques perturbent leur fonctionnement ainsi que les comportements qui en dépendent et la restauration de l’activité de ces circuits représente un enjeu majeur dans le traitement voire même la prévention de ces maladies du cerveau.
Références d’intérêt:
Integrated Control of Predatory Hunting by the Central Nucleus of the Amygdala.
Han W, Tellez LA, Rangel MJ Jr, Motta SC, Zhang X, Perez IO, Canteras NS, Shammah-Lagnado SJ, van den Pol AN, de Araujo IE.
Cell. 2017 Jan 12;168(1-2):311-324.e18. doi: 10.1016/j.cell.2016.12.027.
--------------------------------------------------------------------------------------------------------------------------------
Antoine Besnard est Docteur en Neurosciences (2011, UPMC). Durant son doctorat, il a étudié les mécanismes moléculaires qui contrôlent les adaptations du cerveau en réponse à la cocaïne sous la direction de la Dr Jocelyne Caboche. En 2012, Antoine rejoint l’équipe du Dr Amar Sahay située au Massachusetts General Hospital (Boston). Il utilise des techniques optogénétiques afin de visualiser et contrôler l’activité des cellules du cerveau. Son travail vise à décoder les circuits neuronaux qui contrôlent la peur et l’anxiété. Ces études sont importantes puisque de nombreuses maladies psychiatriques perturbent ces circuits ainsi que ces comportements. Restaurer l’activité de ces circuits pourrait donc un jour permettre de soigner ou même prévenir ces maladies du cerveau. Twitter : @AntoineBesnard3