A la une
Sans la méiose, pas de gamètes et donc pas de reproduction sexuée. Cette division cellulaire est en effet essentielle au cycle de vie de la plupart des espèces : mammifères, oiseaux, reptiles, poissons, amphibiens, insectes, plantes, champignons… Mais, à la différence de la mitose, qui donne deux cellules filles identiques génétiquement à la cellule mère, « la méiose permet de convertir des cellules diploïdes à l’état haploïde », expose Bernard de Massy, chercheur à l’Institut de génétique humaine (IGH) de Montpellier1.
Pour arriver à ce résultat, la méiose repose sur un processus de double division cellulaire. La première va permettre de répartir les paires de chromosomes homologues, dont un est d’origine paternelle et l’autre d’origine maternelle, dans deux cellules distinctes. Quant à la deuxième division, elle permet de séparer les chromatidesFermerLes chromatides sont des éléments constitutifs des chromosomes qui se présentent sous la forme de bâtonnets. En fonction du cycle cellulaire, un chromosome peut être constitué de 1 ou 2 chromatides. de chaque chromosome de ces 2 cellules filles pour obtenir au bout du compte 4 gamètes. Ces cellules reproductrices sont dites « haploïdes », car elles ne contiennent qu’un seul exemplaire de chaque chromosome, soit la moitié du patrimoine génétique de la cellule mère diploïde qui dispose d’une paire de chaque chromosome.
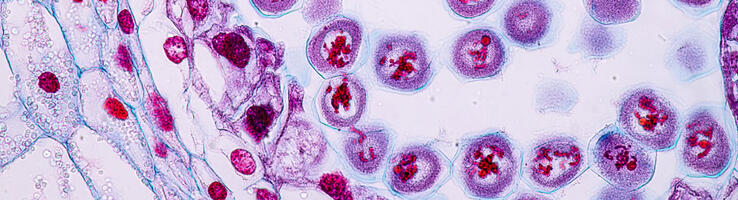
 Cellules germinales en méiose dans un ovaire embryonnaire de souris (© Anne-Amandine Chassot / iBV / Inserm / CNRS Images).
Cellules germinales en méiose dans un ovaire embryonnaire de souris (© Anne-Amandine Chassot / iBV / Inserm / CNRS Images).
La danse des chromosomes
Depuis près de trente ans, Bernard de Massy cherche à comprendre, à partir d’approches génétiques, moléculaires et cytologiques, les mécanismes qui déterminent la ségrégation des chromosomes homologues au tout début de la méiose. « La prophase de la première division méiotique est comme une danse, un tango : les chromosomes homologues, qui ne sont pas strictement identiques du fait de leur origine différente, se rapprochent, s’apparient physiquement et des échanges réciproques de matériel génétique ont lieu », s’émerveille encore le chercheur. Et cette étape est cruciale au bon déroulement de la méiose.
« Sans cette recombinaison méiotique lors de laquelle des allèles sont échangés, la ségrégation des chromosomes est altérée. Cela se traduit par la formation de gamètes possédant un nombre anormal de chromosomes », précise Bernard de Massy. Ces gamètes, dits « aneuploïdes », peuvent être à l’origine de trisomies ou altérer le développement embryonnaire et causer des avortements spontanés, voire conduire à la stérilité. La recombinaison des allèles joue par ailleurs un rôle clef dans l’évolution des espèces : « Elle implique que chaque gamète contient un mélange unique des allèles parentaux, ce qui favorise la diversité des génomes et facilite l’adaptation des espèces aux changements environnementaux. »
Spo11, une protéine conservée au cours de l’évolution
Mais comment cet échange de matériel génétique a-t-il lieu entre chromosomes homologues ? Quelles sont les protéines impliquées dans la coupure de l’ADN ? Car, pour que des allèles soient échangés entre chromosomes homologues, il faut bien casser les deux brins qui forment la molécule d’ADN avant de les recoller. À la fin des années 1990, Bernard de Massy a participé à une percée dans la compréhension de ces mécanismes alors qu’il travaillait dans le groupe d’Alain Nicolas, directeur de recherche CNRS à l’Institut Curie de Paris. Avec leurs collègues, ces chercheurs ont mis en évidence l’importance d’une protéine appelée Spo113 dans l’initiation de la recombinaison méiotique.
« Nous avons montré que cette protéine est responsable des cassures double brin de l’ADN, non seulement dans le modèle expérimental étudié, la levure Saccharomyces cerevisiae, mais aussi chez tous les eucaryotes supérieurs à reproduction sexuée. Ce mécanisme a donc été en grande partie conservé par l’évolution », ajoute le chercheur.
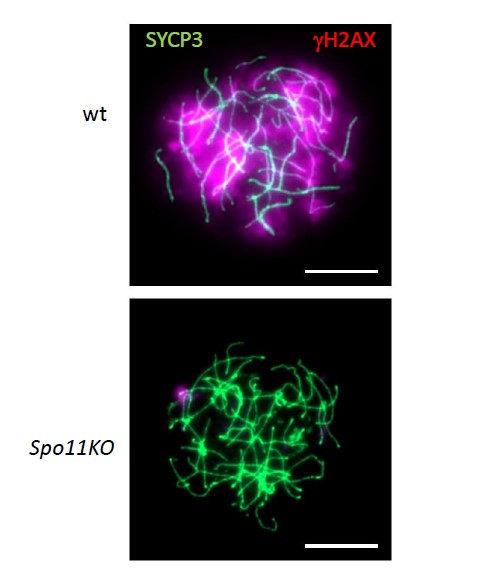 Dans les noyaux de cellules en méiose (ici, spermatocytes de souris), les cassures de l’ADN sont détectées par la présence de gH2AX (histone H2AX phosphorylée). Dans des cellules portant une mutation dans le gène Spo11 (Spo11KO), les cassures de l’ADN n’ont pas lieu. SYCP3 est une protéine de structure des chromosomes. (© Bernard de Massy)
Dans les noyaux de cellules en méiose (ici, spermatocytes de souris), les cassures de l’ADN sont détectées par la présence de gH2AX (histone H2AX phosphorylée). Dans des cellules portant une mutation dans le gène Spo11 (Spo11KO), les cassures de l’ADN n’ont pas lieu. SYCP3 est une protéine de structure des chromosomes. (© Bernard de Massy)
Depuis, Bernard de Massy n’a cessé de chercher à comprendre les différents rouages de ces mécanismes moléculaires. Après avoir monté sa propre équipe à Institut de génétique humaine, le biologiste décide d’étudier la méiose chez la souris et s’intéresse notamment aux sites du génome qui sont les plus susceptibles d’être coupés par Spo11. « Appelés “points chauds de recombinaison”, ces sites se retrouvent chez les mammifères en majorité dans des régions qui contiennent des séquences d’ADN reconnues par la protéine PRDM94. Nous avons démontré que celle-ci agit sur les histones qui structurent la molécule d’ADN pour permettre au complexe moléculaire auquel appartient Spo11 d’initier la recombinaison méiotique », précise le généticien.
Car, oui, Spo11 n’est pas la seule protéine impliquée dans les cassures de l’ADN. « Spo11 présente de fortes similarités avec les topo-isomérases, des protéines qui régulent la topologie de l’ADN. Or ces enzymes forment généralement des complexes impliquant deux protéines. » Mais le ou les partenaires de Spo11 ont longtemps éludé les scientifiques. Ce n’est qu’au milieu des années 2010 que l’équipe de Bernard de Massy a finalement découvert, à travers des approches génétiques et phylogénétiques, l’un de ces partenaires chez la souris5. « Il s’agit d’une protéine que nous avons baptisée Topo-VIB-Like. Elle s’associe à Spo11 pour former une sorte de ciseau moléculaire, appelé TopoVIL, qui permet de couper les doubles brins de l’ADN », explique le chercheur.
Le projet Topobreaks et au-delà
C’est de ces derniers résultats qu’est né le projet Topobreaks, financé par l’Agence nationale pour la recherche : « Nous voulions comprendre comment ces différents partenaires interagissent entre eux et avec l’ADN. » Les chercheurs de l’IGH ont collaboré avec l’équipe de Jan Kadlec, de l’Institut de biologie structurale6 de Grenoble, pour finalement identifier par des approches biochimiques chez la souris un nouveau partenaire qui interagit avec Topo-VIB-Like : REC-114.
« Cette protéine permet de réguler le complexe moléculaire TopoVIL. Petit à petit, nous assemblons les différentes pièces du puzzle », se réjouit le chercheur, qui continue ses recherches sur la recombinaison des chromosomes homologues. Et Bernard de Massy n’est d’ailleurs pas à court d’idée. Il collabore depuis quelques années avec une équipe japonaise pour développer des approches expérimentales innovantes à partir de cellules souches totipotentes6 afin d’étudier ces mécanismes moléculaires de façon plus rapide et moins coûteuse. ♦
Consultez aussi sur CNRS Le Journal
Mécanobiologie : la pression créatrice
Edith Heard, passion épigénétique
Les technologies single cell révolutionnent la recherche en biologie
________________________
Ces recherches ont été financées en tout ou partie, par l’Agence nationale de la recherche (ANR) au titre de l’ANR TOPOBREAKS - AAPG2018. Cette communication est réalisée et financée dans le cadre de l’appel à projet Science Avec et Pour la Société - Culture Scientifique Technique et Industrielle pour les projets JCJC et PRC des appels à projets génériques 2018-2019 (SAPS-CSTI JCJC et PRC AAPG 18/19).
Publications
Spo11
A. Bergerat et al., Nature (1997) ; 386:414-417
DOI: 10.1038/386414a0
PRDM9
F. Baudat et al., Science (2009) ; 327(5967):836-840
DOI: 10.1126/science.1183439
TopoVIL
T. Robert et al., Science (2016) ; 351(6276):943-949
DOI: 10.1126/science.aad530
REC-114
A. Nore et al., Nature Communications (2022) ; 13:7048
DOI: 10.1038/s41467-022-34799-0
- 1. Unité CNRS/Université de Montpellier.
- 3. Sporulation protein 11.
- 4. PR domain zinc finger protein 9.
- 5. L’identification de ce partenaire chez les plantes, MTOPVIB, a été faite de façon concomitante par l’équipe de Mathilde Grelon, de l’Institut Jean-Pierre Bourgin (IJPB) de Versailles.
- 6. a. b. IBS, unité CNRS/CEA/Université Grenoble Alpes.



