A la une
Lorsqu’un patient souffre de graves atteintes aux poumons ou attend une greffe, son oxygénation peut être maintenue par différents dispositifs. La mise en place d’un circuit d’ECMO (Extracorporeal membrane oxygenation), comprenant un oxygénateur sanguin macroscopique, est une solution très prisée mais qui présente plusieurs défauts. Elle comprend la pose d’une canule au niveau de l’aine et du cou, afin d’acheminer le sang jusqu’à la machine, ce qui immobilise le patient au point qu’il ne puisse même pas s’asseoir tant que le dispositif est en place. Au bout d’une vingtaine de jours, le sang aura également coagulé au point de saturer la membrane d’oxygénation et de mettre l’ECMO hors service.
« Le sang “comprend” qu’il sort du corps humain, ce qui déclenche des réactions chimiques qui forment des amas pouvant causer de graves thromboses lorsqu’ils repartent dans la circulation, explique Anne-Marie Haghiri-Gosnet, directrice de recherche au Centre de nanosciences et de nanotechnologies1 (C2N). Nous avons donc besoin de solutions biomimétiques, et c’est justement ce que nous développons dans le cadre du projet BioArtLung. »
Leurrer le sang
BioArtLung fait pour cela appel aux technologies microfluidiques, où des liquides passent dans des canaux de l’ordre du dixième de millimètre de largeur, afin de concevoir un oxygénateur avec une meilleure durée de vie. Financé par l’Agence nationale de la recherche (ANR), le projet est coordonné par Olaf Mercier, chirurgien thoracique à l’hôpital Marie Lannelongue, avec plusieurs partenaires académiques2.
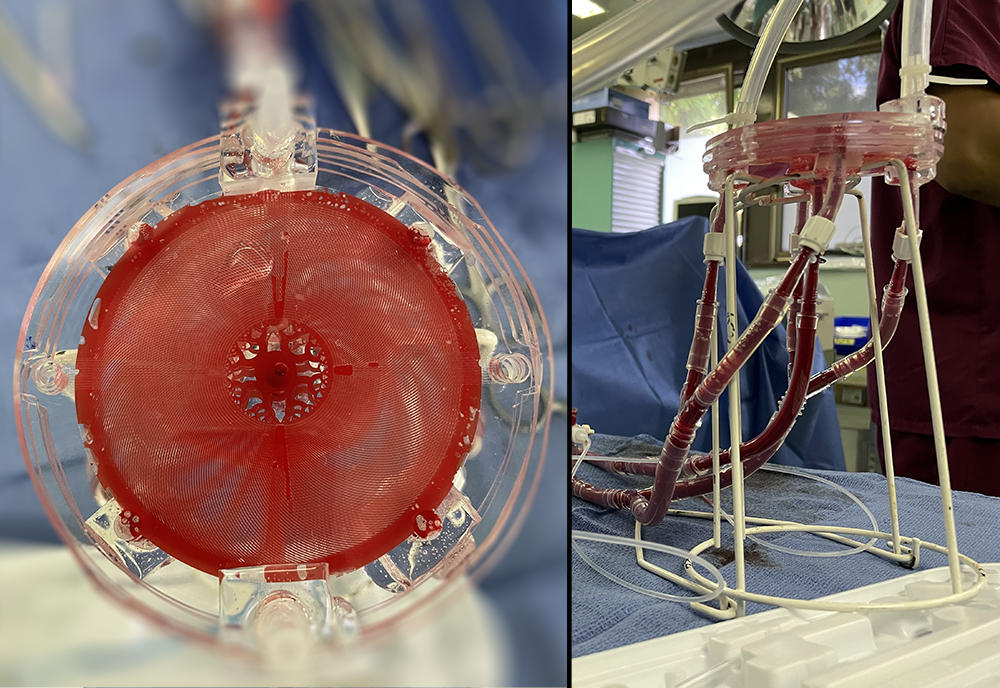
« Les oxygénateurs ECMO se présentent sous la forme de bols, dans lesquels le sang circule autour de fibres creuses dans lesquelles on souffle de l’oxygène, décrit Anne-Marie Haghiri-Gosnet. Nous préférons une approche plus compacte et biomimétique, avec des microvaisseaux sanguins artificiels, tapissés de cellules souches afin que le sang ne se rende pas compte qu’il sort du corps humain pour rejoindre l’oxygénateur. »
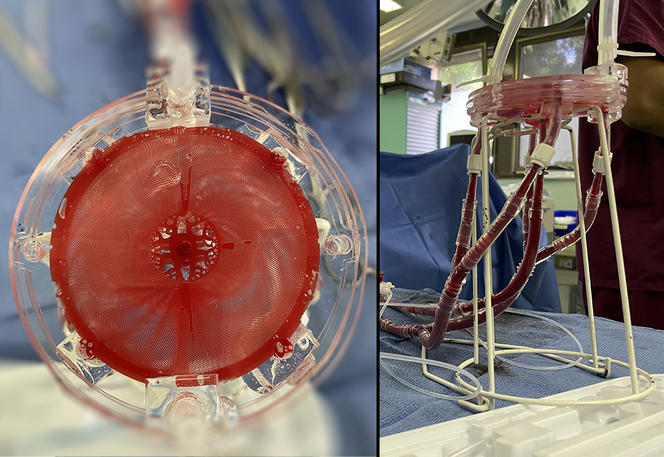
Le sang et l’air se déplacent séparément dans de minuscules canaux en polydiméthylsiloxane (PDMS), un matériau biocompatible déjà utilisé pour des lentilles de contact souples, tandis qu’une membrane extrêmement fine laisse passer les molécules d’oxygène dans le sang. La porosité naturelle de la membrane en PDMS aide dans un même temps à en retirer le CO2. Le système complet se présente sous la forme d’une tricouche : une pour le sang, la membrane, puis une pour l’air ou l’oxygène pur.
Améliorer l’oxygénation
Les tricouches, de dix centimètres de diamètre, peuvent être empilées comme des CD afin de gérer des débits sanguins plus importants. Chaque tricouche peut oxygéner 15 millilitres de sang par minute, et il faudrait en combiner au minimum cent quarante pour permettre une bonne oxygénation sanguine d’un patient adulte. « Notre approche fonctionne mieux que tous les autres systèmes d’oxygénation microfluidique dans le monde, souligne Anne-Marie Haghiri-Gosnet. Fabriquer une seule tricouche au laboratoire nous demande cependant toute une journée de travail, nous démarchons donc des partenaires industriels afin de passer à plus grande échelle. »
Olaf Mercier a de son côté développé et breveté un système de canule double-flux qui ne se pose qu’au niveau du cou, et non plus aussi dans l’aine, ce qui laisse bien plus de mobilité au patient. Cette invention pourra bénéficier à tous les types d’oxygénateurs, y compris les ECMO. L’oxygénateur de BioArtLung a été testé avec succès sur un modèle porcin, mais de nombreux développements sont encore nécessaires avant de passer aux essais cliniques. Les chercheurs songent également à appliquer leur système à la dialyse, qui demande un débit sanguin plus faible que l’oxygénation.
« BioArtLung est entré dans sa dernière année de financement et nous sommes en train de publier nos ultimes résultats, conclut Anne-Marie Haghiri-Gosnet. Nous espérons trouver une collaboration industrielle pour atteindre les cent quarante tricouches et valoriser nos travaux. » ♦
- 1. Unité CNRS/Université Paris-Saclay.
- 2. Le C2N, le Laboratoire d’hydrodynamique (LadHyX, CNRS/École Polytechnique), les unités Inserm 1197 (Interactions entre les cellules souches et leurs niches en physiologie, cancérologie et dans la réparation tissulaire) et 1176 (Hémostase inflammation thrombose), les laboratoires du CEA LITEN (Laboratoire d’innovation pour les technologies des énergies nouvelles et les nanomatériaux) et LEMM (Laboratoire d’études du métabolisme des médicaments).