A la une

Toucher l’ennemi au cœur, avec force et sans dommage collatéral. C’est le credo des thérapies ciblées contre le cancer. Leur principe ? Le même que celui utilisé par les Grecs pour attaquer Troie : un agent cytotoxique transporté par un vecteur capable de se fondre dans la circulation sanguine et de délivrer sa charge médicamenteuse une fois parvenu à destination, au sein des cellules tumorales ou dans leur environnement proche.
L’idée de tels traitements remonte aux années 1980. Depuis une dizaine d’années, elle commence à porter ses fruits, et une poignée de médicaments fonctionnant sur ce principe sont désormais disponibles. De nombreux autres sont en développement, notamment dans les laboratoires du CNRS et de ses partenaires, avec à la clé la création de plusieurs start-up et l’espoir de voir s’enrichir la palette des moyens d’action contre une maladie qui tue 160 000 personnes chaque année en France.
Première stratégie de vectorisation : les conjugués anticorps-médicaments
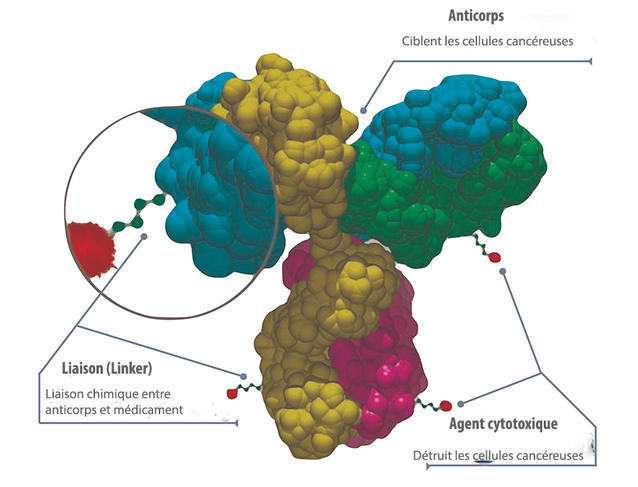
La stratégie de vectorisation la plus avancée à ce jour est celle des conjugués anticorps-médicaments (ADC pour antibody-drug conjugates). Elle consiste à lier une molécule cytotoxique à une grosse molécule biologique – un anticorps monoclonal – capable de se fixer de manière spécifique sur un site protéique de cellules cancéreuses. Une fois l’attelage rendu à destination, le lien chimique entre l’anticorps et le médicament est rompu, par exemple par des enzymes présentes dans l’environnement tumoral, rendant sa capacité d’action au toxique.
Le premier traitement fondé sur un conjugué, ciblant les lymphomes, a été autorisé en 2011. Et aujourd’hui, une dizaine sont accessibles. « Ces dernières années, un cap a été franchi et on entre maintenant dans une période d’accélération de la mise en place des thérapies ADC », analyse Mouad Alami, chercheur au laboratoire Biomolécules : conception, isolement et synthèse1 (BioCIS). Concrètement, biochimie des tumeurs, chimie médicinale, capacité des vecteurs à atteindre effectivement leur cible, contrôle des liaisons chimiques entre anticorps et médicaments… le développement des conjugués nécessite un large front de recherche et d’innovation. D’autant que chaque tumeur a ses spécificités, que la question des effets secondaires demeure prégnante ; à quoi s’ajoute toujours la part d’incertitudes et d’aléas liée au passage de la paillasse aux essais cliniques. Ainsi, de très nombreuses pistes sont explorées, mais les avancées notables se font au compte-gouttes.
Des conjugués plus stables pour durer dans l'organisme
Au laboratoire de Conception et application de molécules bioactives2, Alain Wagner et son équipe se sont par exemple fait une spécialité de la chimie de précision qui permet de lier une molécule active à son « transporteur ». « L’enjeu est de parvenir à maîtriser combien de molécules de médicaments on attache sur un anticorps, comment, et comment on relargue », résume le chimiste. Ainsi, en 2013, ces chercheurs sont parvenus à mettre au point un protocole pour assurer la durabilité dans le temps d’un conjugué. Comme l’explique Sasha Koniev, alors doctorant au laboratoire et désormais directeur de la start-up Syndivia, créée en 2014 afin d’exploiter cette découverte, « les procédés chimiques classiques de bio-conjugaison conduisent à des liaisons dont la stabilité n’est pas durable. Or c’est problématique pour traiter des tumeurs solides, plus difficiles d’accès, qui nécessitent que le conjugué demeure plusieurs jours dans la circulation sanguine pour avoir un effet ». Baptisé APN linker, le procédé a été breveté en 2014. En collaboration avec une société française, Syndivia le met à profit pour la réalisation de conjugués faisant depuis 2020 l’objet d’un essai clinique pour le traitement de cancers du sang et de la moelle osseuse.
En parallèle, la jeune pousse exploite d’autres résultats de l’équipe d’Alain Wagner. En particulier un procédé permettant de contrôler exactement le nombre de molécules médicamenteuses « accrochées » à leur anticorps. Ainsi, ces scientifiques ont été les premiers à réaliser un conjugué « un pour un ». « Dans cette configuration, l’attelage est très proche de l’anticorps seul et sera donc moins rapidement excrété par l’organisme, indique Sasha Koniev qui ajoute : nous avons utilisé ce procédé pour la réalisation de conjugués qui se sont révélés très efficaces contre des tumeurs prostatiques implantées sur des modèles animaux. »
Une meilleure efficacité cytotoxique pour limiter la résistance au traitement
Par ailleurs, Alain Wagner travaille actuellement sur la possibilité de cibler simultanément un récepteur tumoral et un autre du système immunitaire. « Nous cherchons également à greffer deux agents actifs sur un seul anticorps, par exemple une molécule active et un ARN capables d’inhiber une protéine tumorale, dans le but de renforcer la toxicité du médicament », détaille le chercheur. De fait, cette question de l’efficacité de l’agent cytotoxique est centrale. Car paradoxalement, même si le fait d’utiliser un vecteur permet en principe de recourir à des médicaments plus toxiques qu’en chimiothérapie conventionnelle, une si petite quantité parvient à la tumeur que les agents utilisés pour des traitements ciblés doivent être extrêmement puissants pour avoir un effet tangible. Ainsi, actuellement, la plupart des conjugués incorporent des drogues toutes fondées sur le même principe (ce sont des inhibiteurs de la tubuline). Or, comme le précise Mouad Alami, « on s’expose alors à des problématiques de résistance des tumeurs au traitement, d’où la nécessité de mettre au point de nouveaux agents anti-tumoraux puissants qui agissent selon d’autres mécanismes. »
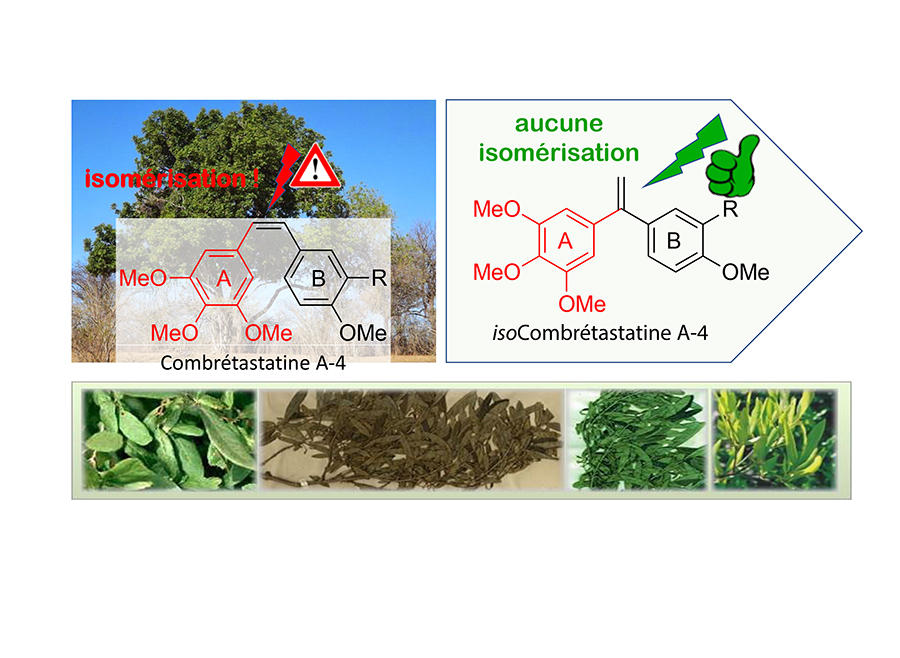
Depuis une quinzaine d’années, ce scientifique s’intéresse à une molécule naturelle, la combrétastatine, extraite des feuilles de l’arbre Combretum caffrum, connue pour avoir un fort effet anti-tumoral et anti-vasculaire. Malheureusement, instable, elle se transforme rapidement en une autre molécule 100 fois moins toxique. Des milliers d’analogues ont été proposés, mais sans résultat probant. Jusqu’à ce que le chimiste effectue en 2007 une modification, brevetée la même année, de la structure de la molécule à laquelle personne n’avait pensé. Bonne pioche : non seulement la molécule devient parfaitement stable, mais son pouvoir cytotoxique demeure intact. Pour le chercheur, la découverte est alors prometteuse : « cette très grande stabilité chimique, notamment en environnement très acide, tel que dans l’estomac, laisse entrevoir la possibilité d’une administration par voie orale, ce qui serait beaucoup moins lourd pour les patients qu’une administration intraveineuse. »
Au fil des années, les chercheurs affinent les propriétés de leur molécule, jusqu’à en proposer une version aux effets cytotoxiques 100 fois plus puissants que ceux de l’originale. « Elle s’est avérée efficace à des concentrations inférieures à 10-9 mole par litre, ce qui est compatible avec une vectorisation par anticorps », s’enthousiasme le chimiste. Conjointement, des dérivés de l’agent toxique capables de s’attaquer aussi bien à la tumeur qu’à son micro-environnement sont mis au point, de même que des versions susceptibles de stimuler le système immunitaire des patients. Et en 2021, un projet de maturation avec la Société d’accélération du transfert de technologies (Satt) Paris-Saclay, conduit à la création de la start-up Elikya Therapeutics. « Dans ce cadre, en collaboration avec l’Institut Gustave Roussy, nos conjugués ont donné de très bons résultats sur la réduction de la croissance de tumeurs dans le cadre d’essais précliniques, décrit Mouad Alami. À terme, nous espérons pouvoir fournir nos molécules sous licence à des partenaires spécialisés dans la formulation de conjugués. »
Seconde stratégie de vectorisation : les prodrogues synthétiques
Aux côtés des conjugués anticorps-médicaments, une autre catégorie de traitements ciblés est en train de voir le jour : les prodrogues synthétiques. L’idée : vectoriser l’agent cytotoxique non pas à l’aide de grosses molécules biologiques, mais grâce à des molécules de synthèse auxquelles il est attaché par une liaison covalente. Comme l’explique Julien Nicolas, directeur de recherche CNRS à l’Institut Galien Paris-Saclay3, « l’utilisation des ADC représente une stratégie thérapeutique extrêmement prometteuse car ils sont très spécifiques vis-à-vis de leur cible et plutôt bien tolérés, même s’ils sont pour l’instant relativement coûteux et complexes à produire. En parallèle des recherches visant à optimiser leurs propriétés pharmacologiques (augmentation du temps de résidence, meilleure pénétration dans les tumeurs, etc.), il semble également important d’explorer des stratégies thérapeutiques complémentaires. »

À l’Institut Galien Paris-Saclay, Patrick Couvreur, lauréat de la médaille de l’innovation du CNRS en 2012, est un pionnier des prodrogues. Dès le début des années 2000, il s’intéresse en particulier au squalène, un lipide naturel présent notamment dans l’huile de foie des requins. Après couplage du squalène à des molécules médicamenteuses, la prodrogue qui en résulte forme spontanément des nanoparticules en milieu aqueux pouvant incorporer jusqu’à 50 % en masse de médicament. En 2017, son équipe démontre notamment qu’une fois dans la circulation sanguine, ces assemblages interagissent avec des lipoprotéines qui sont les transporteurs naturels du cholestérol, dont le squalène est un précurseur. Résultat : elles sont préférentiellement vectorisées vers des cellules tumorales qui se gavent de lipoprotéines pour leur croissance.
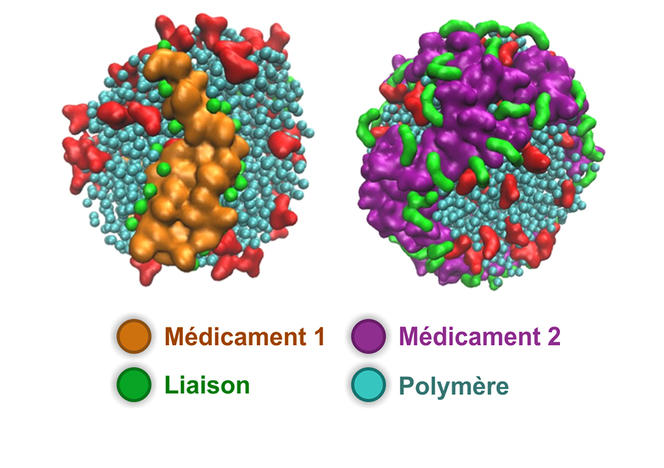
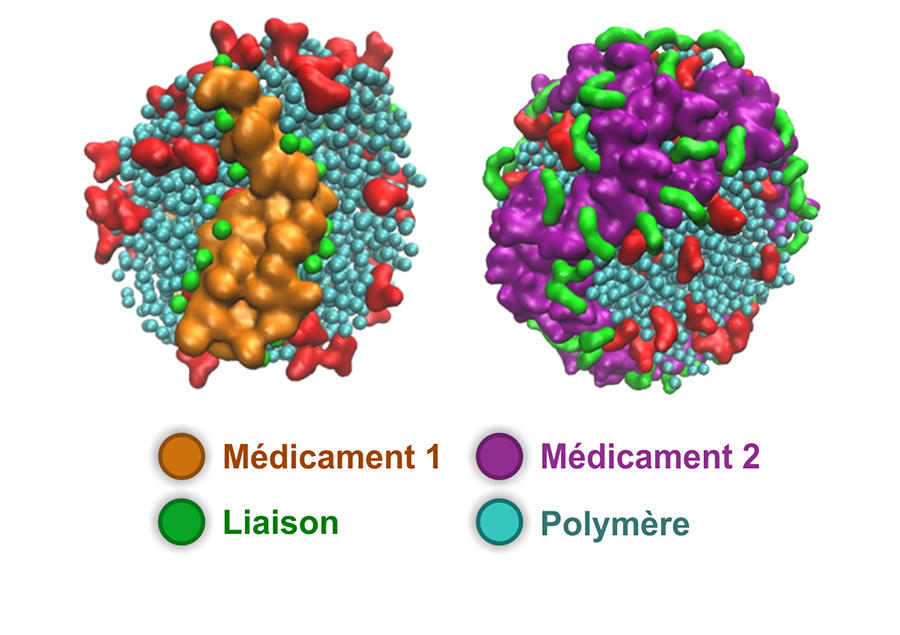
Julien Nicolas, dorénavant à la tête de cette équipe de recherche, propose désormais des nanoparticules de prodrogues formées à partir de polymères synthétiques biocompatibles. Ces dernières années, son équipe a mis au point un procédé de synthèse simple et efficace consistant à faire croître le polymère de manière contrôlée, directement à partir du principe actif. Une fois les nanoparticules sur site, une réaction chimique permise par l’environnement tumoral clive le lien entre le polymère transporteur et le médicament qui retrouve alors son pouvoir cytotoxique. Ainsi, les chercheurs ont formé différentes prodrogues qui ont montré une efficacité anticancéreuse importante chez la souris. Certaines versions de ces assemblages permettent même de véhiculer simultanément plusieurs principes actifs simultanément. « L’intérêt de notre méthode est sa simplicité et sa polyvalence », indique Julien Nicolas.
Des prodrogues hydrophiles pour une action au plus près des tumeurs
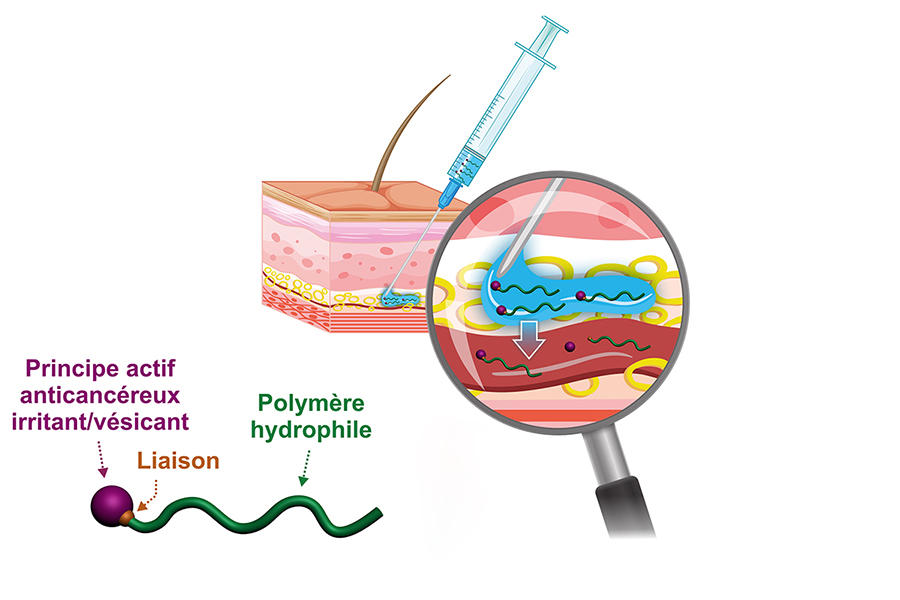
Dernièrement, le chimiste a développé une version hydrophile de ces prodrogues. Résultat : plutôt que de former des nanoparticules, la prodrogue se trouve complètement solubilisée dans le plasma sanguin. « Notre idée est d’une part la possibilité d’une injection sous-cutanée, facile à pratiquer et plus confortable pour le patient, et d’autre part l’obtention d’un effet réservoir du fait d’une libération lente du principe actif dans l’organisme en jouant sur la nature de la liaison chimique entre le médicament et le polymère. Cette prodrogue peut en effet demeurer plusieurs jours dans la circulation sanguine avant son excrétion », explique le chercheur. Pour pousser le plus loin possible ces nouveaux concepts, Julien Nicolas a contribué à créer en 2019 avec d’autres collègues du laboratoire la start-up Imescia. Comme il l’indique, « une première levée de fonds a permis de réaliser une série d’essais précliniques sur des modèles animaux, et nous espérons démarrer des essais cliniques d’ici un à deux ans. »
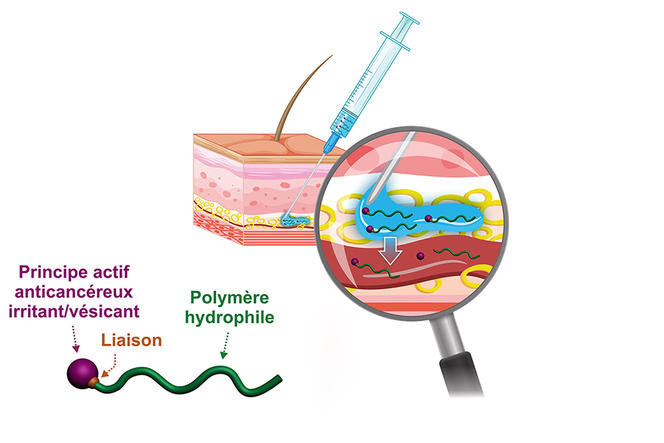
C’est également l’objectif de Sébastien Papot, à l’Institut de chimie des milieux et matériaux de Poitiers4, qui, avec la start-up Seekyo créée en 2018, lève actuellement des fonds pour la réalisation d’essais cliniques de candidats médicaments contre le cancer du pancréas et du sein triple négatif, contre lesquels il n’existe aujourd’hui aucun traitement probant. Leur solution : une petite molécule organique de synthèse sur laquelle il est possible de greffer jusqu’à trois molécules médicaments, et qui se lie à l’albumine du plasma sanguin pour se rendre dans le micro-environnement tumoral. Comme l’explique le professeur des universités, « les cellules cancéreuses présentent une grande hétérogénéité, ce qui les rend souvent difficile à cibler spécifiquement. D’où notre choix d’une approche dite non internalisante. À ce stade, celle-ci nous a permis de traiter des tumeurs humaines du poumon, du côlon, du pancréas et du sein triple-négatif implantées chez des souris avec une efficacité sans précédent ». Avec quelles conséquences, à terme, pour les patients ? Une chose est sûre, les chimistes du CNRS mettent tout en œuvre pour contribuer à faire des traitements ciblés une arme de plus contre une maladie qui demeure la première cause de mortalité en France. ♦