A la une

À mi-chemin entre les modèles in vivo et in vitro, les « organoïdes » sont des modèles cellulaires ex vivo en trois dimensions qui dérivent de cellules souches (cellules indifférenciées). Ils peuvent être considérés comme de « mini-organes » ayant une architecture voire même une fonctionnalité représentative du vivant.
En combinant cette approche des organoïdes cérébraux à celle du modèle poisson-zèbre, des scientifiques du Centre de recherche en neurosciences de Lyon* visent à comprendre les origines d’une maladie génétique rare, le syndrome de Taybi-Linder qui se caractérise par une forme de nanisme associée à des anomalies cérébrales et squelettiques.
 © Simon Bianchetti / CNRL / CNRS Images
© Simon Bianchetti / CNRL / CNRS Images
Les parents d’un enfant atteint du syndrome de Taybi-Linder, une maladie rare qui touche une cinquantaine d’enfants dans le monde, consultent à l’hôpital Femme-Mère-Enfant de Bron (à côté de Lyon) les médecins généticiens, rattachés au Centre de recherche en neurosciences de Lyon, spécialistes de cette maladie.
 © Simon Bianchetti / CNRL / CNRS Images
© Simon Bianchetti / CNRL / CNRS Images
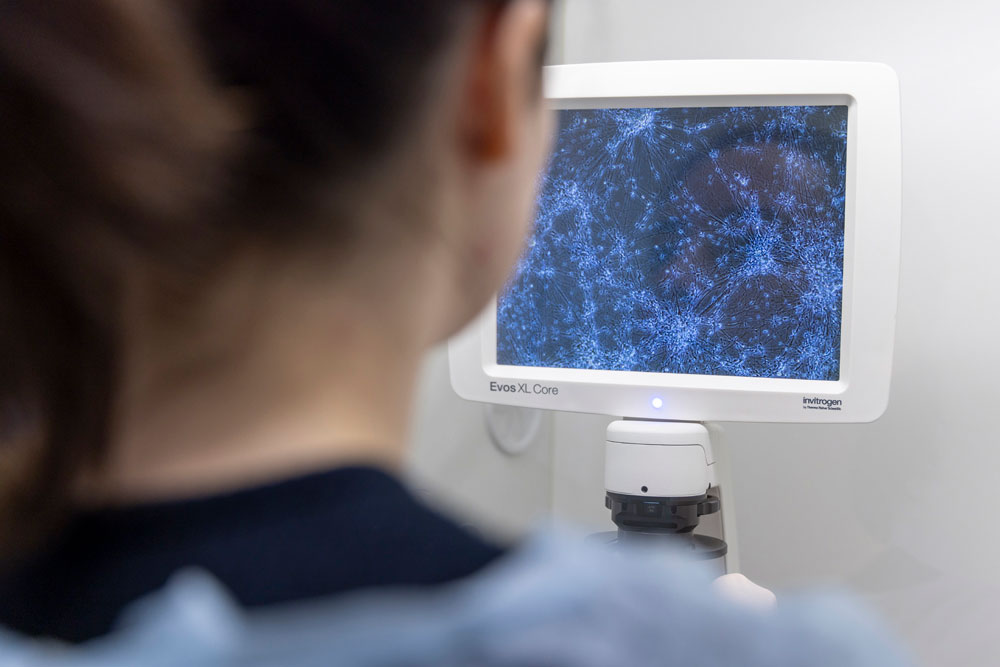
Observation au microscope des cellules différenciées en neurones. Ces cellules ont été obtenues à partir des cellules sanguines d’un enfant malade, qui ont été déprogrammées pour devenir des cellules souches capables de se différencier en n’importe quel type cellulaire, ici des neurones.
 © Simon Bianchetti / CNRL / CNRS Images
© Simon Bianchetti / CNRL / CNRS Images
Les protéines extraites des cellules différenciées en neurones sont déposées sur un gel de polyacrylamide en vue de réaliser une électrophorèse, technique permettant de les séparer selon leur taille, sous l’influence d’un champ électrique. Cette approche permet d’identifier si les protéines que l’on analyse ont une taille anormale (si elles sont plus petites ou plus grandes qu’attendu), et si leur quantité est diminuée ou augmentée. Il a ainsi été montré que plusieurs protéines étaient anormales dans les cellules de patients atteints du syndrome de Taybi-Linder.
 © Simon Bianchetti / CNRL / CNRS Images
© Simon Bianchetti / CNRL / CNRS Images
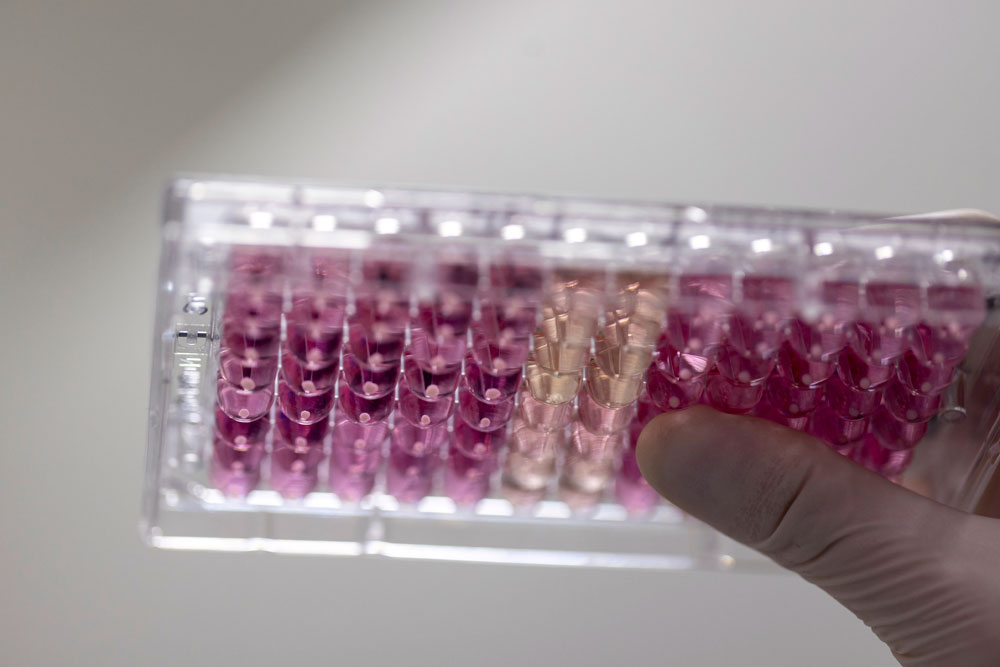
Les organoïdes cérébraux sont répartis dans une plaque de 96 puits (un organoïde par puit). Ils sont obtenus à partir de cellules souches différenciées, puis cultivées pendant trois mois dans un milieu spécifique qui favorise leur croissance et leur auto-organisation en structures tridimensionnelles.
 © Simon Bianchetti / CNRL / CNRS Images
© Simon Bianchetti / CNRL / CNRS Images
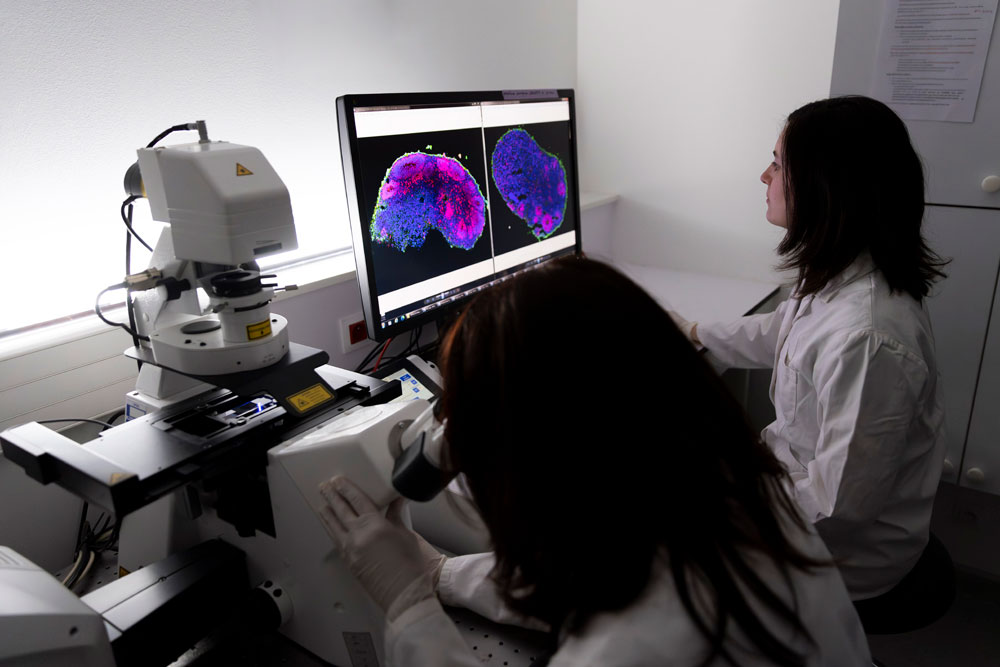
Le microscope confocal à balayage laser permet ici d’analyser la structure détaillée des coupes d’organoïdes cérébraux. L’usage de fluorochromes, molécules fluorescentes, permet de marquer des protéines spécifiques de certains types de cellules et de visualiser ainsi les structures formées par ces cellules après excitation par un laser. En rose, on observe les progéniteurs neuronaux (cellules indifférenciées du système nerveux), en vert les neurones, les noyaux des autres cellules sont quant à eux marqués en bleu.
 © Marion Delous / CNRL / CNRS Images
© Marion Delous / CNRL / CNRS Images
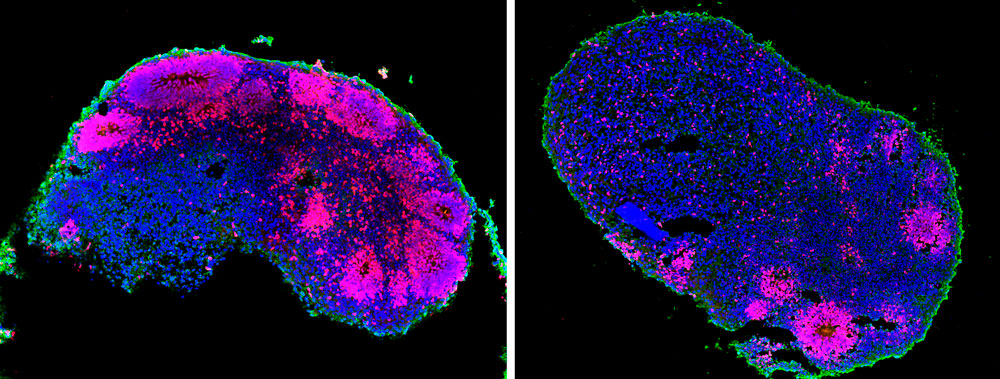
Coupes d’organoïdes cérébraux (donneur sain à gauche et patient à droite). On observe que les progéniteurs neuronaux (colorés en rose), cellules qui se divisent pour former des neurones, sont moins nombreux chez le patient, ce qui pourrait expliquer pourquoi les patients ont des anomalies cérébrales. L’étude de ces modèles permettra de mieux comprendre les défauts cellulaires à l’origine de ces anomalies.
 © Simon Bianchetti / CRNL / CNRS Images
© Simon Bianchetti / CRNL / CNRS Images
Vue d’ensemble de l’animalerie aquacole du Plateau de recherche expérimentale en criblage in vivo (PRECI) de la structure fédérative de recherche Biosciences, située à l’Institut de génomique fonctionnelle de Lyon au sein de laquelle sont élevés les poissons-zèbres, modèle animal utilisé dans le cadre de ce projet de recherche sur la maladie de Taybi-Linder.
 © Simon Bianchetti / CRNL / CNRS Images
© Simon Bianchetti / CRNL / CNRS Images
Des poissons-zèbres adultes au repos dans leur aquarium d’élevage. La similarité génétique et physiologique du poisson-zèbre avec les humains, et le développement « ex utero » des embryons fait de lui un modèle animal attrayant pour la recherche et notamment l’étude des maladies génétiques.
 © Simon Bianchetti / CRNL / CNRS Images
© Simon Bianchetti / CRNL / CNRS Images
Mise en accouplement de poissons-zèbres mâles et femelles. Après une nuit d’échange de phéromones dans un petit aquarium, les mâles sont mis au contact des femelles et fécondent les œufs libérés dans l’eau par la femelle.
 © Simon Bianchetti / CRNL / CNRS Images
© Simon Bianchetti / CRNL / CNRS Images
Une fois fécondés, les œufs sont récupérés dans une boîte de Petri, et maintenus dans un incubateur à 28,5 °C pour un développement optimal.
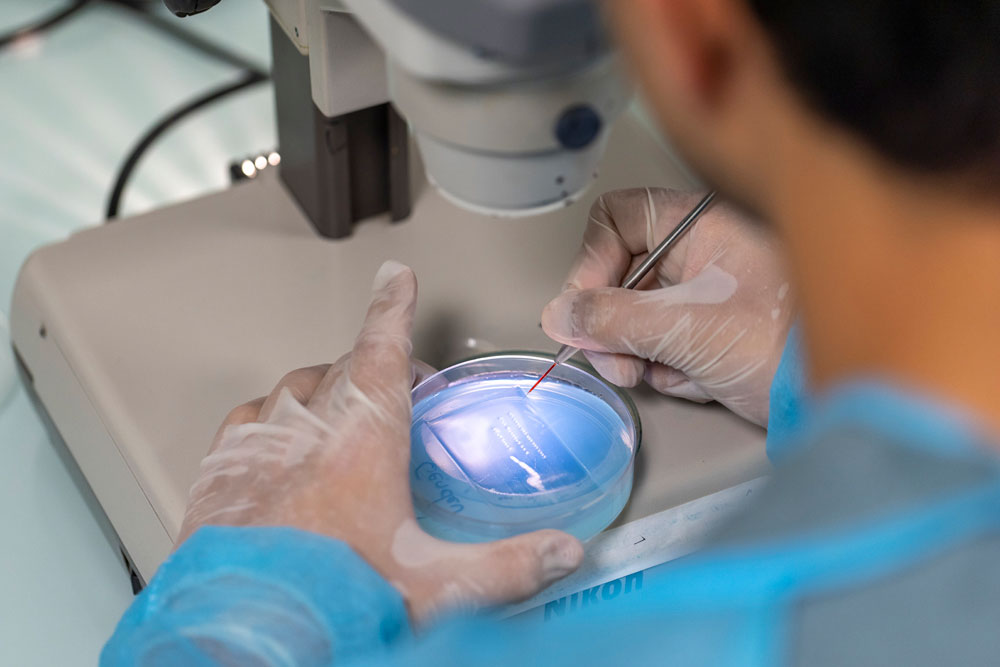 © Simon Bianchetti / CRNL / CNRS Images
© Simon Bianchetti / CRNL / CNRS Images
Alignés sur un gel d’agarose dans une boîte de Petri, les embryons de poissons-zèbres sont injectés avec un morpholino, molécule bloquant le fonctionnement du gène responsable du syndrome de Taybi-Linder. Cette étape permet d’obtenir un modèle animal de la maladie.
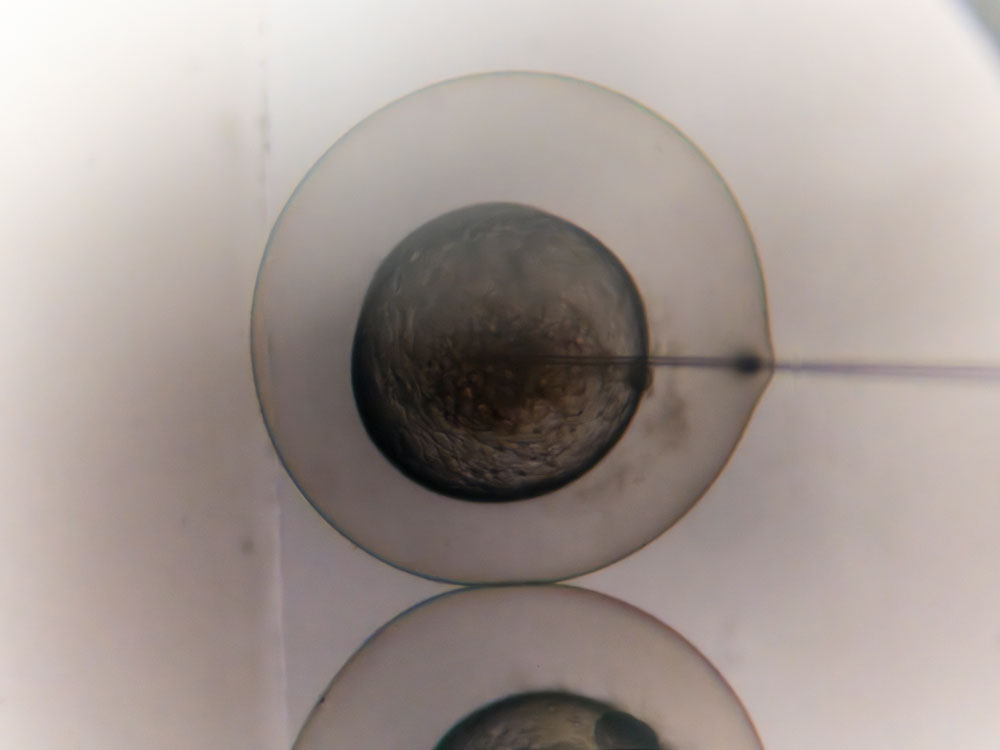 © Simon Bianchetti / CRNL / CNRS Images
© Simon Bianchetti / CRNL / CNRS Images
L’injection est réalisée sous loupe binoculaire à l’aide d’une micro-aiguille, qui permet de transpercer le chorion, enveloppe protectrice de l’embryon et d’introduire la solution dans la cellule. On peut vérifier que l’injection a été correctement réalisée grâce au colorant qui a été, au préalable, ajouté à la solution.
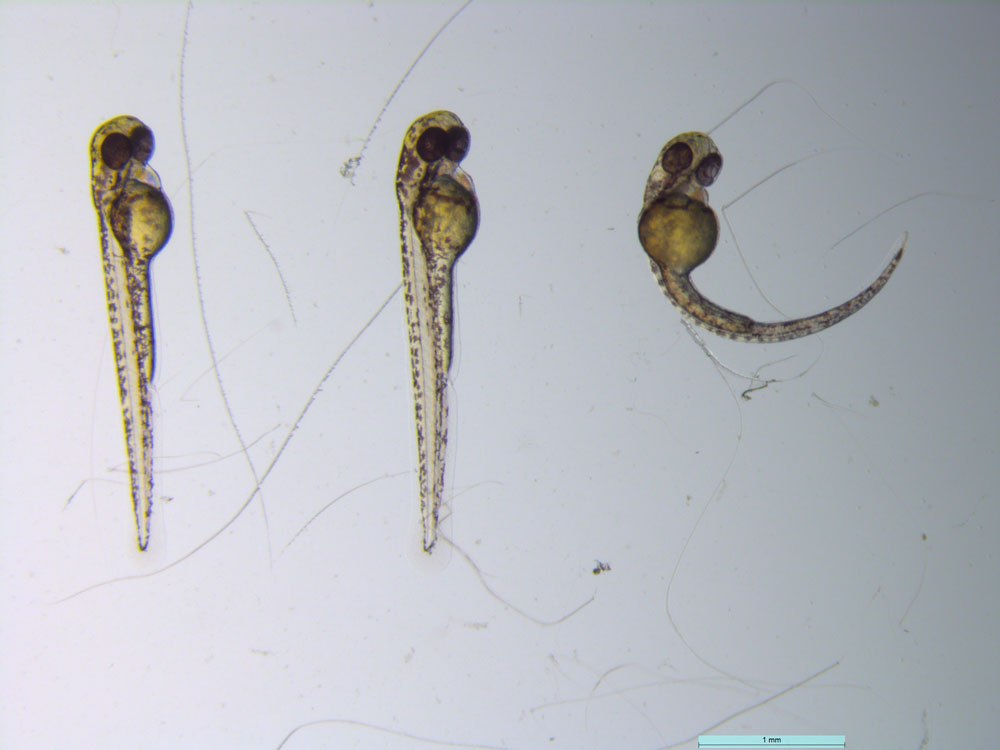 © Marion Delous / CRNL / CNRS Images
© Marion Delous / CRNL / CNRS Images
Les embryons de poissons-zèbres sont observés à la loupe binoculaire 48 h après la fécondation. Une grande partie des anomalies de développement observés chez les patients atteints du syndrome de Taybi-Linder sont dues à un dysfonctionnement également présent chez l’embryon « morphant » (injecté avec un morpholino), qui se traduit, entre autres, par une courbure du corps. Grâce à cette approche, les mécanismes physiopathologiques conduisant au syndrome de Taybi-Linder sont mieux compris, ce qui facilite le diagnostic de cette maladie rare et permettra à terme de mieux prendre en charge les enfants qui en sont atteints.
Découvrez le reportage photos complet « Organoïdes et poissons, modèles d’une maladie rare » sur la médiathèque du CNRS.
*Le Centre de recherche en neurosciences de Lyon (CRNL) est une unité CNRS/Inserm/Université Claude Bernard Lyon 1.
----------------------------------------------------------------------------
Ces recherches ont été financées en tout ou partie, par l’Agence nationale de la recherche (ANR) au titre du projet ANR- U4ATAC-BRAIN -AAPG2019. Cette communication est réalisée et financée dans le cadre de l’appel à projet Sciences Avec et Pour la Société - Culture Scientifique Technique et Industrielle pour les projets JCJC et PRC des appels à projets génériques 2018-2019 (SAPS-CSTI-JCJC et PRC AAPG 18/19).



