A la une

Jusqu’à 1.000 tours par seconde : telle est la vitesse que peut atteindre le moteur du flagelle bactérien. Une ‘nanomachine’ biologique dont les mystères demeurent nombreux, et que le biophysicien Francesco Pedaci s’emploie à percer à jour.
Pour se déplacer, les bactéries disposent de flagelles, dont le nombre diffère selon l’espèce. Modèle de laboratoire, Escherichia coli, bactérie présente dans l’intestin humain, en possède de cinq à dix, affleurant à sa surface. D’une longueur de 5-10 microns, alors que la bactérie n’en dépasse pas deux, ces filaments tournent dans le même sens, s’assemblant en une ‘tresse’ qui se meut comme une hélice de bateau.
Fermement ancré dans la membrane bactérienne, le moteur flagellaire est une machine hautement sophistiquée, et énergétiquement très vorace. C’est ce dernier point qui intéresse l’équipe de Francesco Pedaci, codirecteur de l’équipe « Physique et mécanique des systèmes biologiques » au Centre de biologie structurale1, et coordinateur des projets FLAGMOTOR2 et BaElMec3.
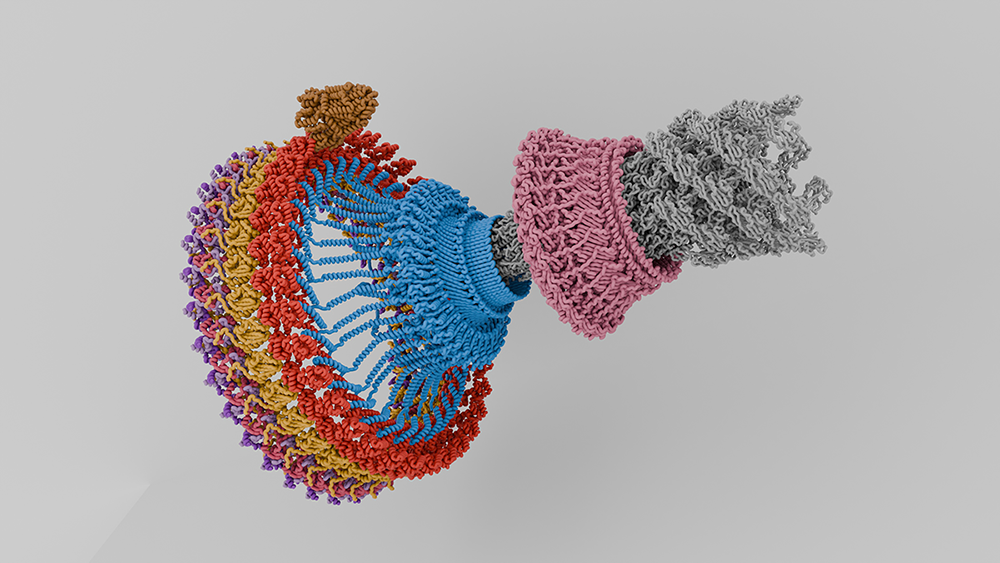 Assemblage du moteur flagellaire montrant différentes protéines avec plusieurs couleurs. © Prash Singh 2024 CC BY 4.0 via Wikipedia
Assemblage du moteur flagellaire montrant différentes protéines avec plusieurs couleurs. © Prash Singh 2024 CC BY 4.0 via Wikipedia
Les protons, force motrice
Carburant du moteur flagellaire bactérien ou Bacterial Flagellar Motor (BFM), les protons sont activement stockés dans l’environnement immédiat de la cellule. Pour approvisionner ce réservoir d’ions H+, elle les expulse via des ‘pompes à protons’ insérées dans sa membrane. Cette opération exige d’importants apports énergétiques, que la cellule tire de la respiration cellulaire, elle-même alimentée par le métabolisme des sucres -en particulier le glucose.
L’extérieur de la membrane est ainsi enrichi en protons, et plus chargé positivement que le milieu intracellulaire. « Cette situation de déséquilibre pousse les protons à rentrer dans la cellule. Or ils ne peuvent pas franchir la membrane lipidique, imperméable, de la bactérie », explique Francesco Pedaci. A défaut de rééquilibre spontané, ce gradient de protons constitue une source d’énergie dont la cellule va tirer parti.
Pour cela, elle recourt à des ‘canaux ioniques’, qui assurent le passage transmembranaire des protons en échange d’un travail. D’une part, le complexe ‘ATP synthase’ convertit cette énergie ionique en énergie chimique, stockée sous forme d’adénosine triphosphate (ATP) -principale monnaie énergétique de tout processus cellulaire. D’autre part, ce flux de protons alimente le moteur flagellaire, dont la partie mobile -le ‘rotor’ relié au flagelle- est entouré d’une douzaine de ‘stators’ insérés dans la membrane cellulaire. Ces canaux ioniques, au fonctionnement très complexe, ‘poussent’ le rotor lorsqu’ils sont traversés par des protons. Leurs propriétés, de sensibilité mécanique et de cinétique coopérative, ont été étudiées par le groupe de Nils Walliser, du Laboratoire Charles Coulomb4, partenaire des projets FLAGMOTOR et BaElMec.
Des dizaines de milliers de protons/seconde
« Cette ‘proton motive force’ (PMF) apporte l’énergie nécessaire pour faire tourner le moteur. La vitesse de rotation, que nous sommes capables de mesurer en laboratoire, présente une relation linéaire avec la PMF. Plus cette force est élevée, plus le moteur tourne rapidement », explique Francesco Pedaci. Chaque seconde, les douze stators transportent jusqu’à des dizaines de milliers de protons vers l’intérieur de la cellule !
Comment mesurer l’activité du moteur, alors que le flagelle est invisible en microscopie optique ? « Les bactéries E. coli sont attachées à la lamelle en verre d’un microscope optique. Nous coupons une partie du flagelle, soit de manière mécanique, soit par délétion génétique de la partie extracellulaire. Nous ajoutons ensuite des microbilles, dont l’une va s’accrocher au morceau de flagelle. Une vidéo à haute vitesse nous permet de mesurer la vitesse de la bille, donc celle du moteur », explique Francesco Pedaci.
Autre technique employée, la modification de la ‘proton motive force’ à l’aide d’outils issus de l’optogénétique. Ce domaine de recherche consiste à introduire dans une cellule un gène codant pour une protéine photosensible, activée lorsqu'elle est éclairée d’une lumière spécifique. En l’occurrence, l’équipe montpelliéraine recourt à des pompes à protons, insérées dans la membrane bactérienne, la protéorhodopsine et la schizorhodopsine, qui permettent respectivement d’augmenter ou d’abaisser la PMF lorsqu’elles sont exposées à une lumière verte.
La réponse instantanée des flagelles
L’étude du moteur flagellaire s’avère riche d’enseignements, aussi bien quant au jeu complexe des stators qu’à la dynamique de la PMF. Les chercheurs se sont en particulier intéressés à un phénomène observé par l’équipe marseillaise d’Axel Magalon, du Laboratoire de chimie bactérienne5, autre partenaire du projet FLAGMOTOR. Privée d’oxygène, E. coli tend, pour des mécanismes inconnus, à concentrer aux pôles cellulaires certains de ses complexes respiratoires, responsables de l’établissement de la PMF. D’où l’hypothèse que, dans certaines conditions, cette force motrice puisse varier localement aux abords de la cellule.
Pour s’en assurer, l’équipe de Francesco Pedaci a recouru à la protéorhodopsine pour augmenter la PMF sur une zone limitée de la surface bactérienne, tout en la laissant inchangée ailleurs6. In fine, les résultats ont montré que ce gain de PMF, aussitôt généré, s’étendait instantanément au reste de la cellule. Qu’il se situe ou non dans une zone subissant un afflux subit de protons, chaque flagelle réagit de manière identique.
Câbles télégraphiques, neurones… et bactéries ?
Comment expliquer cette réponse immédiate de tous les flagelles à un simple changement local ? Bien que les ions H+ diffusent plus rapidement que tout autre élément chimique, « la simple diffusion ne permet pas d’expliquer nos résultats. Si elle était en cause, nous aurions vu un petit décalage d’un moteur à l’autre. Or leur vitesse de rotation augmente en moins d’une milliseconde », explique Francesco Pedaci.
Le phénomène s’expliquerait par la ‘théorie des câbles’ : élaborée au cours des années 1850 pour comprendre le comportement des câbles télégraphiques transatlantiques, elle s’est avérée opérante dans l’étude des neurones… et désormais des bactéries. « II s’agit d’un courant électrique qui se déplace très rapidement le long de la cellule, mais fait intervenir des protons, et non des électrons », explique Francesco Pedaci.
Parmi les applications potentielles de ces travaux, la lutte contre les biofilms. Notamment présentes dans les canalisations, ces communautés bactériennes constituent une menace pour la santé humaine, du fait de leur résistance aux agents chimiques. « De plus en plus de travaux suggèrent que les cellules d’un biofilm peuvent communiquer grâce au voltage transmembranaire », explique Francesco Pedaci. Autre horizon, celui du biomimétisme appliqué au domaine, en plein boom, des nanotechnologies.
-----------------------------------------------------------------------------
Ces recherches ont été financées en tout ou partie, par l’Agence Nationale de la Recherche (ANR) au titre de l'ANR FLAGMOTOR- AAPG2018. Cette communication est réalisée et financée dans le cadre de l’appel à projet Science Avec et Pour la Société - Culture Scientifique Technique et Industrielle pour les projets JCJC et PRC des appels à projets génériques 2018-2019 (SAPS-CSTI JCJC et PRC AAPG 18/19).
- 1. CBS – Unité CNRS / Université de Montpellier / INSERM
- 2. Projet ANR FlagMotor « Le moteur du flagelle bactérien : actionneur et senseur biologique à l’échelle du nanomètre » : https://anr.fr/Projet-ANR-18-CE30-0008
- 3. Projet ANR BaElMec « Electro-mécanique bactérienne » : https://anr.fr/Projet-ANR-23-CE30-0010
- 4. L2C – Unité CNRS / Université de Montpellier
- 5. LCB – Unité CNRS / Aix-Marseille Université
- 6. Biquet-Bisquert et al., Spatiotemporal dynamics of the proton motive force on single bacterial cells, Sci Adv. 2024 May 24;10(21):eadl5849. doi: 10.1126/sciadv.adl5849



