A la une
Présent à l’état latent chez un quart de la population mondiale1, le parasite Toxoplasma gondii se terre au sein des cellules infectées pour mieux se faire oublier de son hôte. Afin de l’en dénicher, une équipe montpelliéraine cherche son point faible.
Généralement asymptomatique, la toxoplasmose peut être redoutable en cas de déficience immunitaire. Avant l’arrivée des trithérapies au milieu des années 1990, elle constituait l’une des principales causes de mortalité parmi les personnes vivant avec le VIH. Aujourd’hui, du moins dans les pays disposant d’un accès universel aux antirétroviraux, ce sont les formes congénitales, suite à une transmission in utero de la mère à l’enfant, qui sont les plus à craindre.
Chez la femme n’ayant jamais été exposée à T. gondii, une primo-infection en cours de grossesse engendre un risque pour l’enfant à naître (mort in utero, séquelles neurologiques, déficits visuels…). En conséquence, les femmes enceintes séronégatives à T. gondii sont appelées à se faire régulièrement dépister, ainsi qu’à éviter la viande mal cuite et à s’abstenir de changer elles-mêmes la litière de leur chat. Pourquoi les chats ? Comme tout félin, ils constituent les hôtes définitifs de T. gondii, les seuls chez lesquels le parasite se reproduit. Sauvages ou domestiques, ces animaux, lorsqu’ils sont infectés, vont libérer dans l’environnement des millions d’oocystes contenant le parasite, via leurs excréments. Sous cette forme, T. gondii peut infecter d’autres espèces, herbivores consommant de l’herbe contaminée, carnivores dévorant ceux-ci. Quant à Homo sapiens, omnivore, il se contamine aussi bien par la viande contaminée peu cuite que par les végétaux mal lavés.
Un stade bruyant, un stade silencieux
Chez les hôtes intermédiaires, dont l’homme, T. gondii, parasite intracellulaire obligatoire (une fois installé chez son hôte, il ne survit qu’à l’intérieur des cellules), peut exister sous deux formes. D’une part le tachyzoïte, prolifératif, responsable de la toxoplasmose aigüe. D’autre part le bradyzoïte, forme latente qui se terre dans les kystes qu’il forme au sein des cellules, notamment celles des muscles, du cerveau et des yeux.
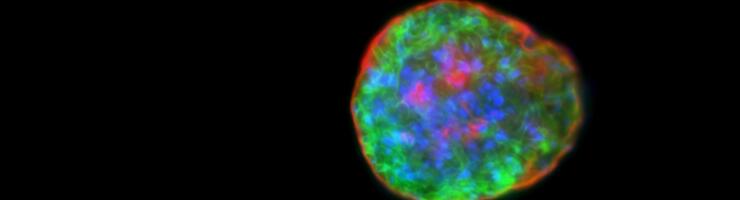
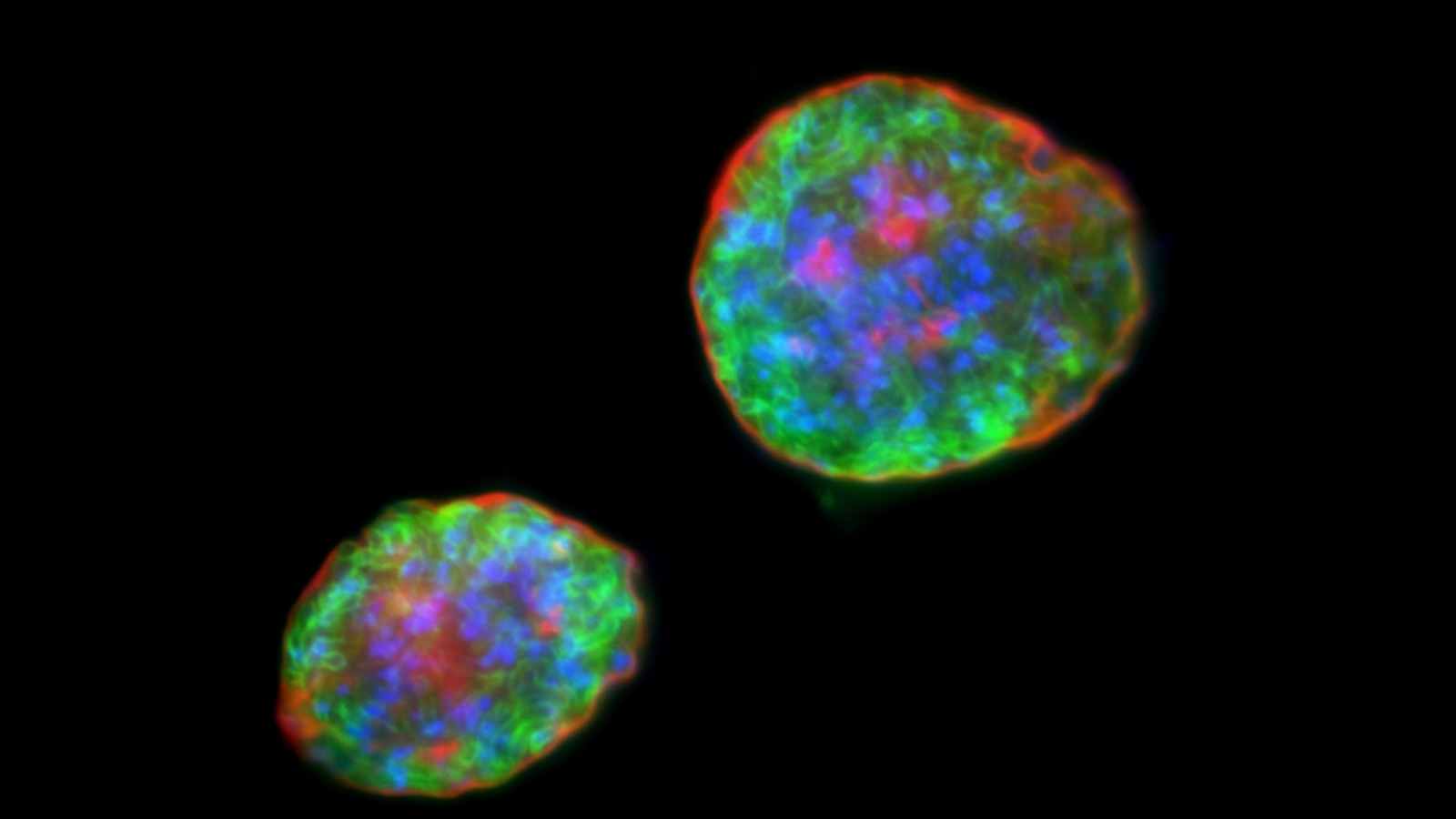 Kystes isolés à partir de cerveau de souris, contenant des formes bradyzoïtes de Toxoplasma gondii. Les parasites sont en vert, leur noyau est coloré en bleu et la paroi du kyste en rouge. © Sébastien Besteiro
Kystes isolés à partir de cerveau de souris, contenant des formes bradyzoïtes de Toxoplasma gondii. Les parasites sont en vert, leur noyau est coloré en bleu et la paroi du kyste en rouge. © Sébastien Besteiro
Chez l’hôte, les bradyzoïtes peuvent se transformer en tachyzoïtes, et vice versa. Si divers antibiotiques sont actifs contre les seconds, il n’existe aucun traitement contre les premiers. Une fois infecté, tout individu est voué à héberger le parasite ad vitam aeternam. D’où l’intérêt d’identifier des cibles contre ces formes chroniques, d’autant que, comme beaucoup d’antibiotiques, ceux actuellement utilisés contre la toxoplasmose aigüe peuvent avoir d’importants effets secondaires.
Dans le cadre de son projet ToxoPlastidTarget, Sébastien Besteiro, du Laboratoire des pathogènes et de l’immunité de l’hôte2, s’est intéressé à l’apicoplaste. Cet organite est caractéristique des apicomplexes, famille d’eucaryotes unicellulaires à laquelle appartient T. gondii, ainsi que les Plasmodium agents du paludisme. Dans l’apicoplaste se déroulent quatre voies de synthèse cruciales pour le parasite, mais absentes chez les mammifères. « C’est une cible thérapeutique privilégiée, qui peut faire espérer une spécificité élevée pour un éventuel médicament », avec des effets collatéraux réduits pour l’hôte, explique Sébastien Besteiro.
L’apicoplaste, aussi vital à l’état latent
Pour cela, l’équipe a tenté de déterminer si l’apicoplaste, crucial au stade tachyzoïte, l’était également chez les bradyzoïtes. La question s’est avérée un véritable casse-tête : au lieu de mutants standard, il a fallu créer des mutants conditionnels, chez lesquels l’atteinte à l’apicoplaste ne surviendrait qu’au stade bradyzoïte, et non au stade tachyzoïte. Recourant à la technique CRISPR/Cas93, les chercheurs ont modifié le génome de T. gondii de manière à ce qu’un gène crucial pour l’apicoplaste, APT1, soit placé sous le contrôle d’un promoteur actif4 uniquement au stade tachyzoïte5.
La protéine codée par APT1 est un transporteur de métabolites impliqués dans deux voies de synthèse se déroulant dans l’apicoplaste. Dans le mutant, le gène, exprimé au stade tachyzoïte, se trouve réduit au silence chez le bradyzoïte. Menée chez la souris, l’expérience s’est avérée concluante : les kystes récupérés dans les cerveaux d’animaux infectés étaient de taille réduite, et non viables lorsqu’ils étaient mis en culture.
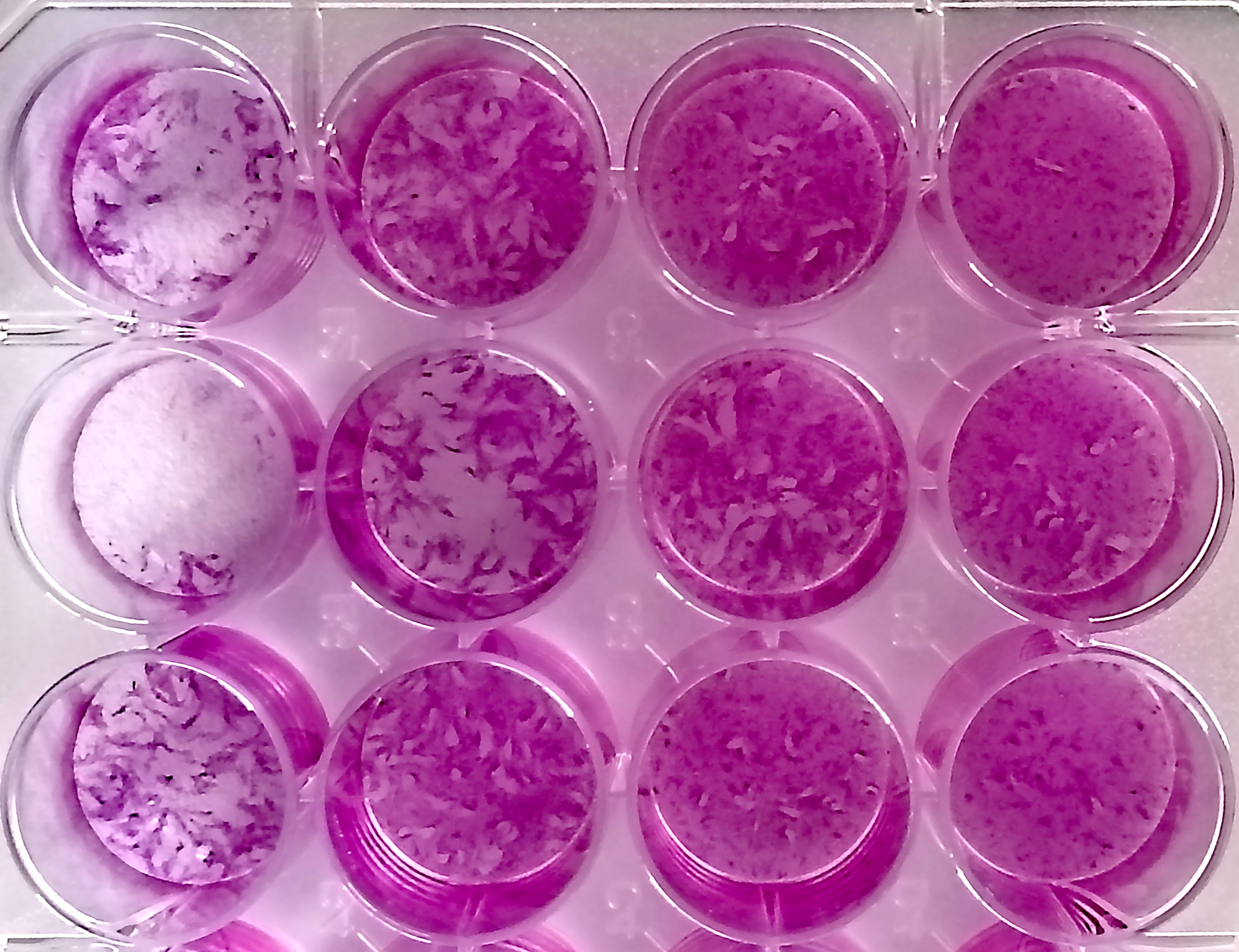 Test de plage de lyse, pour évaluer la croissance parasitaire sur monocouche de cellules hôtes. © Sébastien Besteiro
Test de plage de lyse, pour évaluer la croissance parasitaire sur monocouche de cellules hôtes. © Sébastien Besteiro
Ce résultat a été confirmé par un autre mutant conditionnel. Cette fois-ci, l’équipe a recouru à une version mutée (‘dominante négative’) du gène DrpA, codant pour une protéine impliquée dans la fission des apicoplastes lors de la division cellulaire. A contrario du premier mutant, ce gène altéré, délétère pour le parasite, était sous la dépendance d’un promoteur spécifique du stade bradyzoïte. « Quarante jours après l’infection, il ne restait plus aucune trace du parasite , nous n’avons même pas pu isoler de kystes. Grâce à ces deux mutants, nous avons montré que, en touchant à l’apicoplaste, nous obtenions soit des kystes pas viables, soit l’absence de kyste », résume le chercheur.
Un modèle pour d’autres maladies parasitaires
« Il est possible de cibler l’apicoplaste des bradyzoïtes, mais cela demeure un défi important en termes d’accessibilité. Un médicament devrait franchir la barrière hématoencéphalique, la membrane de la cellule hôte, la paroi du kyste, la membrane du parasite, puis les quatre membranes de l’apicoplaste. De plus, les bradyzoïtes se divisent peu : un médicament n’agirait que très lentement », constate Sébastien Besteiro. Plutôt qu’un ciblage direct, la solution pourrait consister à réactiver les bradyzoïtes, puis à traiter les tachyzoïtes par les médicaments existants. « C’est une approche à double tranchant, qui doit être bien contrôlée, car elle peut être dangereuse chez certaines personnes », dont les immunodéprimées.
Après ses travaux sur les bradyzoïtes, Sébastien Besteiro est reparti à l’assaut des tachyzoïtes, cherchant à caractériser les voies de synthèse des centres fer/soufre, d’importants cofacteurs enzymatiques. Objectif final, découvrir des inhibiteurs permettant de bloquer spécifiquement l’une de ces voies. Au-delà de la toxoplasmose, cette approche pourrait profiter à la recherche menée sur d’autres maladies parasitaires. « Ces travaux pourraient notamment bénéficier à ceux menés sur Plasmodium, car ces voies de synthèse sont très conservées parmi les apicomplexes ».
-----------------------------------------------------------------------------------------------------------------------
Ces recherches ont été financées en tout ou partie, par l’Agence Nationale de la Recherche (ANR) au titre de l'ANR TOXOPLASTIDTARGET- AAPG2019. Cette communication est réalisée et financée dans le cadre de l’appel à projet Science Avec et Pour la Société - Culture Scientifique Technique et Industrielle pour les projets JCJC et PRC des appels à projets génériques 2018-2019 (SAPS-CSTI JCJC et PRC AAPG 18/19).
- 1. Molan A. et al., Tropical Biomedicine, 1er décembre 2019. En France, la prévalence chez les femmes de 30 ans était estimée à 25,94% en 2021 (27,93% en France métropolitaine), en forte baisse depuis 1995 (54,3%), selon des données de Santé publique France citées dans le rapport d’activité 2024 du Centre national de référence (CNR) de la toxoplasmose
- 2. LPHI – Unité CNRS / Université de Montpellier
- 3. Souvent décrit comme des ‘ciseaux moléculaires’, l’outil CRISPR/Cas9, couramment utilisé en laboratoire, permet de modifier de façon très spécifique la séquence d’un gène
- 4. Les promoteurs sont des séquences d’ADN impliquées dans la régulation de l’expression des gènes. Celui utilisé dans l’expérience n’est actif qu’au stade tachyzoïte : il permet donc de restreindre l’expression du gène à ce stade
- 5. Sanchez SG et al., PNAS, 17 août 2023



