A la une

Nous connaissons toutes et tous, de près ou de loin, une personne âgée ayant subi des pertes sévères de mémoire de plus en plus importantes, des troubles du raisonnement, de l’apprentissage ou des fonctions cognitives. L’une des maladies dégénératives les plus connues est la maladie d’Alzheimer. Selon l’INSERM, près de 225 000 nouveaux cas sont dépistés chaque année. Il s’agit d’ailleurs de la principale cause de dépendance lourde du sujet âgé.
Il est déjà possible, aujourd’hui, de diagnostiquer ces maladies neurodégénératives par l’analyse de marqueurs biologiques dans des échantillons, comme le sang ou l’urine. Mais souvent, ces résultats confirment un état déjà avancé de la maladie. La recherche actuelle se concentre donc sur le développement de techniques permettant de les diagnostiquer plus tôt, pour envisager une meilleure prise en charge. Une des pistes envisagée est de parvenir à détecter certaines protéines cibles présentes en quantités infimes dans les échantillons biologiques, et plus particulièrement de subtiles altérations qu’elles subissent lorsque la maladie se déclare.
Découvrons une recherche multidisciplinaire pour la santé mêlant biologie, chimie organique… et un peu de physique des particules.
 © Bruno Aguirre Unsplash
© Bruno Aguirre Unsplash
"Les protéines", nous dit Marion Girod, chimiste CNRS à l'Institut des sciences analytiques1, "peuvent être représentées comme un collier de perles : chaque perle est un acide aminé, l’une des briques élémentaires de la vie. Les protéines ne sont qu’une longue chaine de ces fameux acides aminés. En fonction de la longueur de la chaîne, du type de perles acides aminés qui la composent et de la manière dont ces chaînes se replient sur elles-mêmes, les protéines auront des propriétés différentes."
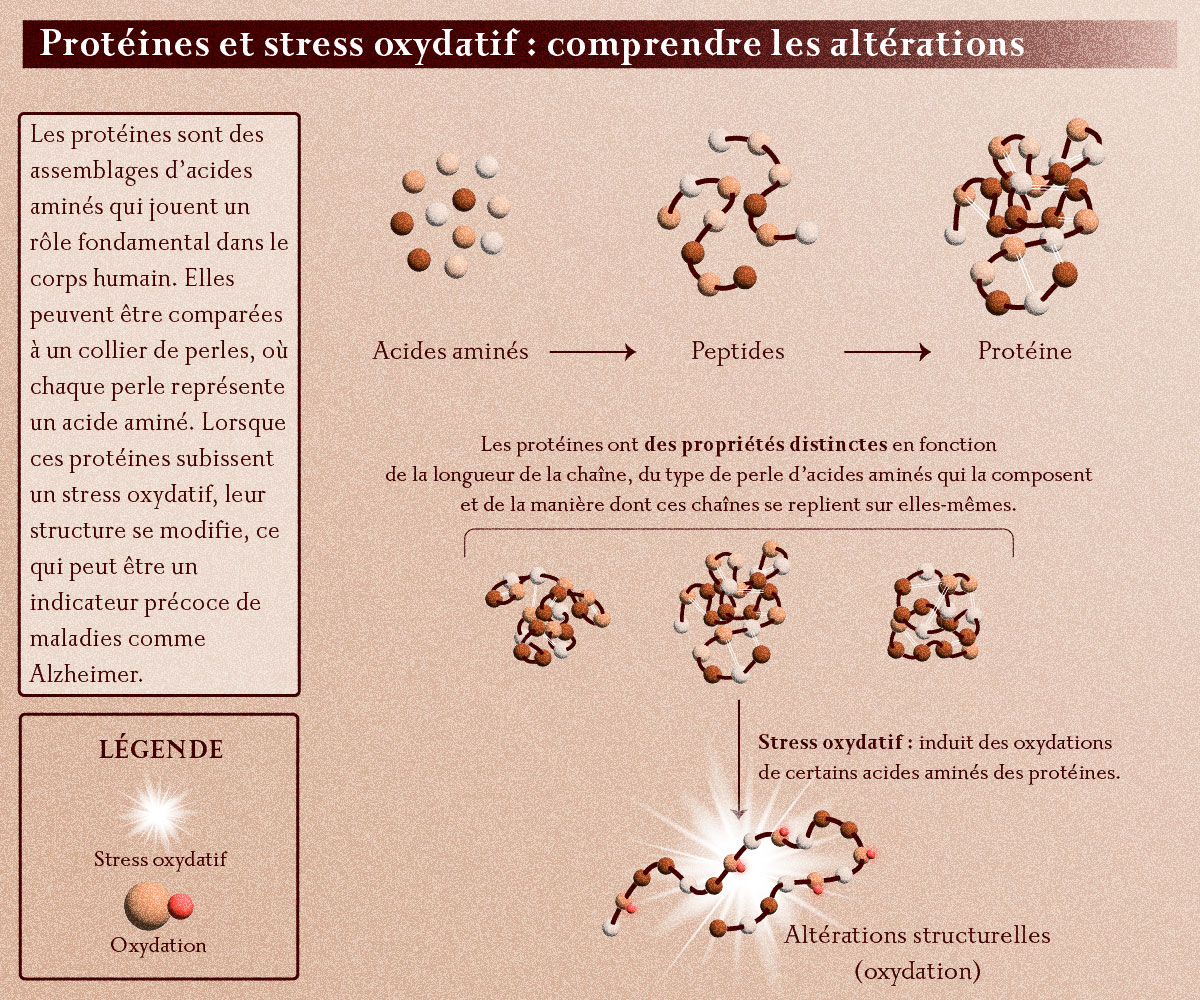 Structure des protéines et effet du stress oxydatif sur les acides aminés qui les composent
Structure des protéines et effet du stress oxydatif sur les acides aminés qui les composent
© Emilie Josse
La recherche a déjà mis en évidence le fait que beaucoup de maladies dégénératives, de cancers, ou de maladies vasculaires étaient induites par un « stress » sur l’ADN, les lipides ou les protéines de notre corps. Ce stress dit « oxydatif » va altérer la structure de l’ADN ou des protéines. Ce sont ces altérations (ces « oxydations ») qu’on espère pouvoir détecter et mesurer le plus tôt possible lors de l’émergence de ces pathologies.
Problème : certaines de ces protéines cibles qui ont subi ce stress oxydatif se trouvent en quantités extrêmement faibles dans les échantillons de sang ou d’urine. De plus, elles sont mélangées avec des milliers d’autres protéines, beaucoup plus abondantes. La concentration de ces protéines « altérées » est parfois si faible, et ces variations si infimes, qu’il faut s’adjoindre l’utilisation d’un des détecteurs le plus sensible, capable de mesurer les propriétés presque molécule par molécule : le spectromètre de masse.
La spectrométrie de masse au secours de l’analyse des protéines
Ce dispositif permet de mesurer l’abondance de molécules, même à des concentrations extrêmement faibles. Il utilise des champs électriques pour accélérer les molécules étudiées en phase gazeuse, séparer les plus grosses des plus petites et les différencier en fonction de deux paramètres : leur masse et leur charge électrique. Ce que l’on mesure est donc le rapport de ces deux grandeurs : masse/charge des ions formés. Le spectromètre permet également de filtrer toutes ces molécules, à la manière d’un tamis, et de ne sélectionner et étudier que les molécules qui ont un rapport masse/charge choisi.
L’inconvénient des protéines est que ce ne sont pas des petites molécules, bien au contraire. Ce sont des assemblages extrêmement longs (à l’échelle des molécules). À titre de comparaison, si une molécule d’eau faisait la taille d’une voiture, une protéine classique mesurerait plusieurs kilomètres de long ! Elles sont bien trop grosses pour être analysées de la façon la plus sensible par spectrométrie de masse.
" C'est pourquoi " nous explique Marion Girod " les protéines sont sectionnées en éléments plus petits. Grâce à des enzymes spécifiquement choisis, il est possible de couper les protéines en éléments plus petits : les peptides. Là où les protéines peuvent être composées de centaines d’acides aminés, les peptides n’en contiendront qu’une dizaine. Les milliers de peptides ainsi obtenus sont séparés par chromatographie liquide couplée à la spectrométrie de masse. Au bout du compte, ce sont uniquement les peptides spécifiques de la protéine recherchée (appelées peptides protéotypique) qui seront finalement ionisés (rendus sensibles aux champs électriques) et détectés dans le spectromètre de masse. "
De nouvelles techniques innovantes d’analyse par spectrométrie de masse
Dans l’utilisation « classique » d’un spectromètre de masse, les peptides injectés dans le spectromètre sont accélérés par un champ électrique, puis eux-mêmes brisés en éléments plus petits encore, ne comprenant plus que deux ou trois acides aminés. Cette dernière fragmentation se fait par choc contre des atomes de gaz contenus dans la cellule de collisions du spectromètre. Ce que l’on mesure, c’est le rapport masse/charge de ces petits fragments puis, à la manière d’un puzzle que l’on reconstitue, il est possible de remonter à la structure de tous les peptides détectés, puis finalement de la protéine d’intérêt présente dans l’échantillon.
L’inconvénient est le fait que l’on se sert de la masse et de la charge pour identifier les fragments. Or, plusieurs ions différents peuvent avoir le même rapport masse/charge, et ainsi être confondus. Si l’on demande au spectromètre de ne sélectionner que les molécules qui ont un certain rapport masse/charge pour la suite de l’analyse, plusieurs molécules différentes seront encore présentes, c’est ce qu’on appelle un signal interférent. L’identification et les mesures risquent donc d’être biaisées.
" L’originalité de notre approche de recherche, nous dit Marion Girod, est de fragmenter les peptides dans le spectromètre de masse, non plus par collision avec des atomes de gaz, mais en les brisant sélectivement à l’aide d’un laser, limitant ainsi le signal interférent."
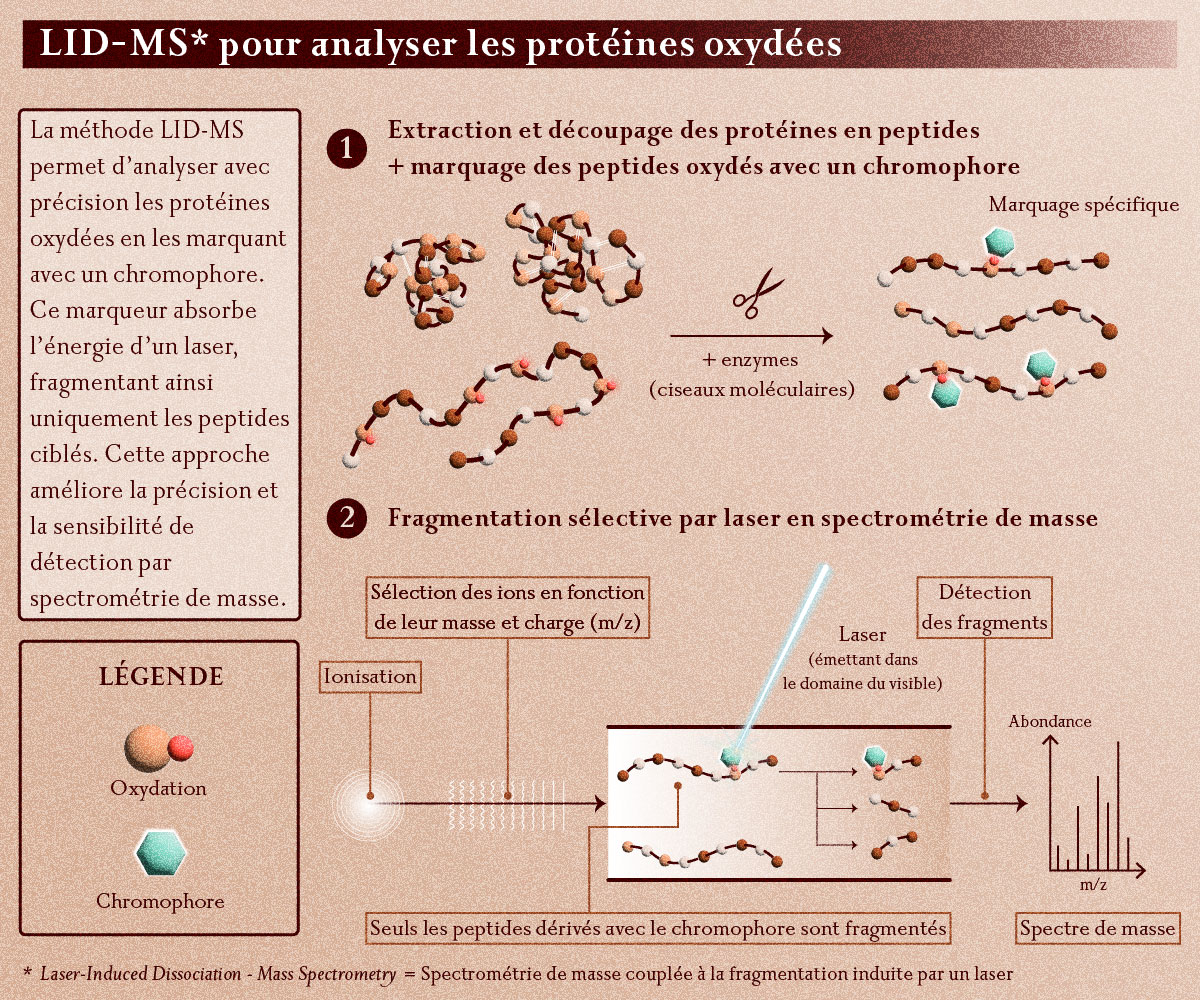 Principe de la méthode LID-MS (Laser-Induced Dissociation – Mass Spectrometry) de fragmentation par laser des peptides d’intérêt marqués par des chromophores dans un spectromètre de masse.
Principe de la méthode LID-MS (Laser-Induced Dissociation – Mass Spectrometry) de fragmentation par laser des peptides d’intérêt marqués par des chromophores dans un spectromètre de masse.
© Emilie Josse
En effet, pour que le laser fragmente les peptides que l’on fait entrer dans le spectromètre, il faut que l’énergie du laser soit absorbée par ces molécules, pour qu’elles soient chauffées et éclatées en morceaux. Mais on ne veut casser que les quelques fragments qui contiennent les acides aminés qui ont subi le stress oxydatif causé par la maladie. C’est pourquoi, de base, le laser est réglé sur une longueur d’onde ou fréquence qui n’est absorbée par aucun peptide. L’astuce est de « marquer » les peptides d’intérêt avec un petit élément chimique appelé « chromophore ». Il s’agit d’un composé organique que l’on greffe chimiquement aux peptides à mesurer, et qui, lui, absorbe l’énergie du laser et la transmet à la molécule à laquelle il a été ajouté. Ainsi, seules les molécules qui ont été marquées par ce chromophore vont absorber l’énergie du laser, se fragmenter, et être détectées dans le spectromètre de masse.
Il existe ainsi toute une bibliothèque de chromophores, chacun adapté à un type particulier de protéines à mesurer, et qui permettront de les sélectionner si précisément que l’on arrive à mesurer des concentrations extrêmement faibles dans les échantillons biologiques à analyser.
Dans le cadre de ses travaux de recherche, Marion Girod s'est intéressée avec son équipe, spécifiquement à l'oxydation de la cystéine, un acide aminé présent dans certaines protéines du corps. Cette oxydation est tout à fait normale chez un individu sain, mais dans le cadre de certaines maladies (neurodégénératives par exemple), le nombre de ces cystéines oxydées augmente par rapport à la normale. Un chromophore spécifique à ces cystéines oxydées a donc été développé. Il permet de mesurer la variation de la concentration des protéines possédant ces cystéines oxydées dans des échantillons biologiques, et sert de marqueur pour l’étude des maladies neurodégénératives.
Une étude en condition réelle de 50 échantillons, comparant les niveaux d’oxydation d’individus sains et de patients atteints de la maladie d’Alzheimer, a montré l’intérêt de cette technique pour deux protéines sensibles au stress oxydatif induit par cette pathologie, avec une oxydation plus importante dans les groupes des patients atteints de la maladie d'Alzheimer.
Ces travaux sont toutefois assez préliminaires et il faudra encore du temps pour utiliser ces mesures comme marqueurs fiables de la maladie d’Alzheimer. Cette nouvelle technique d’analyse de l’altération des protéines pourrait d’ailleurs être étendue à la détection précoce d’autres pathologies (COVID, diabète ou autres maladies neurodégénératives…), mais aussi permettre aux biologistes de mieux comprendre les mécanismes fondamentaux à l’œuvre lors de ces « stress oxydatifs », et leurs liens avec les pathologies associées.
_________________________
Ces recherches ont été financées en tout ou partie, par l’Agence Nationale de la Recherche (ANR) au titre du projet ANR-HyLOXI-AAPG2018. Cette communication est réalisée et financée dans le cadre de l’appel à projet Sciences Avec et Pour la Société - Culture Scientifique Technique et Industrielle pour les projets JCJC et PRC des appels à projets génériques 2018/2019 (SAPS-CSTI-JCJC et PRC AAPG 18/19).
- 1. Unité CNRS, Université Claude Bernard Lyon 1



