A la une
Le 13 février dernier, pour la Saint-Valentin, CNRS Images postait sur le compte Instagram du CNRS une image issue des collections de la photothèque. Nos documentalistes l’avaient sélectionnée parmi d’autres en guise de clin d’œil car on pouvait y voir une cellule en division dont les noyaux des cellules filles sont en forme de cœur. Cette image déposée dans nos collections par Thomas Jungas, du Centre de biologie intégrative1 (CBI), a été beaucoup partagée et a suscité, sur les médias sociaux2, de nombreux commentaires et questions. Cela nous a incités à mener l’enquête pour vous en dire plus sur cette image, son mode d’obtention et son utilisation.
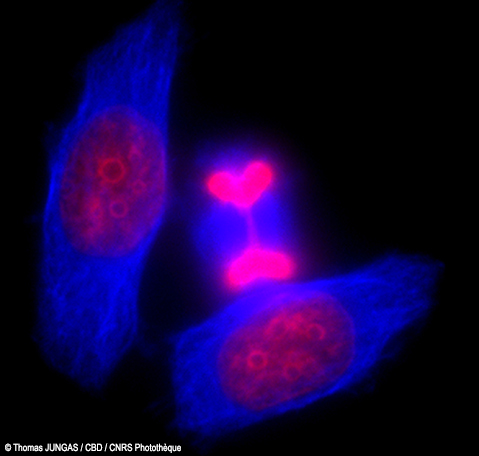 Légende n°1 : Image postée sur le compte instagram du CNRS à l'occasion de la Saint-Valentin (crédit : © Thomas JUNGAS / CBD / CNRS Photothèque)
Légende n°1 : Image postée sur le compte instagram du CNRS à l'occasion de la Saint-Valentin (crédit : © Thomas JUNGAS / CBD / CNRS Photothèque)
Sur quel sujet de recherche travaillez-vous ?
Thomas Jungas : L’équipe dans laquelle je travaille, dirigée par la docteure Alice Davy, est hébergée au Centre de biologie intégrative (CBI) de Toulouse sur le campus de l’université Paul-Sabatier. Nous étudions la mise en place du néocortex, une des structures du cerveau adulte, durant l’embryogénèse. En particulier, nous nous intéressons aux cellules souches (ou progéniteurs neuraux) qui vont donner naissance aux cellules spécialisées qui constitueront notre cerveau adulte (neurones et cellules gliales). Dans l’embryon, elles se divisent à un rythme effréné (toutes les dix heures aux stades précoces) et font le « choix » de produire telle ou telle cellule avec des fonctions très spécifiques sans retour en arrière possible. Comme d’autres équipes dans le monde, nous essayons de comprendre comment se fait ce choix de destin qui déterminera la bonne composition, et donc le bon fonctionnement, du cerveau adulte.
On suppose que le destin des cellules filles se joue en partie au moment de la division de la cellule mère, chacune des cellules générées pouvant faire un choix différent de sa cellule sœur. Nous étudions donc attentivement la réalisation de la division des progéniteurs neuraux.
Pratiquement, il est relativement coûteux et difficile de manipuler des cellules souches neurales. Pour les étapes de recherche préliminaires, nous utilisons des types cellulaires moins exigeants, comme ici la lignée HeLa, qui sont des cellules épithéliales de l’utérus immortalisées, c’est-à-dire des cellules qui continuent indéfiniment de se diviser. Si nos hypothèses sont validées, nous essayons de reproduire nos résultats avec des cellules issues du cerveau.
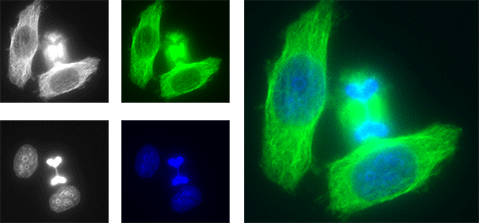 Légende n°2 : Les images récupérées par la caméra CCD sont en noir et blanc (à gauche). Elles sont recolorisées soit en « couleurs naturelles » (au milieu), c’est-à-dire les couleurs observées en vision directe aux oculaires du microscope, ou avec des couleurs arbitraires. Ensuite, elles sont superposées pour donner l’image finale (à droite) (crédit : © Thomas JUNGAS / CBD)
Légende n°2 : Les images récupérées par la caméra CCD sont en noir et blanc (à gauche). Elles sont recolorisées soit en « couleurs naturelles » (au milieu), c’est-à-dire les couleurs observées en vision directe aux oculaires du microscope, ou avec des couleurs arbitraires. Ensuite, elles sont superposées pour donner l’image finale (à droite) (crédit : © Thomas JUNGAS / CBD)
Comment avez-vous procédé pour obtenir cette image ?
T. J. : Pour réaliser cette image, nous avons mis en culture des cellules HeLa (cellules épithéliales utérines humaines) sur une lame de verre pendant deux jours. Nous avons ensuite réalisé un marquage en fluorescence. Nous avons utilisé, d’une part, du DAPI, une molécule qui s’intercale dans la double hélice d’ADN et émet dans le bleu (450-490 nanomètres) lorsqu’elle est excitée par un laser ultraviolet (405 nm). D’autre part, à l’aide d’anticorps, nous avons révélé la présence d’une protéine du cytosquelette, la tubuline. Ici, l’anticorps secondaire révélant la tubuline est couplé à une molécule – appelée fluorochrome – capable d’émettre dans une longueur d’onde précise (ici verte, 525 nm) lorsqu’elle est excitée par un laser bleu (488 nm).
Nous avons observé cette lamelle sous un microscope à fluorescence équipé d’une caméra CCD qui convertit le signal lumineux en signal électrique traduit en pixels d’intensités variables. En changeant alternativement les filtres d’excitation sur le microscope, nous pouvons visualiser chaque couleur une par une et collecter la lumière réémise par les différents fluorochromes à l’aide du capteur de la caméra. Nous attribuons ensuite des couleurs réalistes ou arbitraires pour recoloriser les images obtenues. L’image finale résulte donc de la superposition des images collectées séquentiellement lors de l’excitation des marqueurs par les lasers de longueurs d’onde différentes et recolorisées arbitrairement. D’ailleurs, certains comités de rédaction des publications scientifiques recommandent aux auteurs de tenir compte du daltonisme et de ne pas associer le vert et le rouge lors de la recolorisation des images.
 Légende n°3 : Représentation linéaire en longueur d'onde (nm) du spectre lumineux visible (source de l'image : Wikimedia commons)
Légende n°3 : Représentation linéaire en longueur d'onde (nm) du spectre lumineux visible (source de l'image : Wikimedia commons)
Comment expliqueriez-vous la microscopie à fluorescence à un public de non-spécialistes ?
T. J. : Nous travaillons à une échelle qui n’est pas visible à l’œil nu. La microscopie nous permet tout d’abord de grossir les objets que nous souhaitons observer grâce à l’utilisation d’objectifs grossissants. Nous exploitons en plus des propriétés particulières de la lumière, et plus spécifiquement de la réaction de molécules appelées fluorochromes avec la lumière. Les fluorochromes sont des molécules qui absorbent la lumière (plus précisément des photons généralement émis par un laser) et réémettent une partie seulement de cette lumière, dans une longueur d’onde spécifique. En utilisant différents lasers comme source d’excitation des fluorochromes et des collecteurs spécifiques de certaines longueurs d’onde d’émission, nous pouvons visualiser la présence et la localisation de ces molécules dans nos échantillons. Nous pouvons soit observer directement cette lumière fluorescente aux oculaires du microscope, soit reconstituer une image informatiquement, à partir de signaux de détection obtenus via une caméra. Il ne reste plus qu’à coupler ces fluorochromes à des anticorps ou d’autres molécules nous permettant de visualiser les composants de la cellule que nous souhaitons observer.
 Légende n°4 : Observation et acquisition d'images de cellules neurales de souris au microscope à fluorescence. Cette photo a été prise à l’Institut du cerveau et de la moelle épinière (crédit : © Cyril FRESILLON / CNRS Photothèque)
Légende n°4 : Observation et acquisition d'images de cellules neurales de souris au microscope à fluorescence. Cette photo a été prise à l’Institut du cerveau et de la moelle épinière (crédit : © Cyril FRESILLON / CNRS Photothèque)
Comment se fait-il que le noyau de la cellule prenne une forme de cœur ?
T. J. : La cellule est en train de se diviser dans l’axe haut-bas. On dit qu’elle est en mitose et plus précisément en fin de télophase. Les noyaux, en cours de formation, sont courbés par les changements morphologiques imposés par la division de la cellule et dans ce cas particulier, prennent la forme de cœur. Le noyau a plus classiquement parfois la forme de croissant à cette étape de la division.
De plus, ces cellules sont au fond d’une boîte de culture et ne manquent pas de place pour se diviser. Dans notre organisme, les choses sont un peu différentes. Les cellules sont souvent plus confinées et doivent jouer des coudes avec leurs voisines pour pouvoir se diviser.
Cette image a un caractère esthétique de par ces noyaux de cellule en forme de cœur, mais l’avez-vous également conservée pour son intérêt scientifique ?
T. J. : Cette image est effectivement esthétique mais elle revêt aussi un caractère scientifique. Le projet pour lequel cette image a été réalisée avait pour but de mieux comprendre les mécanismes qui contrôlent la séparation physique de deux cellules filles à l’issue de la division. Nous avons publié ces travaux dans un journal international (Journal of Cell Biology du 29 août 2016). Nous avions d’ailleurs à cette occasion fait la couverture du journal avec une image de cellules en division. L’objectif précis de cette expérience était de quantifier le nombre de cellules qui se divisent en fonction de diverses conditions expérimentales, ainsi que de mesurer leur temps de division.
 Légende n°5 : Couverture de la revue scientifique Journal of Cell Biology du 29 août 2016
Légende n°5 : Couverture de la revue scientifique Journal of Cell Biology du 29 août 2016
Une autre image de cellule en division a été utilisée pour la couverture de la publication scientifique. Pourquoi a-t-elle été choisie d’après vous ?
T. J. : Lorsque nos travaux sont acceptés pour publication sous forme d’article, après évaluation de leur contenu par un comité d’experts, ils sont regroupés dans des versions papiers des journaux. L’éditeur propose alors à chaque auteur de soumettre une image qui n’a pas été utilisée dans les figures de l’article. Elle revêt soit une dimension artistique, soit a valeur d’illustration ou de résumé du message de l’article soumis, soit les deux.
La revue sélectionne une image qui apparaîtra en couverture. Être présent en couverture est un choix éditorial pour mettre en avant un article en lui ajoutant de la visibilité.
Que vous apporte l’utilisation des images dans le cadre de vos recherches ?
T. J. : L’utilisation d’images est essentielle dans nos travaux. Elle nous permet de voir les résultats de nos manipulations expérimentales et de constituer des banques de données analysables et quantifiables. C’est la base de nos approches expérimentales mais, pour adresser nos questionnements, nous utilisons également d’autres approches technologiques que l’imagerie comme l’amplification d’ADN, la cytométrie de flux ou des gels de protéines.
Propos recueillis par Elizabeth Jacquinot et Nathalie Lambert
Si ce billet vous a intéressé, lisez également le blog « Aux frontières du cerveau ».




