Vous êtes ici
Cancer, le double jeu du fer
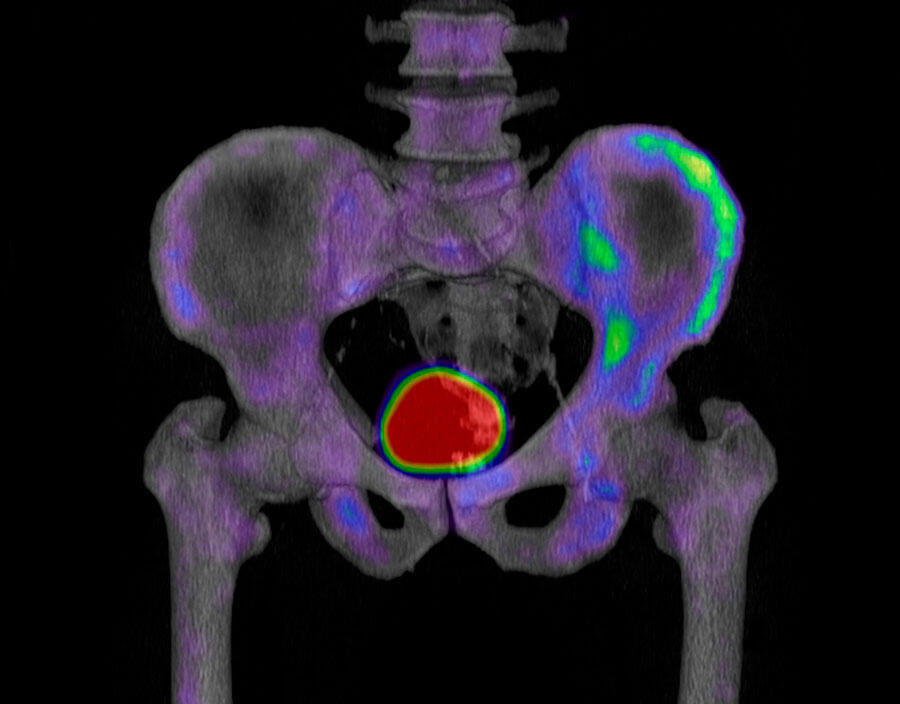
Le cancer, le mal du siècle, continue de résister à l’arsenal thérapeutique développé au fil des ans par les scientifiques du monde entier. Le fait est que le cancer est retors. Aujourd’hui, la plupart des thérapies ciblent préférentiellement les cellules cancéreuses en prolifération. Ces divisions rapides, en plus de permettre à la tumeur de croître, induisent une pression de sélection sur leur propre communauté. Ainsi, au sein de la tumeur, certaines cellules s’adaptent et arrêtent de se diviser pour entrer dans une sorte de dormance leur permettant d’échapper aux traitements.
Plus encore, cet état non prolifératif est associé dans certains cas à d’autres propriétés, à savoir la capacité à migrer, à envahir d’autres tissus – bref, à métastaser. Ces cellules métastatiques ont, de surcroît, une plus forte résistance aux chimiothérapies actuelles et un fort potentiel de colonisation. Elles sont l’objet des travaux de scientifiques du CNRS, de l’Institut Curie et de l’Inserm dirigés par le chimiste Raphaël Rodriguez1. « La thématique majeure de mon laboratoire est de comprendre qu’elle est la nature de cette adaptation et quelles en sont les bases chimiques et moléculaires sous-jacentes, précise le chercheur. Sachant que si on comprend comment ces cellules s’adaptent, on peut identifier de nouvelles cibles et, par conséquent, inventer de nouveaux médicaments qui cibleront et entraveront ces adaptations. »
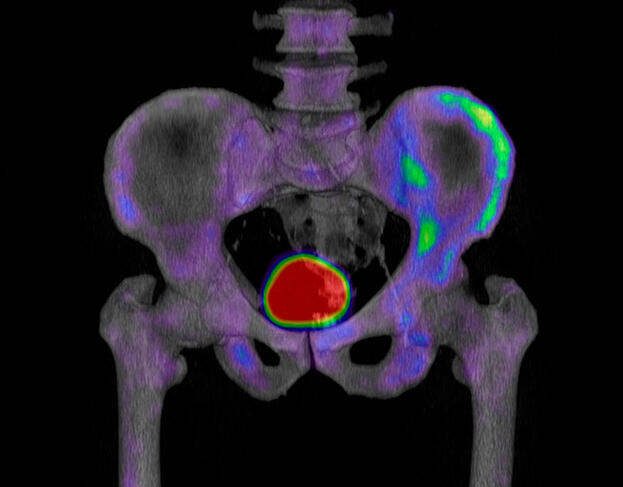
Cette approche, aussi novatrice qu’unique, a vu ses résultats publiés dans la revue Nature2. Elle tire parti à la fois d’une petite molécule mise au point au laboratoire et d’un processus de mort cellulaire médiée par le fer et récemment mis en évidence : la ferroptose.
Le fer, essentiel dans le vivant
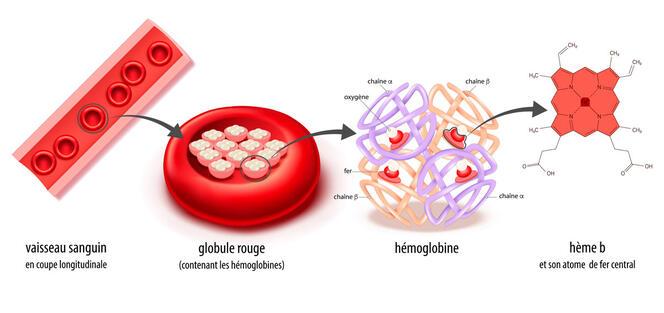
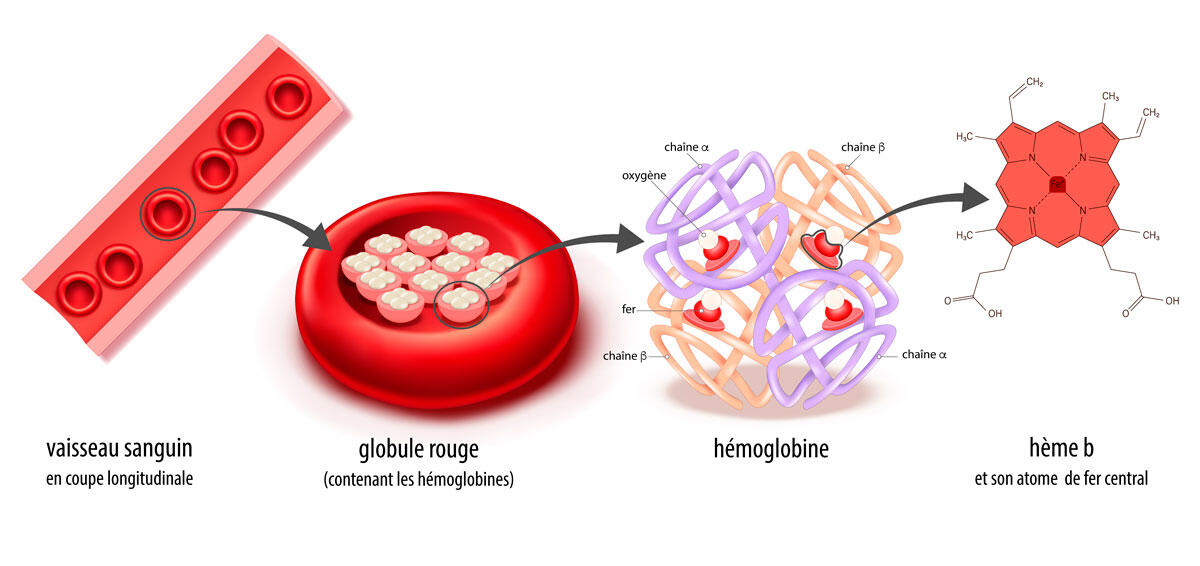
Métal présent en grande quantité dans la croûte terrestre, le fer joue aussi un rôle essentiel dans le monde du vivant – notamment comme transporteur d’oxygène via l’hémoglobine (ce qui lui confère sa couleur rouge caractéristique). Plus récemment, le fer a été identifié comme facteur majeur d’un type de mort cellulaire appelé « ferroptose ».
« La ferroptose, c’est une vulnérabilité de la cellule à la chimie du fer, décrit le chercheur. En réaction à une forte concentration interne de fer, la cellule invente des mécanismes pour en neutraliser les effets délétères. Pour une cellule cancéreuse, si les mécanismes neutralisants sont toujours efficaces, alors la cellule vit, s’adapte et peut métastaser. En revanche, si la cellule n’est pas capable de s’accommoder aux effets secondaires d’une concentration élevée en fer (en l’occurrence, la production de radicaux libres d’oxygène), eh bien, elle meurt. »
Plus précisément, une fois le fer internalisé dans la cellule au sein d’un compartiment cellulaire, il va réagir au peroxyde d’hydrogène (eau oxygénée) qui y est présent et produire des radicaux libres d’oxygène. Ce sont ces derniers qui sont à l’origine de la dégradation des lipides constituant la membrane du compartiment. Dégradation qui se propagera de proche en proche à l’ensemble des compartiments cellulaires (noyau, mitochondrie…), menant in fine à la mort de la cellule par ferroptose.
En somme, le fer joue ici un double jeu : indispensable à la transformation des cellules tumorales primaires en cellules métastatiques, le fer, en trop grande quantité, induit leur autodestruction par ferroptose.
Une nouvelle voie d'internalisation des métaux
« En 2020, nous avons découvert une nouvelle voie d’internalisation des métaux dans les cellules par l’intervention d’un récepteur membranaire appelé CD44, explique le chimiste. Nous avons démontré que ce récepteur permet d’absorber les métaux présents dans l’environnement direct de la cellule, en particulier le fer et le cuivre. Or on sait que les cellules cancéreuses en cours de transformation surexpriment CD44. »
Mais quel rôle le fer joue-t-il dans ce mécanisme ? « Pour devenir métastatique, la cellule cancéreuse primaire doit changer de profil d’expression de ses gènes. Il faut savoir que les cellules de notre organisme n’expriment pas toutes les mêmes gènes. Leur expression est, entre autres, régulée par l’accessibilité de certains gènes aux facteurs de transcription qui définit l’identité et la nature du tissu. »
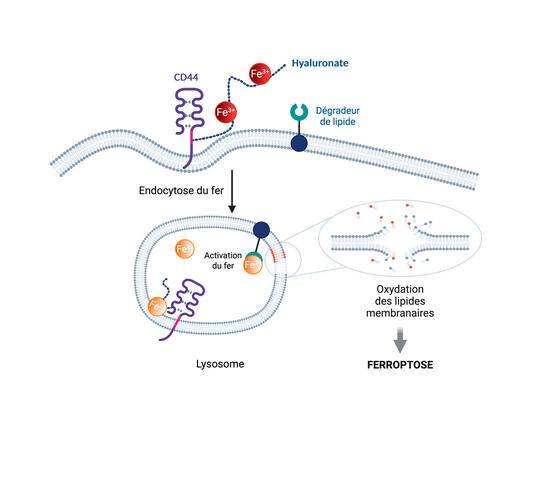

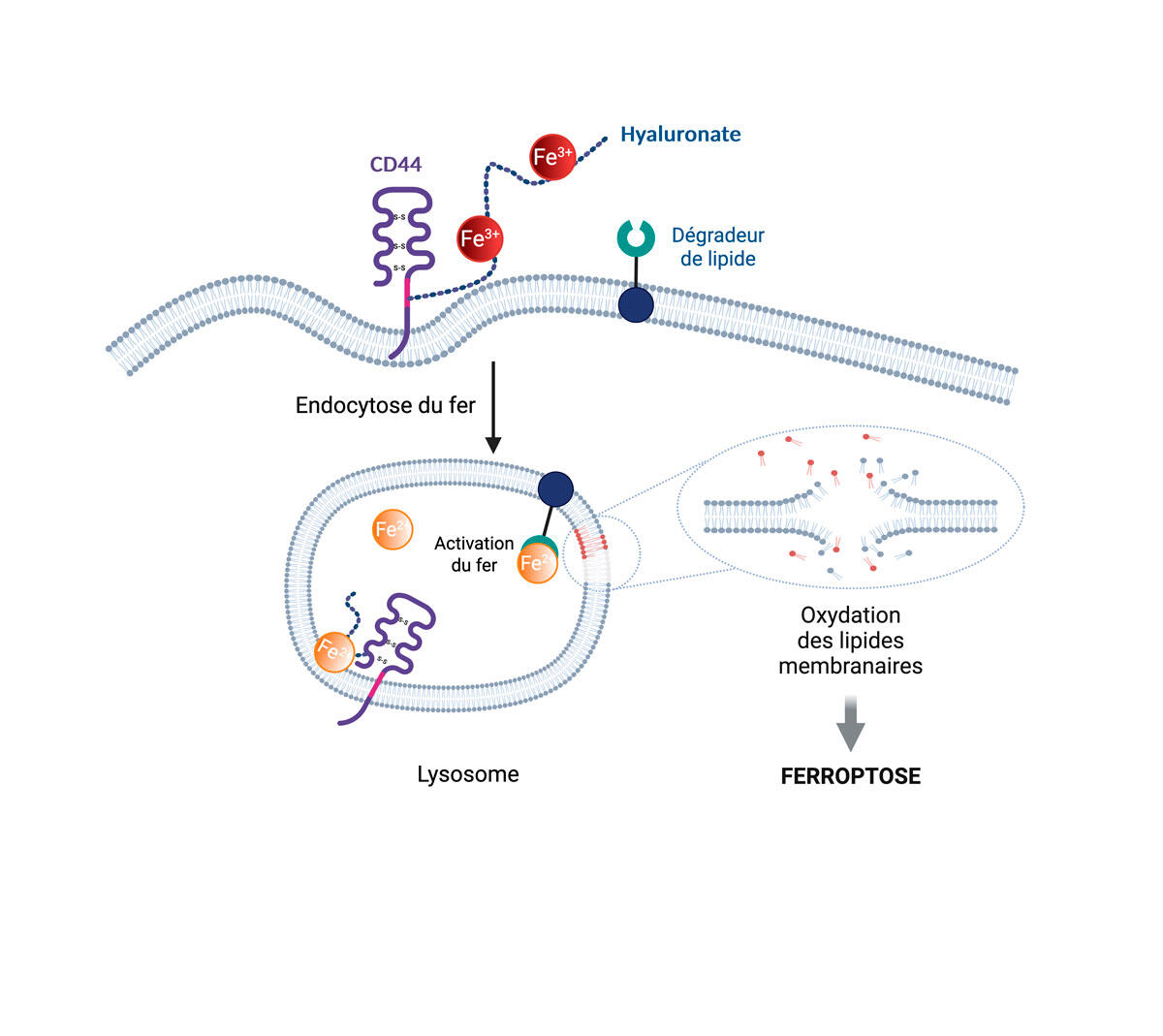
Or le fer permet de catalyser l’accessibilité de certains gènes – et donc leur expression –, notamment de ceux impliqués dans l’acquisition de résistances aux traitements classiques. Les cellules cancéreuses ont donc besoin de fer pour devenir métastatiques. C’est ce phénomène que le scientifique du CNRS cherche à exploiter pour se débarrasser des cellules métastatiques.
Médiateur de la ferroptose
En effet, lors de leur transformation, les cellules cancéreuses se trouvent sur une ligne de crête. Pour échapper à la mort par ferroptose, elles doivent développer des mécanismes limitant l’apport de fer dans la cellule.
« Notre objectif est clair : c’est de faire pencher la balance vers la mort plutôt que vers la dissémination. Pour cela, il existe une fenêtre de tir pour exploiter cette abondance de fer, s’enthousiasme Raphaël Rodriguez. Notre idée, c’est de saturer les systèmes de protection de la cellule, en exacerbant la réactivité du fer, afin d’initier la propagation de l’altération des lipides. »
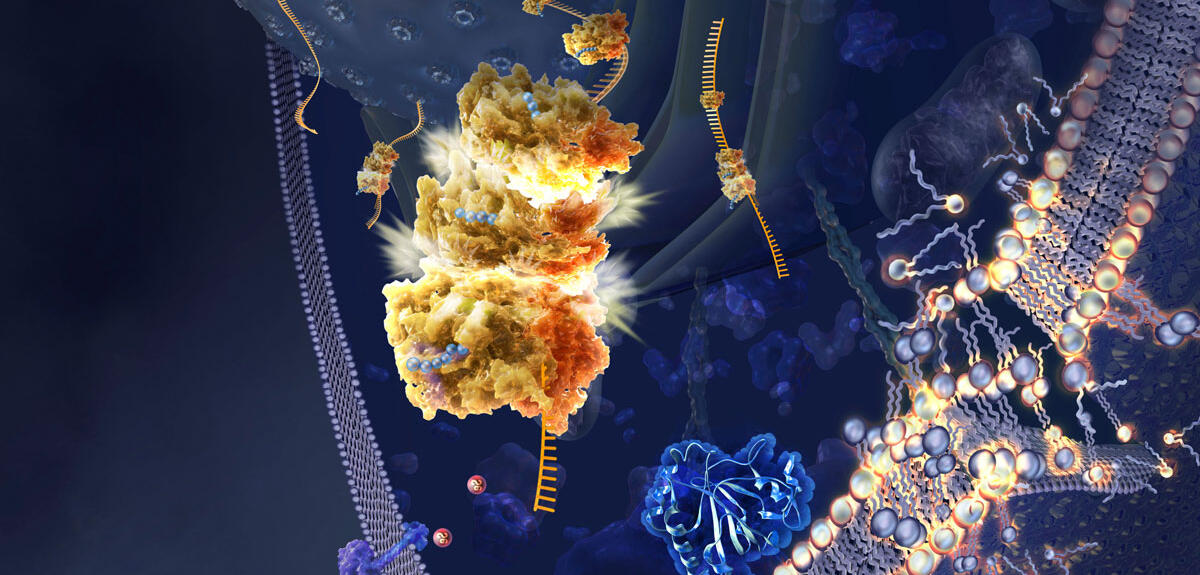
Fort de leurs découvertes antérieures sur l’implication du fer dans la ferroptose, ainsi que de l’identification du compartiment cellulaire au sein duquel le fer intracellulaire se retrouve, les chercheurs ont développé une molécule bifonctionnelle appelée fentomycine-1 (ou Fento-1), « inspirée des dégradeurs de protéines comme le protéasome3 ».
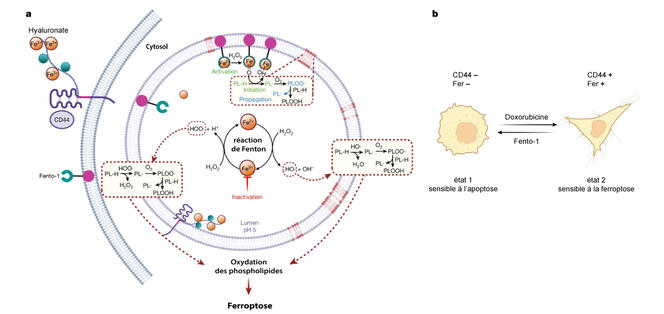

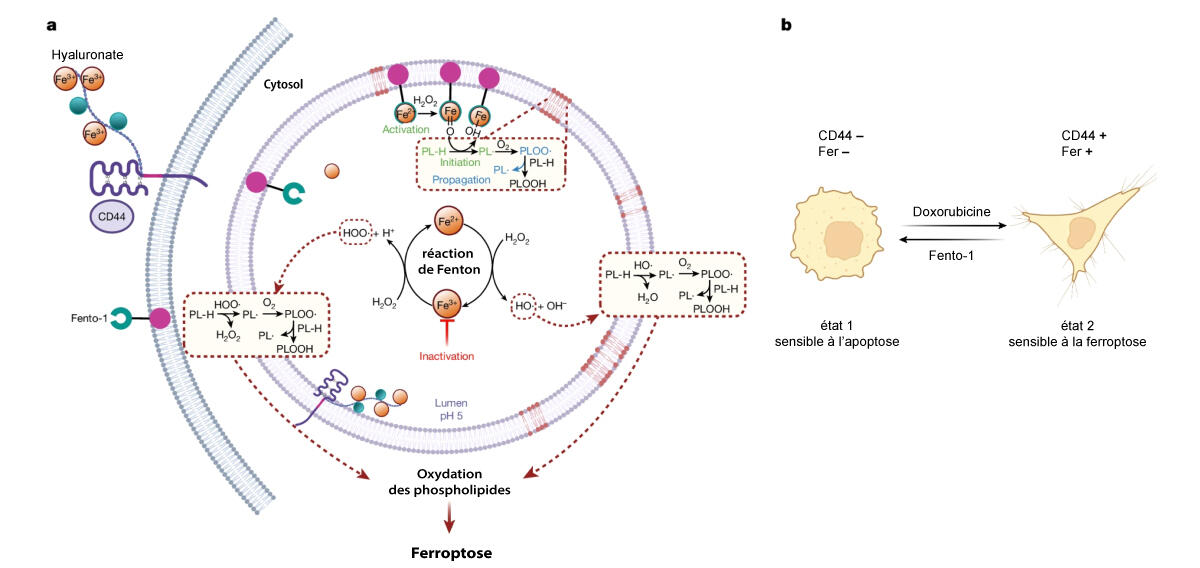
Cette molécule a une particularité : elle possède deux substrats différents. « Une partie de la Fento-1 a une forte affinité pour les membranes lipidiques, notamment la plus importante, celle qui constitue l’enveloppe externe de toutes les cellules animales. Membrane dont on sait qu’elle sera internalisée tôt ou tard, puisque son turnover est de l’ordre de deux heures – c’est-à-dire qu’environ toutes les deux heures, l’intégralité de la membrane est entièrement renouvelée, révèle Raphaël Rodriguez. La seconde partie de la molécule est un ligand4 ayant une forte affinité pour le fer, avec une géométrie et une densité électronique telle qu’elle favorise la chimie du fer. Le tout nous donne une molécule capable d’induire la dégradation des lipides membranaires via la production de radicaux libres de l’oxygène et, à terme, de déclencher la ferroptose. »
Prometteur contre les sarcomes et les cancers du pancréas
Aussi efficace sur des modèles murins de cancer métastatique que sur des cellules primaires de patients, des organoïdes ou encore des biopsies de tumeurs humaines obtenues juste après chirurgie, la Fento-1 semble très prometteuse dans le traitement des sarcomes et des cancers du pancréas. Plus encore, selon Raphaël Rodriguez, ces résultats sont le fruit d’un changement de paradigme.
« Ce changement, souligne-t-il, ne s’appuie pas sur l’utilisation d’une molécule anticancéreuse ou d’une molécule ayant un mécanisme particulier, mais plutôt sur le fait d’avoir compris que c’est l’état d’une cellule qui lui confère une vulnérabilité particulière et, par conséquent, définit le type de molécules à utiliser pour la combattre. »
Ainsi, à terme, la stratégie serait d’utiliser une combinaison de molécules antimétastatiques et antiprolifératives pour obtenir de meilleures réponses thérapeutiques. « On appuie clairement sur de nouvelles vulnérabilités des cellules cancéreuses, conclut Raphaël Rodriguez. Ce qui nous permet de comprendre d’autant mieux la biologie des cancers, qui mérite évidemment d’être davantage approfondit, avant de possibles applications cliniques. » ♦
Consultez aussi
Un nouvel anticorps dédié à la lutte contre le cancer
Vers un traitement des cancers à base de nanoparticules d’or
Contre le cancer, des traitements ciblés en ligne de mire
Les cancers transmissibles, une curiosité biologique
Des nanoparticules pour soigner les cancers ?
- 1. Directeur de recherche CNRS au laboratoire Chimie et biologie du cancer (CBC, unité CNRS/Inserm/Institut Curie).
- 2. nature.com/articles/s41586-025-08974-4
- 3. Complexe enzymatique multiprotéique présent dans le cytoplasme et impliqué dans la dégradation spécifique des protéines mal repliées, dénaturées ou obsolètes.
- 4. Molécule pouvant se lier de façon réversible à une cible (protéine, acide aminé…).