Vous êtes ici
Pourquoi les humeurs jouent sur notre santé
Une fois par mois, retrouvez sur notre site les Inédits du CNRS, des analyses scientifiques originales publiées en partenariat avec Libération.
Nous savons depuis peu que les neurones ne sont pas restreints au cerveau, mais sont également présents en très grand nombre (plus de 200 millions) dans l’intestin. Or celui-ci se trouve être également notre réservoir de cellules immunitaires. Ces deux familles de cellules communiquent-elles entre elles ? Instinctivement, nous serions tentés de répondre par l’affirmative… Car nous l’observons tous de manière empirique au quotidien : nos humeurs et notre stress affectent nos défenses immunitaires et nous tombons plus facilement malade lors de périodes de stress intense. Or, des découvertes récentes sont venues confirmer ce lien étroit entre système nerveux et système immunitaire. Mais pour bien comprendre ce qui se joue ici, penchons-nous tout d’abord sur leur mode de communication respectif.



Les neurones communiquent entre eux grâce à des molécules appelées neurotransmetteurs, dont l’une des plus connues est la sérotonine. La sérotonine est impliquée dans la régulation de fonctions telles que le cycle du sommeil, la douleur, l'anxiété, les comportements alimentaires et sexuels, ainsi que l’inflammation. Elle est sécrétée par les neurones mais également par les cellules du système immunitaire : plus de 95 % de la sérotonine n’est d’ailleurs pas produite par le cerveau mais par… l’intestin. D’autres neurotransmetteurs comme l’histamine, impliquée par ailleurs dans les allergies, est aussi connue pour avoir des effets sur notre système immunitaire, notamment en modulant la réponse inflammatoire.
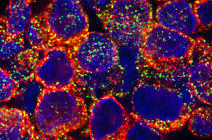
De leur côté, les cellules immunitaires communiquent entre elles en sécrétant des molécules appelées cytokines. Parmi ces cytokines, un sous-groupe est en avant-garde dans la réponse contre les infections : les interférons. Ces interférons sont des protéines antivirales découvertes il y a plus de soixante ans. Ce sont des agents extrêmement puissants, capables, lorsqu’ils sont produits en réponse à une infection virale ou bactérienne, d’induire l’activation de plus de 400 gènes ! Présents chez la plupart des vertébrés, les interférons sont les véritables gardiens de notre immunité. De nombreuses cellules infectées peuvent produire des interférons, mais toujours en faible dose, ce qui ne permet pas d’expliquer les quantités importantes détectées chez les patients infectés. Il y a tout juste vingt ans, la découverte des cellules « professionnelles » de la production d’interférons, les cellules dendritiques plasmacytoïdes (ou pDC), allait révolutionner notre compréhension de la réponse antivirale. Ces cellules pDC sont de véritables sentinelles, patrouillant dans le corps à la recherche de pathogènes à éliminer. Lorsqu’elles en détectent un, elles le détruisent et produisent de grandes quantités d’interférons, jusqu’à mille fois plus que n’importe quel autre type cellulaire. Cette capacité à produire massivement des interférons est un mécanisme a priori protecteur, mais qui peut devenir destructeur lorsque l’activation des cellules pDC persiste dans le temps, notamment dans le cas des maladies chroniques et auto-immunes.
Les neurotransmetteurs diminuent nos défenses anti-infectieuses
Alors, existe-t-il un lien entre les neurotransmetteurs de notre système nerveux et les interférons du système immunitaire ? Pour le savoir, nous étudions au laboratoire LCBPT1 la production des interférons par les cellules pDC. Plus particulièrement, nous nous sommes intéressés à l’effet des neurotransmetteurs lors de la réponse antivirale. Or, nous avons découvert que la sérotonine et l’histamine sont de puissants inhibiteurs de la production d’interférons par les pDC humaines cultivées en laboratoire, mais également in vivo chez des souris infectées par le virus de la grippe.
Nous avons voulu mieux comprendre cette action de la sérotonine et de l’histamine sur les pDC, et ce au niveau moléculaire. Ainsi, nous avons découvert que ces neurotransmetteurs se fixaient à une protéine présente à la membrane des pDC : le récepteur de chimiokines CXCR4. Ce récepteur, exprimé par de très nombreuses cellules du corps, est connu pour avoir diverses fonctions, notamment dans la migration des cellules immunitaires et cancéreuses, dans la croissance des neurones, et il est également utilisé par le VIH pour infecter les cellules. Nous avons alors démontré2 que l’histamine et la sérotonine se fixent sur les protéines CXCR4 présentes à la surface des pDC, ce qui a pour conséquence l’arrêt de la production des interférons. Nous avions en quelque sorte découvert le bouton « on/off » de la production d’interférons : le récepteur CXCR4.
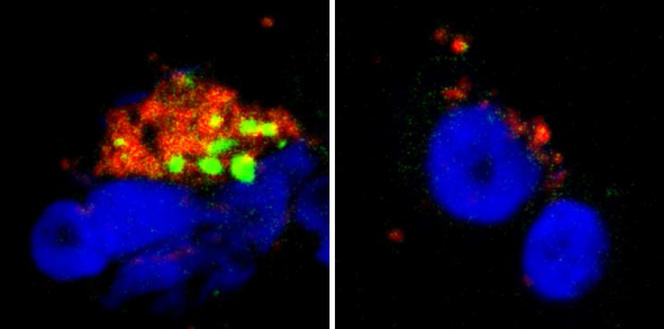

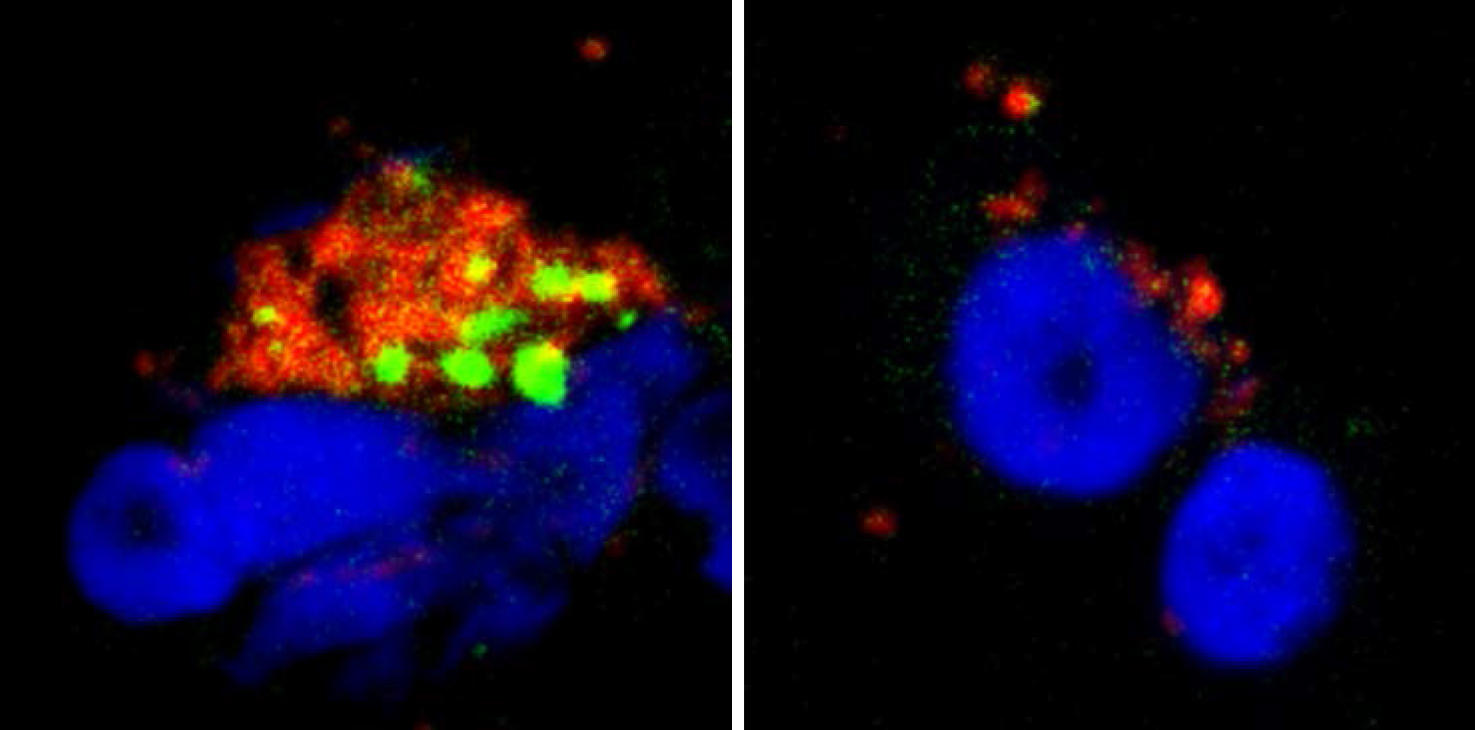
Cette découverte ouvre d’importantes perspectives thérapeutiques. En ciblant CXCR4, nous pourrions réduire la production d’interférons dans les maladies chroniques et auto-immunes, dans lesquelles la sécrétion constante d’interférons est responsable de la plupart des symptômes chez les patients. D’autre part, le fait que l’histamine inhibe la réponse interféron des pDC permet de donner une explication cellulaire et moléculaire à la sensibilité accrue des patients allergiques aux infections virales respiratoires. En effet, lors d’un épisode allergique, les mastocytes (qui font partie de la famille des cellules immunitaires) déchargent localement de grandes quantités d’histamine qui vont alors empêcher la sécrétion des interférons, laissant notre corps sans défense vis-à-vis des virus. Nos résultats concernant l’effet inhibiteur de la sérotonine sur les interférons ouvrent des perspectives encore plus excitantes.
En prouvant que les neurotransmetteurs sont capables de bloquer la production de molécules antivirales, ces résultats constituent une nouvelle étape dans la compréhension du dialogue entre système nerveux et système immunitaire. Cependant de nombreuses questions restent à élucider : pourquoi le corps a-t-il prévu que des neurotransmetteurs puissent contrôler notre immunité antivirale ? La sécrétion de sérotonine en vue de bloquer les pDC a-t-elle des conséquences sur notre humeur, notre état de stress ? Le système immunitaire influence-t-il notre état psychique en faisant sécréter des neurotransmetteurs ? Toutes ces questions passionnantes constitueront un enjeu majeur de recherche du XXIe siècle.
Les points de vue, les opinions et les analyses publiés dans cette rubrique n’engagent que leur auteur. Ils ne sauraient constituer une quelconque position du CNRS.
- 1. Laboratoire de chimie et biochimie pharmacologiques et toxicologiques (CNRS/Université Paris-Descartes), Équipe « Chimie et biologie, modélisation et immunologie pour la thérapie » (CBMIT).
- 2. Cette étude, parue dans Nature Communications en février 2017, a été financée par l’Agence nationale de la recherche sur le sida et les hépatites (ANRS), le Sidaction et la Fondation Paris-Descartes via le projet Santimmune.