A la une

Cet article est issu de la revue Dialogues économiques éditée par AMSE.
Quel sera le visage de la médecine de demain ? Un chemin particulièrement exploré est celui de la médecine personnalisée, aussi connue sous le nom de médecine de précision. Celle-ci vise en effet à améliorer la prévention, les diagnostics et les traitements en exploitant le bagage biologique du patient, en particulier ses informations génétiques. L’intelligence artificielle est largement mise à contribution pour exploiter les « données massives » des patients et faciliter ainsi la prise de décision médicale. Plusieurs pays investissent dans cette voie avec des partenariats et des plans nationaux ambitieux comme le projet 100 000 génomes du Royaume-Uni.
La France participe aussi à cette course avec notamment le plan « Médecine France 2025 »1. Parmi les retombées attendues se trouve l’amélioration de la prise en charge et du suivi des patients au meilleur coût pour la société sans renoncer à l’un des principes fondateurs du système de santé français, l’égalité devant la maladie. Pourtant les économistes Samuel Kembou et Bruno Ventelou révèlent que des disparités existent déjà au sein de son territoire dans l’accès à la médecine personnalisée.
Une médecine sur mesure ?
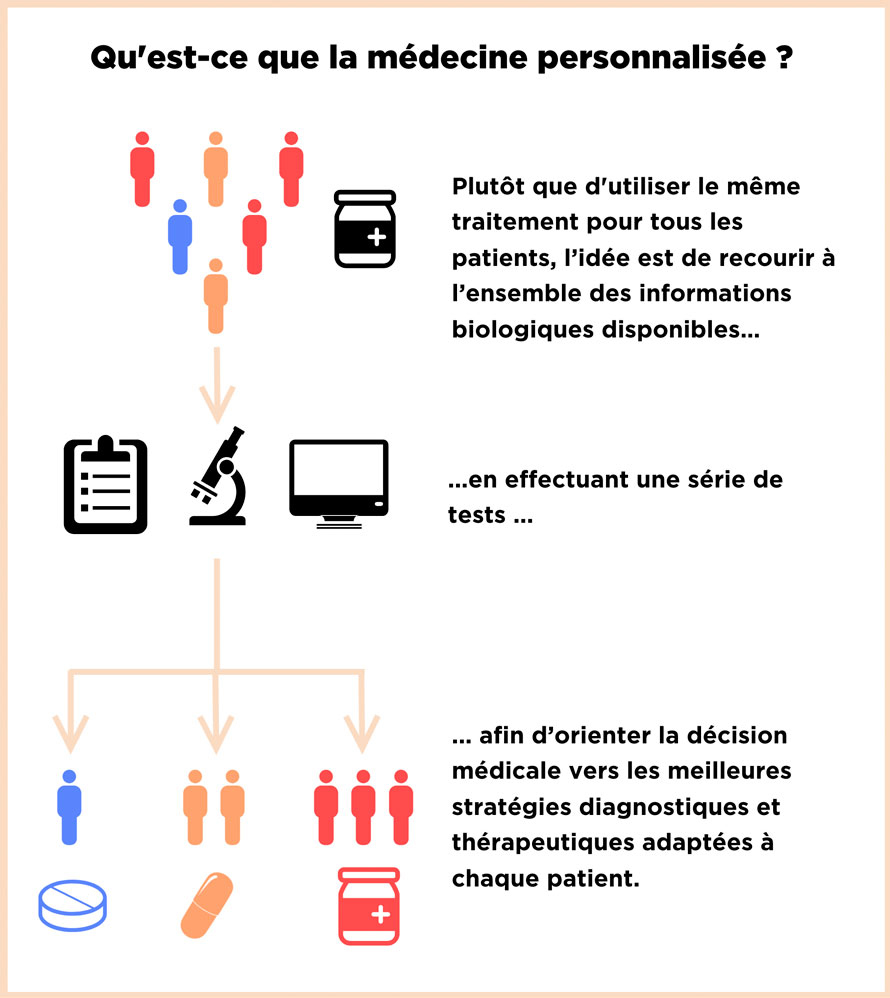
Capable d’être préventive, prédictive et même participative, la médecine personnalisée permet d’identifier le traitement le plus adapté à chaque patient. En évitant les soins inutiles et en améliorant la prise en charge, elle présente des avantages médicaux et économiques.
Une prise en charge sous le sceau de la médecine personnalisée commence en général par des analyses génétiques et moléculaires pour déterminer les singularités de chaque patient. À partir des informations obtenues, le profil de chaque individu va être comparé à d’autres patients afin d’identifier à quelle sous-population il appartient, permettant ainsi de l’orienter vers les soins adaptés à sa situation personnelle. En d’autres termes, la médecine personnalisée s’occupe de collecter et d’analyser des données dans le but de stratifier les patients pour proposer le bon traitement (ou affiner le diagnostic) au bon moment.
De la santé à l’économie
Le cancer du poumon est le plus mortel au monde avec 1 796 144 décès en 20202 . Cette triste performance s’explique par une incidence forte (plus de 2 millions de nouveaux cas par an), et une mortalité relative plus importante que les autres cancers. En France, l’identification génomique de certaines mutations associées fait aujourd’hui partie de la procédure standard en cas de diagnostic.
Pour mieux comprendre la relation entre l’incidence, les conséquences des mutations et les traitements, l’Institut National du Cancer a soutenu un ambitieux programme de recherche biomédicale : l’étude Biomarqueurs France. Son ambition était de séquencer l’ensemble des mutations de six gènes présents chez les cas diagnostiqués avec la forme la plus courante du cancer du poumon, le cancer bronchique non à petites cellules, CBNPC, et référés vers l’une des 28 plateformes hospitalières de génétique moléculaire réparties sur l’ensemble du territoire français. D’avril 2012 à 2013, les données de plus de 17 500 individus ont été collectées afin d’étudier les principales mutations.
Samuel Kembou et Bruno Ventelou ont exploité ces mêmes données afin d’étudier l’uniformité d’accès sur le territoire à la médecine personnalisée. Tout d'abord, ils ont déterminé les taux d’accès par département puis ils ont mobilisé des données socio-économiques, démographiques et administratives pour expliquer les différences observées dans l’accès à la médecine personnalisée.
Une inégalité territoriale
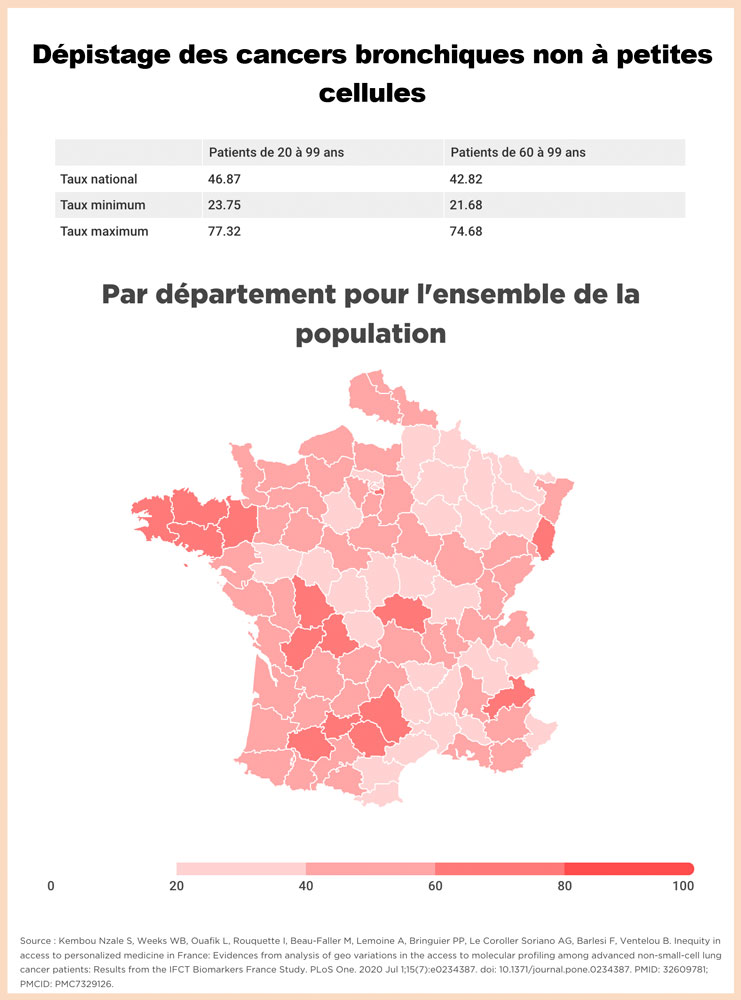
Sur l’ensemble du territoire, leurs analyses révèlent un taux moyen de test de 46,87 % chez les patients tous âges confondus (20-99 ans) et de 42,82 % pour les plus vieux (>60 ans) Néanmoins, ces moyennes cachent d’importantes disparités entre les départements comme le révèle la carte représentant les principaux taux d’accès. Le plus faible département « testeur » est la Nièvre qui en pratique trois fois moins que le plus important, les Côtes-d’Armor. Les données (carte interactive) couvrent uniquement la France métropolitaine, à l’exception de la Somme dont les données n’étaient pas disponibles.
Comment expliquer ces différences ? Pour répondre à ces questions, les auteurs de l’étude tentent d’identifier des paramètres corrélant ou non avec le taux de test.
Sans surprise, la présence de professionnels de santé influe sur le recours aux tests. Une forte proportion de généralistes et de radiothérapeutes conduit à plus de tests. L’effet est particulièrement marqué pour ces derniers dont la présence peut être un indicateur d’équipement de pointe. Cependant, plus il y a de chirurgiens, moins il y a de test. Une explication à cette observation serait que leur présence conduit à plus de traitement avec des interventions chirurgicales précoces, nécessitant moins d’informations moléculaires.
Richesse et santé
Un lien existe entre le statut social et la santé. Les études montrent que les individus les plus précaires présentent une espérance de vie plus faible associée à des risques plus élevés de maladie cardio-vasculaire et de cancer3. Cette situation peut s’expliquer par une exposition plus importante à des facteurs de risque comme la malnutrition ou encore le tabagisme. De plus, un faible statut socio-économique se trouve souvent lié à un accès réduit à des soins de qualité. Qu’en est-il pour les départements français et l’accès au test ?
Pour mesurer la défavorisation économique des départements, deux paramètres sont considérés : le taux de pauvreté et la proportion d’ayant droit à la couverture maladie universelle complémentaire, CMU-C4.
L’analyse révèle que les patients souffrant d’un CBNPC présentent moins de chance d’être orientés vers un test génétique lorsqu’ils vivent dans les départements les plus pauvres du territoire national. Cela est vrai pour des départements dispersés partout sur le territoire métropolitain, sans corrélation géographique particulière.
La défavorisation d’un département se trouve donc statistiquement reliée à un recours moindre au test génétique. Plusieurs explications sont possibles, notamment le manque de pertinence des trajectoires de soins, le manque d’équipement, ou encore de professionnels capables de prescrire et réaliser ces tests, relativement aux besoins du département.
_______________
Zoom sur les pratiques des médecins en matière de médecine personnalisée
En parallèle de cette étude, Samuel Kembou, Bruno Ventelou et David Bardey s’intéressèrent aussi aux facteurs pouvant inciter les praticiens à inclure la médecine personnalisée dans la stratégie de soins de leurs patients.
L’économie étant une science se pratiquant sans blouses blanches ni éprouvettes, quelle forme prend une expérience dans un laboratoire d’économie ? Principalement par un jeu avec des sujets volontaires dont les choix conduisent à des récompenses plus ou moins généreuses selon les performances des individus ; les données utilisées par les chercheurs étant le comportement des participants dans ces jeux.
Pour simuler l’interaction entre médecine et patients, ils ont demandé à des couples formés au hasard d’améliorer l’orthographe de morceaux de dictées. Le premier type de joueurs devait surligner les passages possiblement erronés (description des symptômes, par le patient), tandis que le second joueur devait corriger les fautes (le soin, effectué par le médecin). Le recours possible à la médecine personnalisée était, lui, simulé par la possibilité pour le second joueur d’avoir plus d’informations pour identifier les zones à corriger dans les dictées. Avec 48 rôles-patients et 95 rôles-médecins (ces derniers étant exclusivement « joués » par de futurs professionnels de santé recrutés en faculté de médecine), les chercheurs disposent de données sur plus de 4 500 pseudo-interactions médecins-patients. Leur conclusion est que l’adoption de la médecine personnalisée dépend à la fois des coûts que doivent supporter les médecins (administratif, financier, logistique ou même cognitif) et de leur mode de rémunération . Des pistes de réflexion sont avancées pour des dispositifs économiques (schémas de rémunération notamment) destinés à faciliter l’adoption des techniques de médecine personnalisée par les soignants.
Source : Bardey D., Kembou S., Ventelou B., 2021., “Physicians’ Incentives to Adopt Personalised Medicine: Experimental Evidence.” Journal of Economic Behavior & Organization ,191, 686–713
___________________________________________________________________________
Une promesse rompue
Par sa constitution, la Nation française « garantit à tous (…) la protection de la santé »5. En conséquence, elle se doit d’assurer à tous un accès à des soins médicaux de qualité et à des services de prévention, sans distinction ni restriction.
Bien que le droit à la protection de la santé pour tous soit inscrit dans la Constitution française, les travaux menés par les chercheurs démontrent l’existence d’inégalités dans l’accès à la médecine personnalisée du cancer et renforcent le constat que l’accès à la santé et aux soins pour tous est un défi prioritaire pour la médecine de demain. Néanmoins, en révélant ces angles morts, ils ouvrent la voie à des réponses par les autorités publiques à travers de nouvelles lois et des investissements dans le système de soins.
Notes
1. Plan Médecine France génomique 2025.
2. Cancer today http://gco.iarc.fr/today/home
3. Stringhini, S. et al. Socioeconomic status and the 25 × 25 risk factors as determinants of premature mortality: a multicohort study and meta-analysis of 1·7 million men and women. Lancet 389, 1229–1237 (2017).
4. Connue aujourd’hui sous le nom de Protection universelle maladie, elle permet gratuitement l’accès au remboursement des soins aux résidants français non couverts par l’Assurance maladie.
5. Préambule de la Constitution du 27 octobre 1946 | Conseil constitutionnel.
Référence
Kembou Nzale S., Weeks WB., Ouafik L., Rouquette I., Beau-Faller M., Lemoine A., et al., 2020, "Inequity in access to personalized medicine in France: Evidences from analysis of geo variations in the access to molecular profiling among advanced non-small-cell lung cancer patients: Results from the IFCT Biomarkers France Study" PLoS ONE 15(7).



