Vous êtes ici
« La question de l'origine du SARS-CoV-2 se pose sérieusement »
Temps de lecture : 19 minutes
Tandis qu’on assiste à une course de vitesse pour la mise au point de vaccins ou de traitements, pourquoi est-il si important de connaître la généalogie du virus qui provoque la pandémie de Covid-19 ?
Étienne Decroly1 : SARS-CoV-2, qui a rapidement été identifié comme le virus à l’origine de la Covid-19 est, après le SARS-CoV en 2002 et le MERS-CoV en 2012, le troisième coronavirus humain responsable d’un syndrome respiratoire sévère à avoir émergé au cours des vingt dernières années. On connaît désormais bien cette famille de virus qui circulent principalement chez les chauves-souris, et dont le transfert zoonotiqueFermerUne zoonose est une maladie infectieuse qui est passée de l'animal à l'homme provoque épisodiquement des épidémies chez l’humain. Il est donc crucial de comprendre comment ce virus a passé la barrière d'espèce et est devenu hautement transmissible d’homme à homme. L’étude des mécanismes d’évolution et des processus moléculaires impliqués dans l’émergence de ce virus pandémique est essentielle afin de mieux nous prémunir des émergences potentielles de ces virus, et pour élaborer des stratégies thérapeutiques et vaccinales.
Dès les premières semaines de la pandémie, alors qu’on ne savait encore pas grand-chose du virus, sa probable origine animale a très vite été pointée. Pourquoi a-t-on d’emblée privilégié cette piste, et a-t-elle été confirmée depuis ?
É. D. L’origine zoonotique des coronavirus, qui infectent près de 500 espèces de chauves-souris, était déjà bien documentée à partir des émergences précédentes. Dans la nature, des populations de chauves-souris partagent les mêmes grottes, et différentes souches virales peuvent alors infecter simultanément le même animal, ce qui favorise les recombinaisons génétiques entre virus et leur évolution. Certaines souches sont parfois aptes à franchir la barrière d’espèce.
En comparant les séquences génomiques d’échantillons viraux de différents malades infectés par SARS-CoV-2, on a observé un taux d’identité de 99,98 %, ce qui montrait que cette souche virale avait émergé très récemment chez l’humain. On a par ailleurs rapidement découvert que ce génome était à 96 % identique à celui d’un virus de chauve-souris (RaTG13) collecté en 2013 à partir de fèces de l’animal et dont les séquences ne sont connues que depuis le mois de mars 2020. Nous avons par ailleurs remarqué qu’une séquence de ce génome était totalement identique à un fragment de 370 nucléotides séquencé dès 2016 à partir d’échantillons collectés en 2013 dans une mine de la province du Yunnan, où trois mineurs avaient succombé à une pneumonie sévère.
En outre, en analysant les séquences des autres coronavirus humains connus, on ne relève que 79 % d’identité génétique entre SARS-CoV-1 et SARS-CoV-2, et seulement 50 % en ce qui concerne MERS-CoV. Pour faire bref, le SARS-CoV-2 est génétiquement plus proche de souches virales qui ne se transmettaient jusqu’alors qu’entre chauves-souris. Il ne descend pas de souches humaines connues et n’a acquis que récemment la capacité de sortir de son réservoir animal naturel qui est probablement la chauve-souris.
S’il est établi que la Covid-19 nous vient de la chauve-souris, pourquoi son origine reste-elle l’objet de controverses ?
É. D. Aucune épidémie liée à la transmission directe de la chauve-souris à l’homme n’ayant été démontrée à ce jour, on pense que la transmission à l’humain doit plutôt s’effectuer via une espèce hôte intermédiaire dans laquelle les virus peuvent évoluer puis être sélectionnés vers des formes susceptibles d’infecter des cellules humaines. Afin d’identifier cette espèce intermédiaire, on examine habituellement les relations phylogénétiques entre le nouveau virus et ceux provenant d’espèces animales vivant près de la région d'émergence ; c’est cette méthode qui a permis d’établir que la civette a été probablement l’hôte intermédiaire du SARS-CoV au début des années 2000, et le dromadaire celui du MERS-CoV dix ans plus tard. La découverte dans le génome de coronavirus infectant des pangolins d’une courte séquence génétique codant pour le domaine de reconnaissance du récepteur ACE-2, apparenté à celle qui permet à SARS-CoV-2 de pénétrer les cellules humaines, a un temps fait penser qu’on tenait un possible hôte intermédiaire, mais le restant de son génome est trop distant du SARS-CoV-2 pour être un ancêtre direct.

SARS-CoV-2 aurait ainsi pu résulter de recombinaisons multiples entre différents CoV circulant chez le pangolin et la chauve-souris, ce qui aurait conduit à une adaptation ayant rendu possible la transmission du virus à l’humain. La pandémie de Covid-19 proviendrait secondairement du contact avec l'hôte intermédiaire, éventuellement vendu sur le marché de Wuhan. Cette hypothèse pose cependant de nombreux problèmes. Tout d’abord à cause de la géographie : les échantillons viraux de chauves-souris ont été recueillis dans le Yunnan, à près de 1 500 km du Wuhan où a éclaté la pandémie. Ensuite pour une raison écologique : chauves-souris et pangolins évoluent dans des écosystèmes différents et on se demande à quelle occasion leurs virus auraient pu se recombiner. Et surtout, on note que le taux d’identité entre les séquences de SARS-CoV-2 et celles issues du pangolin n’atteint que 90,3 %, ce qui est bien inférieur aux taux habituellement observés entre les souches infectant l’humain et celles infectant l’hôte intermédiaire. Par exemple, le génome du SARS-CoV et celui de la souche de civette dont il descendait partagent 99 % d’identité.
Pouvez-vous nous en dire plus sur cette séquence de reconnaissance du récepteur cellulaire et le mécanisme d’entrée du virus dans les cellules ?
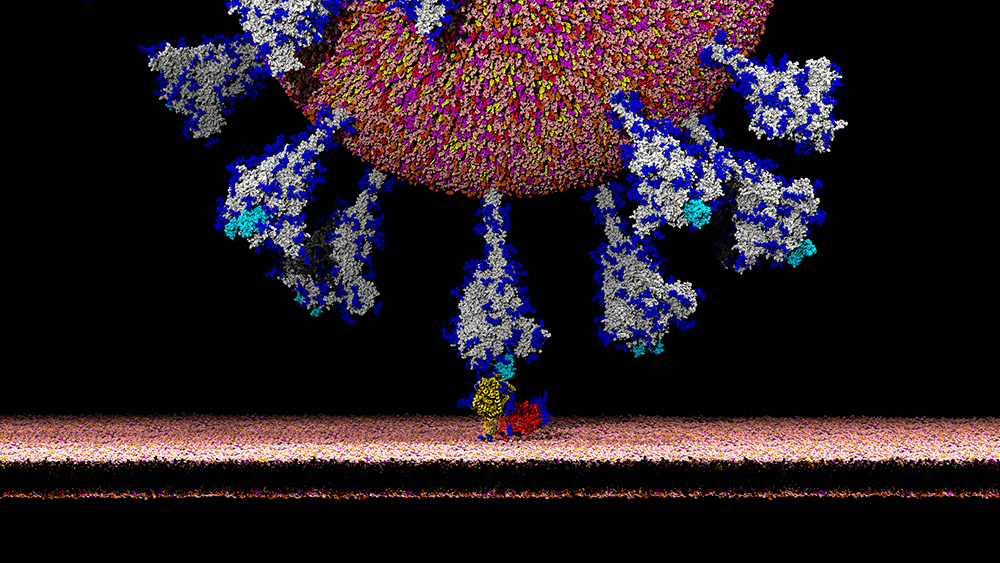
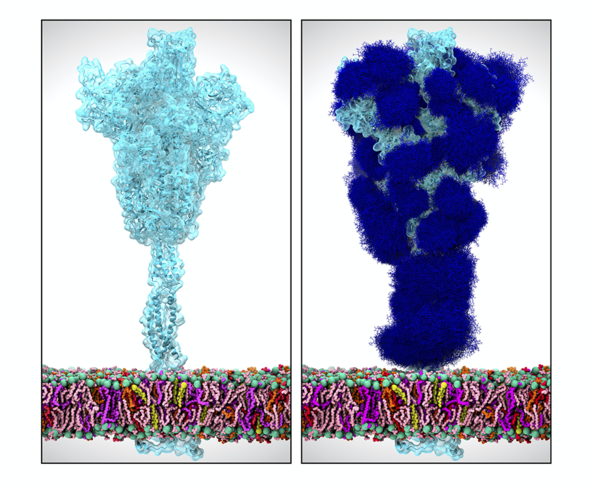
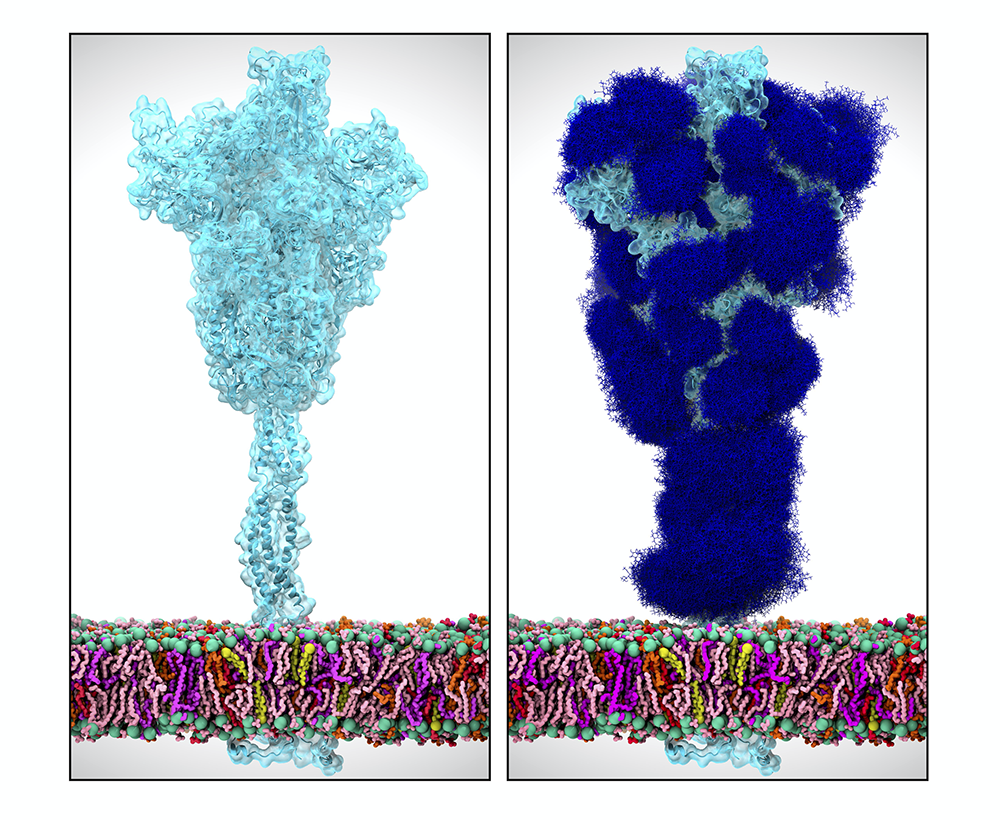
É. D. Il faut pour cela revenir aux caractéristiques biologiques des coronavirus. Leur génome contient un gène S codant pour la protéine Spike, qui entre dans la composition de l’enveloppe du virus et donne aux coronavirus leur forme typique de couronne. La protéine Spike joue un rôle fondamental dans la capacité d’infection du virus car elle contient un domaine, appelé RBD, qui a pour caractéristique de se lier spécifiquement à certains récepteurs (ACE2) situés à la surface des cellules infectables : c’est l’établissement de cette liaison qui favorise ensuite la pénétration du virus dans la cellule. L’affinité du domaine RBD pour les récepteurs ACE2 d’une espèce donnée est un facteur déterminant de la capacité d’infection du virus de cette espèce. Chez l’humain, ce récepteur est largement exprimé et on le retrouve par exemple à la surface des cellules pulmonaires ou intestinales.
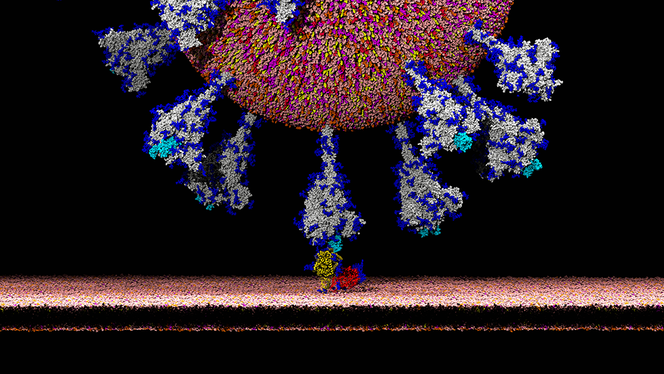
C’est en analysant les bases de données de coronavirus qu’il a été possible d’identifier que la séquence génétique codant pour le domaine RBD du SARS-CoV-2 était très proche de celle du coronavirus infectant le pangolin. Cette observation suggère que la protéine Spike du CoV infectant le pangolin a une bonne affinité pour le récepteur ACE2 humain, ce qui aurait pu permettre au virus de pangolin d’infecter plus efficacement les cellules humaines que le virus de chauves-souris. Toutefois, pour les raisons déjà évoquées, une majorité de chercheurs estiment désormais que le pangolin n’a probablement pas joué de rôle dans l’émergence de SARS-CoV2. L’hypothèse actuellement privilégiée est qu’il s’agit plutôt d’une évolution convergente et indépendante du domaine RBD dans les deux lignées virales.
Y a-t-il des indices pointant vers d’autres candidats au rôle d’hôte intermédiaire ?
É. D. Dans les zoonoses, les hôtes intermédiaires se retrouvent généralement parmi les animaux d’élevage ou sauvages en contact avec les populations. Or, en dépit des recherches de virus dans les espèces animales vendues sur le marché de Wuhan, aucun virus intermédiaire entre RaTG13 et le SARS-CoV-2 n’a pu être identifié à ce jour. Tant que ce virus intermédiaire n’aura pas été identifié et son génome séquencé, la question de l’origine de SARS-CoV-2 restera non résolue. Car en l’absence d'éléments probants concernant le dernier intermédiaire animal avant la contamination humaine, certains auteurs suggèrent que ce virus pourrait avoir franchi la barrière d’espèce à la suite d'un accident de laboratoire ou être d’origine synthétique.
Vous pensez que le SARS-CoV-2 est sorti d’un laboratoire ?
É. D. On ne peut éliminer cette hypothèse, dans la mesure où le SARS-CoV qui a émergé en 2003 est sorti au moins quatre fois de laboratoires lors d’expérimentations. Par ailleurs, il faut savoir que les coronavirus étaient largement étudiés dans les laboratoires proches de la zone d’émergence du SARS-CoV-2 qui désiraient entre autres comprendre les mécanismes de franchissement de la barrière d’espèce. Toutefois, pour l’instant, les analyses fondées sur la phylogénie des génomes complets de virus ne permettent pas de conclure définitivement quant à l’origine évolutive du SARS-CoV-2.
On dispose de trois grands types de scénarii pour expliquer comment SARS-CoV-2 a acquis son potentiel épidémique. Premièrement, il s'agit d'une zoonose. La Covid-19 est due au franchissement récent de la barrière d’espèce par le coronavirus. Dans ce cas, on doit retrouver un virus plus proche que RaTG13 dans une espèce domestique ou d’élevage. Pour rappel, ce n’est toujours pas le cas.
Deuxième scénario, il pourrait également s’agir d’un coronavirus différent de SARS-CoV ou de MERS-CoV, qui se serait adapté à l’humain il y a déjà plusieurs années, qui aurait circulé jusqu’ici à bas bruit, et qu’une mutation récente aurait rendu plus transmissible d’homme à homme. Pour étayer ce cas de figure, il faudrait pouvoir analyser les échantillons viraux de personnes décédées de pneumonies atypiques dans la zone d’émergence avant le début de la pandémie.
Enfin, il reste la possibilité que SARS-CoV-2 descende d’un virus de chauves-souris isolé par les scientifiques lors des collectes de virus et qui se serait adapté à d’autres espèces au cours d’études sur des modèles animaux en laboratoire ; laboratoire dont il se serait ensuite échappé accidentellement.
Cette dernière hypothèse ne risque-t-elle pas de conforter les discours complotistes sur la pandémie de Covid-19 ?
É. D. Étudier l’origine de SARS-CoV-2 est une démarche scientifique qui ne peut être assimilée à une thèse complotiste. De plus, j’insiste sur le fait que, tant qu’on n’aura pas trouvé l’hôte intermédiaire, cette hypothèse d’un échappement accidentel ne peut être écartée par la communauté scientifique.
À ce jour, les études scientifiques n’ont apporté aucun élément définitif qui démontrerait cette hypothèse ; il n’en demeure pas moins que des analyses plus approfondies sont nécessaires pour trancher. La question de l’origine naturelle ou synthétique du SARS-CoV-2 ne doit pas dépendre d’un agenda politique ou de logiques de communication. Elle mérite d’être examinée à la lumière des données scientifiques à notre disposition.
Nos hypothèses doivent également tenir compte de ce qu’il est actuellement possible de réaliser dans les laboratoires de virologie ; et du fait que dans certains laboratoires, la manipulation du génome de virus potentiellement pathogènes est une pratique courante, notamment pour étudier les mécanismes de franchissement de la barrière d’espèces.
Justement, de nombreux sites complotistes se réfèrent aux affirmations de Luc Montagnier qui explique que SARS-CoV-2 serait une chimère virale créée dans un laboratoire chinois entre un coronavirus et le virus de l’immunodéficience humaine (VIH). Cette théorie est-elle sérieuse ?
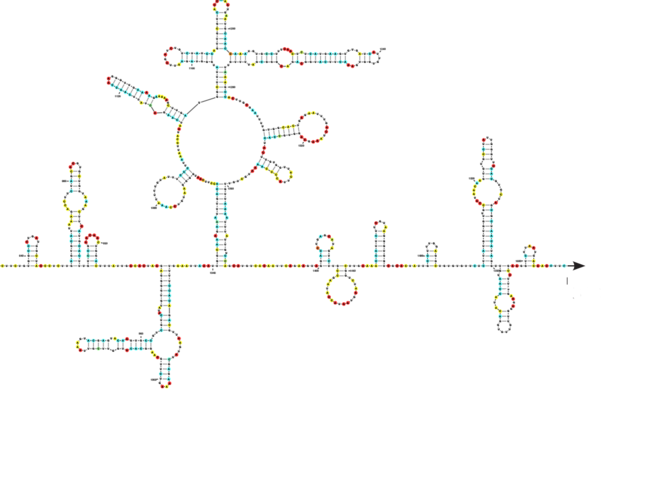
E. D. Elle n’est en tout cas plus considérée comme telle par les spécialistes, qui en ont réfuté les principales conclusions. Néanmoins, elle part d’une observation tout à fait sérieuse et importante pour la compréhension du mécanisme d’infection de SARS-CoV-2 : Il a été découvert que le gène codant la protéine Spike contient quatre insertions de courtes séquences que l’on ne retrouve pas chez les CoV humains les plus proches génétiquement. Ces insertions confèrent probablement des propriétés remarquables à la protéine Spike de SARS-CoV-2. Des études structurales indiquent que les trois premières insertions sont localisées sur des domaines exposés de la protéine S et jouent donc probablement un rôle dans l’échappement du virus au système immunitaire de l’hôte.
La quatrième insertion est plus récente et fait apparaître un site sensible aux furines, des enzymes protéases produites par les cellules de l’hôte. Il est aujourd’hui clairement démontré que le clivage de Spike par les furines induit un changement de conformation favorisant la reconnaissance du récepteur cellulaire ACE2. S’interrogeant sur l’origine de ces insertions, des chercheurs ont affirmé dans une prépublication qu’au niveau de ces séquences, la protéine Spike de SARS-CoV-2 présenterait des similarités troublantes avec des séquences de fragments du virus VIH-1. Très critiqué pour ses faiblesses méthodologiques et ses erreurs d’interprétation, l’article a été retiré du site bioRxiv.
Cette hypothèse serait donc restée anecdotique si, en avril 2020, Luc Montagnier, prix Nobel de médecine pour ses travaux sur le VIH, ne l’avait relancée en proclamant que ces insertions ne résulteraient pas d’une recombinaison naturelle ou d’un accident, mais d’un vrai travail de génétique, effectué intentionnellement, vraisemblablement dans le cadre de recherches visant à développer des vaccins contre le VIH. Ces affirmations ont une nouvelle fois été réfutées par des analyses biostatistiques qui ont montré que les séquences similaires entre VIH et SARS-CoV-2 étaient trop courtes (10 à 20 nucléotides sur un génome qui en compte 30 000) et que cette ressemblance était vraisemblablement fortuite.
Cependant, devant la difficulté à comprendre l’origine de ce virus, nous avons conduit des analyses phylogénétiques en collaboration avec des bio-informaticiens et des phylogénéticiens. Leurs résultats montrent que trois des quatre insertions que l’on observe chez le SARS-CoV-2 se retrouvent chacune dans des souches plus anciennes de coronavirus. Notre étude indique de façon certaine que ces séquences sont apparues indépendamment, à différents moments de l’histoire évolutive du virus. Ces données invalident l’hypothèse d’une insertion récente et intentionnelle de ces quatre séquences par un laboratoire.

Reste la 4e insertion qui fait apparaître un site de protéolyse furine chez le SARS-CoV-2 absente dans le reste de la famille des SARS-CoV. On ne peut donc pas exclure que cette insertion résulte d’expériences visant à permettre à un virus animal de passer la barrière d’espèce vers l’humain dans la mesure où il est bien connu que ce type d’insertion joue un rôle clé dans la propagation de nombreux virus dans l’espèce humaine.
Comment sortir de cette incertitude ?
É. D. Le génome de SARS-CoV-2 est un puzzle combinatoire et les mécanismes de recombinaison des virus animaux ayant permis une telle émergence demeurent énigmatiques. Pour comprendre sa genèse, il est donc nécessaire d’intensifier la collecte d’échantillons chez des espèces sauvages ou domestiques. L’éventuelle découverte de virus animaux présentant une très forte similarité avec SARS-CoV-2 fournirait un élément décisif pour valider son origine naturelle. Par ailleurs, des analyses bio-informatiques plus poussées pourraient permettre de révéler des traces éventuelles de manipulation génétique, ce qui plaiderait à l’inverse pour une origine expérimentale.
Quoi qu’il en soit, que ce virus soit ou non d’origine naturelle, le fait même que la question puisse désormais être sérieusement posée nous contraint à une réflexion critique sur les outils et les méthodes de reconstruction de virus actuellement à l’œuvre dans les laboratoires de recherche, et sur leur usage potentiel dans des expériences de « gain de fonction ».
Mais ces outils ne sont-ils pas justement les seuls capables de nous permettre de comprendre et combattre les virus et les épidémies qu’ils entraînent ?
É. D. Certes, mais il faut bien comprendre qu’en quelques années, les paradigmes de la recherche sur les virus ont radicalement changé. Aujourd’hui, obtenir ou faire synthétiser une séquence génétique est à la portée de n’importe quel laboratoire : on peut en moins d’un mois construire de toutes pièces un virus fonctionnel à partir des séquences disponibles dans les bases de données. De plus, des outils de manipulation du génome rapides, bon marché et faciles à utiliser ont été développés. Ces outils permettent de faire des avancées spectaculaires, mais ils démultiplient aussi les risques et la gravité potentielle d’un éventuel accident, notamment lors d’expériences de « gain de fonction » sur des virus à potentiel pandémique.
Même s’il s’avère que la pandémie de Covid-19 est finalement le résultat d’une zoonose « classique », plusieurs incidents ayant conduit à des sorties accidentelles de virus depuis des laboratoires ont été documentés ces dernières années. Un des cas les plus connus concerne le virus Marburg, issu d’une contamination par des singes sauvages. La pandémie grippale de 1977 en est un autre exemple. Des études génétiques récentes suggèrent qu’elle aurait résulté de la sortie de laboratoire d’une souche virale collectée dans les années 1950. Et plus récemment, plusieurs sorties accidentelles de SARS-CoV étudiés dans des laboratoires ont été rapportées dans la littérature, même si elles n’ont heureusement donné lieu à aucune épidémie importante.
Les normes internationales imposent que la recherche, l’isolement et la culture de virus à potentiel pandémique, incluant les virus respiratoires, soient réalisés dans des conditions expérimentales sécurisées, avec une traçabilité irréprochable pour éviter toute transmission zoonotique. Toutefois, des accidents peuvent toujours se produire et il est important de se questionner sur la dangerosité potentielle des expérimentations notamment quand elles visent un gain de fonction ou d’infectiosité.
Prônez-vous un moratoire ou une interdiction de ces recherches ?
É. D. Je ne prône pas une interdiction pure et simple ; il ne s’agit pas de stériliser la recherche, mais de questionner plus strictement le rapport bénéfice/risque. Une conférence devrait peut-être être organisée pour évaluer la nécessité d’un moratoire ou d’une réglementation internationale plus adapté ?
Au vu des risques infectieux que les techniques d’étude des virus nous font aujourd’hui courir, la société civile et la communauté scientifique doivent au plus vite s’interroger sur la pratique d’expériences de gain de fonction et d'adaptation artificielle de souches virales dans des hôtes animaux intermédiaires. En 2015, conscientes de ce problème, les agences fédérales américaines avaient gelé le financement de toute nouvelle étude impliquant ce type d’expériences. Ce moratoire a pris fin en 2017. Ces pratiques à haut risque devraient, à mon sens, être repensées et encadrées au niveau international par des comités d’éthiques.
Enfin, les chercheurs de ces domaines doivent également mieux prendre en compte leur propre responsabilité dès lors qu’ils ont conscience des dangers éventuels que peuvent générer leurs travaux. Des stratégies expérimentales alternatives existent souvent pour atteindre les objectifs tout en limitant fortement les risques expérimentaux.
N’est-ce pas déjà le cas ?
É. D. En théorie, oui. Dans la réalité, on est souvent loin du compte, notamment car nous, les scientifiques, sommes insuffisamment formés sur ces questions. Et parce que le climat de compétition qui baigne le monde de la recherche engendre de l’expérimentation rapide et tous azimuts, sans réflexion approfondie sur ces questions d’éthique ou la dangerosité potentielle de leurs travaux.
Dans mes cours consacrés à l’ingénierie virale, j’ai l’habitude de présenter à des étudiants de Master cet exercice théorique : je leur demande d’imaginer un procédé procurant au virus VIH la capacité d’infecter n’importe quelle cellule de l’organisme (pas seulement les lymphocytes). Ces étudiants sont brillants, et la plupart sont en mesure de me proposer des méthodes efficaces, conduisant à la construction de virus chimériques potentiellement dangereux. Je donne ce cours depuis une dizaine d’années et les étudiants s’attachent exclusivement à l’efficacité de la méthode sans s’interroger une seconde sur les conséquences potentielles de leurs mises en œuvre.
L’objectif pédagogique que je poursuis est de les sensibiliser à ces problématiques et de leur montrer qu’on peut dans bien des cas construire des systèmes expérimentaux tout aussi efficaces et permettant de mieux contrôler les risques biologiques. il faut intervenir dès la formation, en formant les futurs biologistes à toujours questionner le risque et la pertinence sociétale de leurs travaux, aussi novateurs soient-ils. ♦
Pour en savoir plus:
Retrouver les origines du SARS-COV-2 dans les phylogénies de coronavirus
E. Sallard, et al. Médecine/sciences, 36 (8-9), 783-796 (2020).
Conférence d'Etienne Decroly sur la pandémie Covid-19 pour l'Université Populaire de Marseille (video)
- 1. Directeur de recherche au CNRS au laboratoire Architecture et fonctions des macromolécules biologiques (CNRS/Aix-Marseille Université), membre de la Société française de virologie.