Vous êtes ici
Les cellules à mémoire, alliées des vaccins face aux variants du SARS-CoV-2
Le développement des vaccins et leur validation dans des essais cliniques ont constitué la première étape permettant d'envisager qu'une très large vaccination puisse permettre d'atteindre l'immunité de groupe, nécessaire pour freiner la circulation du virus. Des études menées sur des populations entières, dans le contexte des campagnes de vaccination s'effectuant alors qu'une large circulation virale était encore présente, ont depuis clairement confirmé la remarquable efficacité des vaccins à ARN messager, ainsi que du vaccin Astra Zeneca à vecteur viral. Cette efficacité est non seulement manifeste en termes de prévention de l'infection, mais aussi, dans les cas « d'échappement vaccinal » comme en attestent une moindre gravité de la maladie et une charge virale atténuée, notamment concernant la durée du portage. C'est le cas d'études faites en Israël ou au Royaume-Uni portant sur des centaines de milliers d'individus.
L'immunité de groupe face aux variants
Cependant, comme beaucoup de virus, le SARS-CoV-2 est sujet à des modifications des protéines qu'il exprime, notamment la protéine Spike qui lui permet de se fixer et d'infecter les cellules épithéliales pulmonaires. Des formes variantes, notamment des formes préoccupantes (variants of concern, ou VOC), sont en effet rapidement apparues. Cette variabilité accompagne sa multiplication, et l'on observe une évolution accélérée due à l'immense réservoir d'expansion mondiale et à la pression de la réponse immune que développent les gens infectés ou vaccinés. Deux propriétés permettent l'émergence de variants : soit celles qui permettent au virus de se répandre plus vite (plus infectieux, plus contagieux), soit celles qui lui permettent d'échapper au contrôle du système immunitaire. Malgré le développement des campagnes vaccinales dans de nombreux pays, la crainte se développe maintenant que l’apparition de ces variants repousse l’objectif d’une immunité de groupe, seule à même de prévenir une nouvelle vague infectieuse et de permettre un retour à la normale.
L'émergence de virus plus infectieux suggère en effet que le seuil auquel l'immunité de groupe sera atteinte sera plus élevé, mais les niveaux de la vaccination (ou de l'infection) qui seront nécessaires sont difficiles à estimer précisément. Le deuxième aspect de l'émergence des variants préoccupants est leur capacité à déjouer les défenses immunitaires développées contre le virus initialement rencontré, ou contre la protéine Spike présente dans les vaccins actuels. Mais qu'en est-il exactement de cet « échappement immunitaire » ?
Le tableau est en fait moins sombre qu'il n'y paraît, même si un certain nombre de publications ont souligné la baisse de la protection offerte par les anticorps présents dans la circulation sanguine après vaccination contre certains variants, comme le variant Delta dont l'émergence est très rapide1. À nouveau, les études de populations vaccinées dans le contexte de circulation d'un variant préoccupant sont très informatives : c'est le cas du Qatar, avec une forte présence du virus Beta (dit « sud-africain »), ou de l'Écosse, avec le variant Delta. Si la protection offerte par les vaccins à ARN messager est de 90 % contre le SARS-CoV-2 à l'origine de la première vague (70-80 % pour l'Astra Zeneca), elle diminue en effet face aux variants, mais dans des proportions somme toute modestes : 10 % de moins environ dans la protection offerte contre le variant Delta (15 % pour le variant Beta), mais avec toujours une forte réduction des formes graves2.
Le rempart des lymphocytes B à mémoire
Comment expliquer une telle efficacité, notamment contre les formes graves ? Pour cela, il faut d'abord décrire les deux piliers de la protection offerte par les cellules qui produisent les anticorps, les lymphocytes B. Lors de l'infection initiale ou de la vaccination, ces cellules vont s'activer et produire rapidement des anticorps de qualité variable, mais qui, dans la très grande majorité des cas, vont permettre, avec d'autres mécanismes de défense, de contenir l'infection en quelques jours : c'est la réponse sérologique, que l'on détecte par la présence d'anticorps anti-Spike dans le sang. Cependant, cette infection va aussi permettre que se développe sur quelques mois une meilleure réponse antivirale, par la production de cellules capables de sécréter des anticorps dits « neutralisants » (qui empêchent notamment le virus de se fixer à ses cellules cibles) et qui persistent dans le temps, avec pour l’instant un recul d’environ un an pour les dernières études en date : ce sont des plasmocytes à longue durée de vie, spécialisés dans la production continue d'anticorps, mais sans capacité d'adaptation à un nouveau virus.
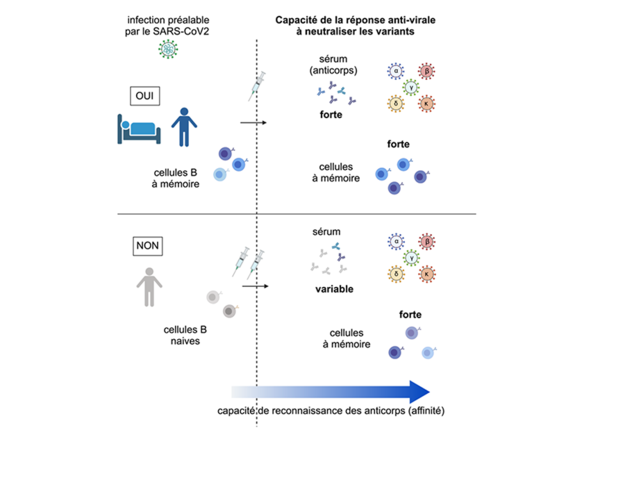
Une deuxième population est également formée, qu'on appelle lymphocytes B à mémoire, qui présentent des capacités de neutralisation du virus plus variées3. Tels des agents dormants, ces cellules peuvent rester au repos plusieurs années mais vont immédiatement s'activer, se multiplier et se changer en plasmocytes produisant rapidement de grandes quantités d'anticorps lors d'une nouvelle rencontre avec le virus (ou lors d'un rappel vaccinal). Le SARS-CoV-2 réside quelques jours dans l'organisme avant que les symptômes de la maladie n'apparaissent, ce qui permet à ces cellules à mémoire de s'amplifier, et tout particulièrement, celles qui présentent une bonne reconnaissance des variants : même si elles sont peu nombreuses au départ, elles vont pouvoir se multiplier rapidement et dominer la réponse. Si la multiplication des cellules est un peu tardive, on peut détecter la présence du virus lors des tests PCR ou antigéniques, mais l'infection a toute chance d'être modérée et largement contrôlée.
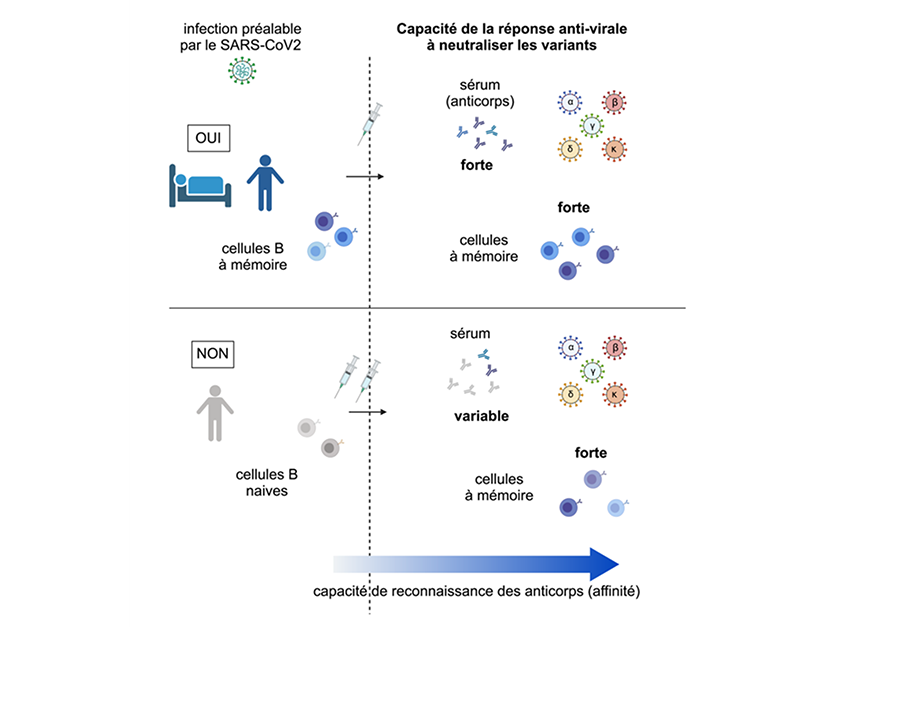
Plusieurs études récentes ont établi, en suivant la réponse à la vaccination de personnes ayant été préalablement infectées avec le SARS-CoV-2 ou de personnes « naïves » pour l'infection, la contribution des cellules à mémoire à la protection vaccinale. Elles montrent que la vaccination protège remarquablement avec une seule dose, y compris contre les variants, les personnes préalablement infectées par le SARS-CoV-2, en permettant la mobilisation des cellules à mémoire formées lors de l'infection et présentant les meilleures performances ; de plus, le niveau de protection acquis est d'autant plus fort que la maladie a été sérieuse (sans atteindre un stade critique), une compensation modeste mais bien réelle pour la gravité des symptômes rencontrés4.
L'intérêt d'une troisième dose de vaccin
Pour les individus « naïfs », la protection sérologique est rapidement induite par le vaccin, mais son efficacité contre les variants est plus faible et plus hétérogène entre les individus, et sa stabilité dans le temps n’est pas acquise. Cependant, des cellules à mémoire capables de neutraliser ces variants sont bien produites et pourront s'activer dans le cas d'une nouvelle infection. Si leur nombre apparaît au départ plus faible que chez les personnes infectées, il semble augmenter progressivement au cours des semaines et mois qui suivent la vaccination5. La conclusion de ces différentes études est qu'une troisième dose de vaccin sera à même d'apporter une protection optimale aux personnes qui n'ont pas été infectées par le SARS-CoV-2 en activant leurs cellules à mémoire et en augmentant la présence dans le sang d'anticorps capables de contrôler notamment le variant Delta. De façon intéressante, cette troisième dose peut être constituée de la protéine Spike présente dans l'essentiel des formules vaccinales disponibles actuellement ou qui le seront dans un futur proche, et non de vaccins spécifiques des formes variantes.
Une excellente nouvelle globalement, qui soutient l'intérêt de la campagne actuelle pour une troisième injection vaccinale, même si le fort potentiel contagieux du variant Delta nous impose d'arriver à une couverture vaccinale élevée et de maintenir les gestes barrières pour arrêter sa circulation. ♦
Les points de vue, les opinions et les analyses publiés dans cette rubrique n’engagent que leur(s) auteur(s). Ils ne sauraient constituer une quelconque position du CNRS.
Référence
"mRNA vaccination of naive and COVID-19-recovered individuals elicits potent memory B cells that recognize SARS-CoV-2 variants", Immunity, 20 septembre 2021. DOI:https://doi.org/10.1016/j.immuni.2021.09.011
A. Sokal, G. Barba-Spaeth, I. Fernández, M. Broketa, I.e Azzaoui, A. de La Selle, A. Vandenberghe, S. Fourati, A. Roeser, A. Meola, M. Bouvier-Alias, E. Crickx, L. Languille, M. Michel, B. Godeau, S. Gallien, G. Melica, Y. Nguyen, V. Zarrouk, F. Canoui-Poitrine, F. Noizat-Pirenne, J. Megret, J.-M. Pawlotsky, S. Fillatreau, P. Bruhns, F.A. Rey, J.-C. Weill, C.-A. Reynaud, P. Chappert, M. Mahévas.
À lire sur notre site
Covid-19 : ces variants qui ont changé la donne
Covid-19 : vacciné, peut-on s’infecter et transmettre le virus ?
- 1. Lucas et al., medRxiv, 2021.07.14.21260307
- 2. Abu-Raddad et al., NEJM, 385, 187 (2021) ; Lopez Bernal et al., NEJM, 385, 585 (2021).
- 3. Reynaud et al., Med Sci, 37, 722 (2021).
- 4. Sokal et al., Immunity, 20 sept. 2021 ; Wang et al., Nature, 595, 426 (2021) ; Goel et al., bioRxiv, 2021.08.23.457229
- 5. Sokal et al., Immunity , 20 sept. 2021 ; Goel et al., bioRxiv, 2021.08.23.457229 ; Cho et al., bioRxiv, 2021.07.29.454333