Vous êtes ici
Antifongiques, antibiotiques : des mécanismes de résistance identiques
Temps de lecture : 10 minutes
D’un côté, une hausse du nombre de patients infectés par Aspergillus fumigatus, un micro-champignon pathogène présent dans la terre. De l’autre, des centaines de bulbes de tulipes destinés à embellir les nouvelles terrasses de l’hôpital de Besançon. C’est parce qu’elle avait un pied dans la recherche, au laboratoire Chrono-environnement1, et l’autre dans la clinique, en tant que responsable du laboratoire de parasitologie-mycologie du CHU, que Laurence Millon, avec son équipe, a pu établir le lien entre les deux.
C’était en 2019, à l’hôpital de Besançon, alors que la résistance de certaines mycoses aux antifongiques n’était quasiment pas médiatisée. « On parle encore peu de ce sujet, car les infections par des champignons touchent moins de personnes que les infections par des virus ou des bactéries », commente Laurence Millon.
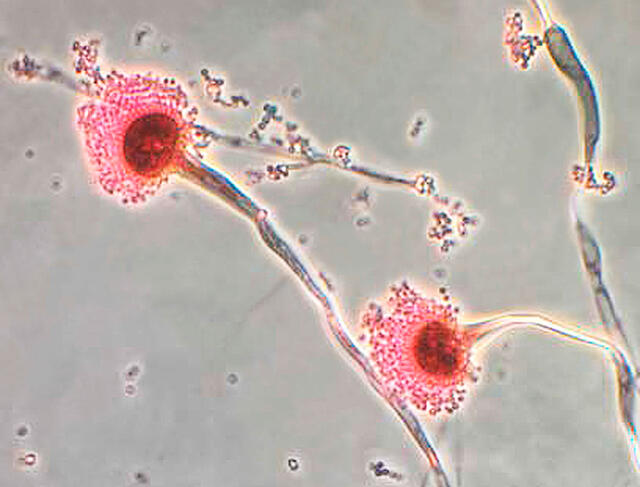
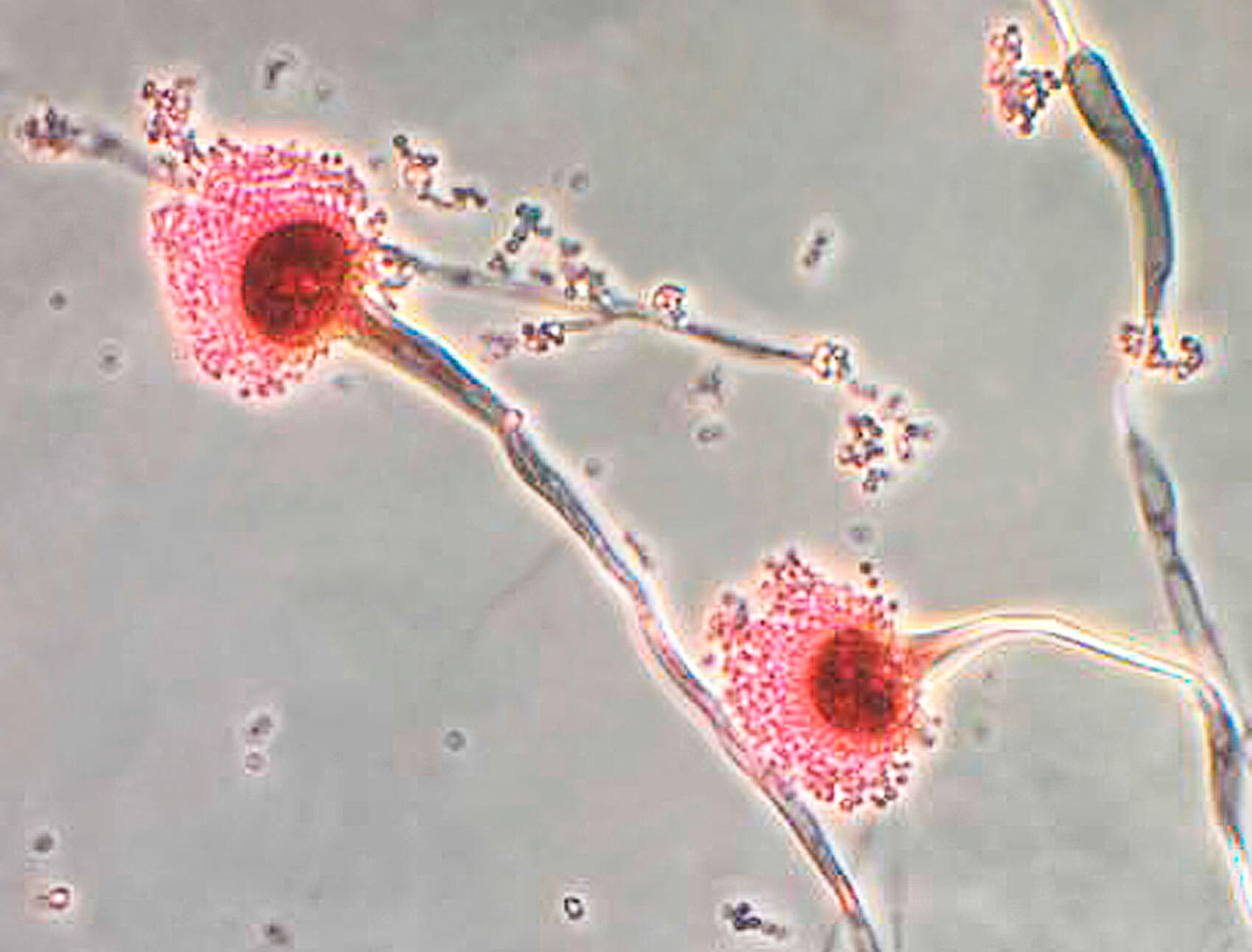
Dans leurs formes courantes, ces infections peuvent ne pas présenter de gravité particulière. Mais, dans leurs formes invasives, elles affectent des personnes qui présentent par ailleurs de graves pathologies liées au système immunitaire (cancer, sida, maladie respiratoire chronique) ou des patients ayant reçu une greffe de moelle ou d’organe. Elles sont alors dramatiques, le risque de mortalité dépassant les 50 % !
Une surveillance croissante
Les mycoses résistantes aux antifongiques font l’objet d’une surveillance croissante. L’OMS a publié en 2022 la première liste2 de 19 champignons particulièrement dangereux (par exemple, Cryptococcus neoformans, Candida auris, Aspergillus fumigatus et Candida albicans) – non seulement car « l’incidence et la portée géographique des maladies fongiques s’étendent dans le monde entier sous l’effet du réchauffement climatique et de l’augmentation des échanges internationaux », comme le souligne le rapport de l’OMS, mais surtout parce qu’ils sont de plus en plus résistants aux traitements.
En effet, les mêmes antifongiques sont utilisés en santé humaine, en santé animale, en agriculture et en horticulture. Comme c’est le cas pour les antibiotiques trop prescrits, auxquels les bactéries sont devenues résistantes, l’usage massif d’antifongiques entraîne une diminution progressive de leur efficacité.
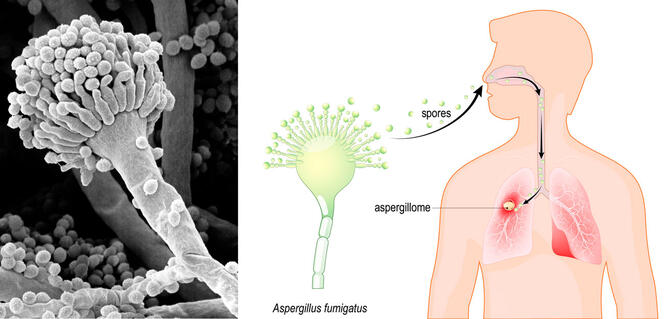

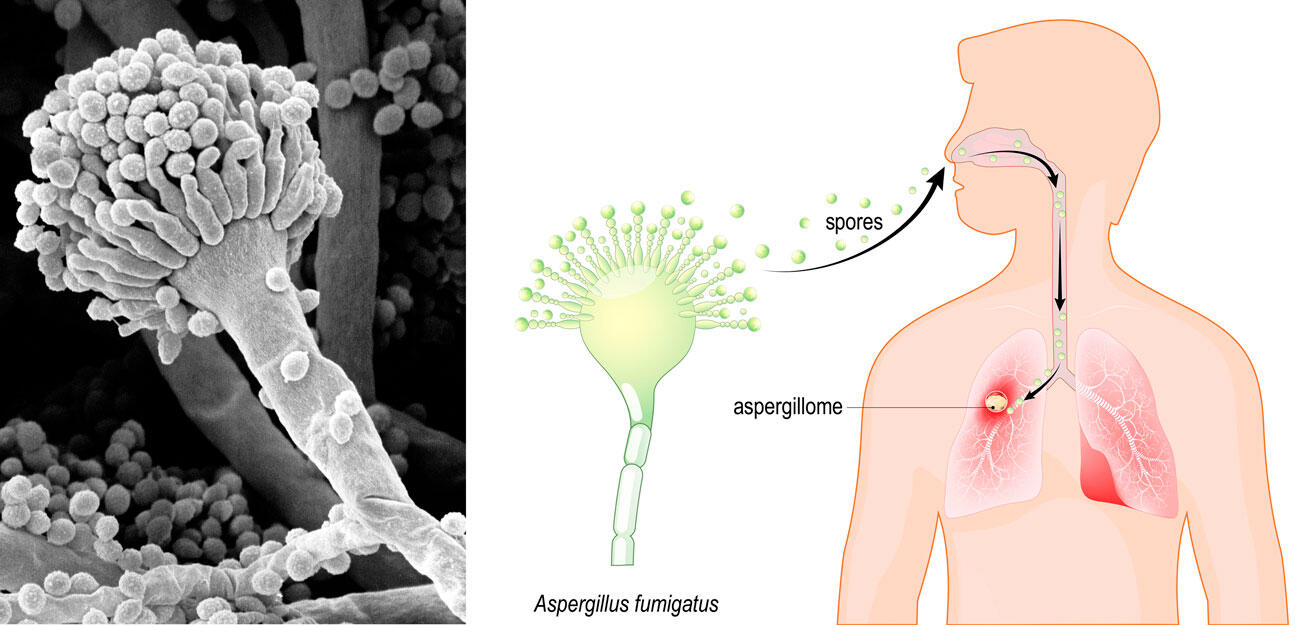
Cela fait déjà une quinzaine d’années que les biologistes hollandais rapportent dans des publications scientifiques une progression inquiétante de la résistance aux antifongiques aux Pays-Bas. Notamment pour les infections causées par Aspergillus. Ils ont établi sur place un lien avec les quantités importantes de fongicides déversées sur les cultures de fleurs, dans des zones habitées.
« Cela nous avait mis la puce à l’oreille, relate Laurence Millon. En 2013, nous avons isolé à l’hôpital de Besançon, chez un patient agriculteur de profession, une souche résistante d’Aspergillus au principal traitement existant, le voriconazole. Nous avons alors fait des prélèvements non seulement sur les terres qu’il cultivait, sur les poussières issues des filtres de son tracteur, mais aussi à son domicile, car nous savons que les spores se diffusent sur des distances importantes et restent en suspension très longtemps dans l’air, les sols, le compost. Et nous avons effectivement trouvé des spores porteuses d’une mutation de résistance (TR34) dans un des lieux fréquentés par cet agriculteur. De ce fait, leur inhalation était très probable. »
Les scieries contaminées
Quelques années plus tard, la même équipe est surprise par le cas d’un autre patient, employé dans une scierie. Celui-ci a subi un traumatisme de la face sur son lieu de travail et, alors qu’il était en bonne santé avant l’accident, a développé ensuite une infection sinusienne gravissime, résistante au traitement. « Dans les scieries, les planches sont souvent trempées dans des bains remplis de fongicides azolés pour lutter contre les champignons lignivoresFermerLignivore : qui attaque le bois., puis mises à sécher dehors. Ce qui explique qu’il a été contaminé par une souche d’Aspergillus résistante lors de l’accident et que les sols aient été eux aussi largement contaminés, comme les prélèvements que nous avons faits dans une vingtaine de scieries utilisant les mêmes pratiques l’ont prouvé. »
À l’hôpital de Besançon, à la suite de la contamination des terrasses, tous les bulbes ont été retirés et remplacés l’année suivante par des bulbes issus de l’horticulture biologique, cultivés sans fongicides. Résultat : en 2019, 69 isolats d’Aspergillus fumigatus résistants aux azolés avaient été détectés dans la terre ; en 2020, des prélèvements réalisés avec le même mode opératoire ont permis de constater que le taux de résistance était passé de 71 % à moins de 3 % en un an.
Trouver les armes pour combattre la résistance
Le « coupable » a donc été formellement identifié. Mais, sachant qu’il est illusoire d’imaginer que l’horticulture diminue rapidement et drastiquement le recours aux fongicides, comment combattre cette résistance ?
« Alors que les bactéries sont des organismes procaryotes, sans noyaux, que les antibiotiques peuvent détruire sans nuire aux personnes malades, les champignons3 sont, comme les êtres humains, des organismes eucaryotes, dont les cellules sont dotées d’un noyau, explique Thierry Noël, responsable de l’équipe Candida au laboratoire Microbiologie fondamentale et pathogénicité4. Il est donc difficile de trouver des traitements qui s’attaquent aux champignons sans nuire dans le même temps à la santé des êtres humains porteurs de mycoses ! »
C’est entre autres pourquoi il existe seulement quatre classes de médicaments antifongiques disponibles pour les infections les plus graves, contre une dizaine de familles d’antibiotiques. Les antifongiques les plus courants sont des traitements dits « azolés ». Ceux-ci bloquent la production d’un composant important de la membrane cellulaire des champignons, l’ergostérol, « qui ne se trouve pas chez l’humain, mais qui est un équivalent de notre cholestérol », précise Thierry Noël.
Or, lorsque les fongicides azolés sont appliqués dans l’environnement, ils favorisent, par pression de sélection, les souches d’Aspergillus adaptées à ces molécules azolées. Conséquence, des souches résistantes aux fongicides azolés se développent.
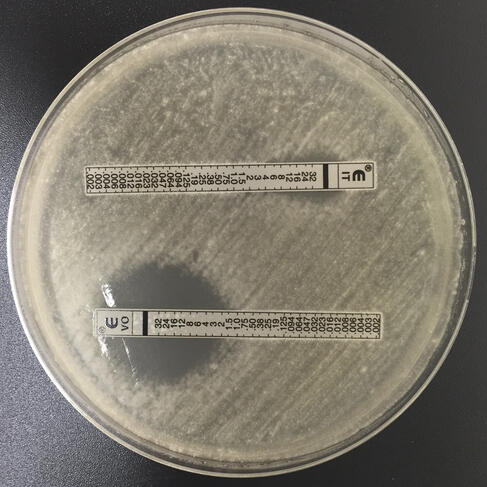

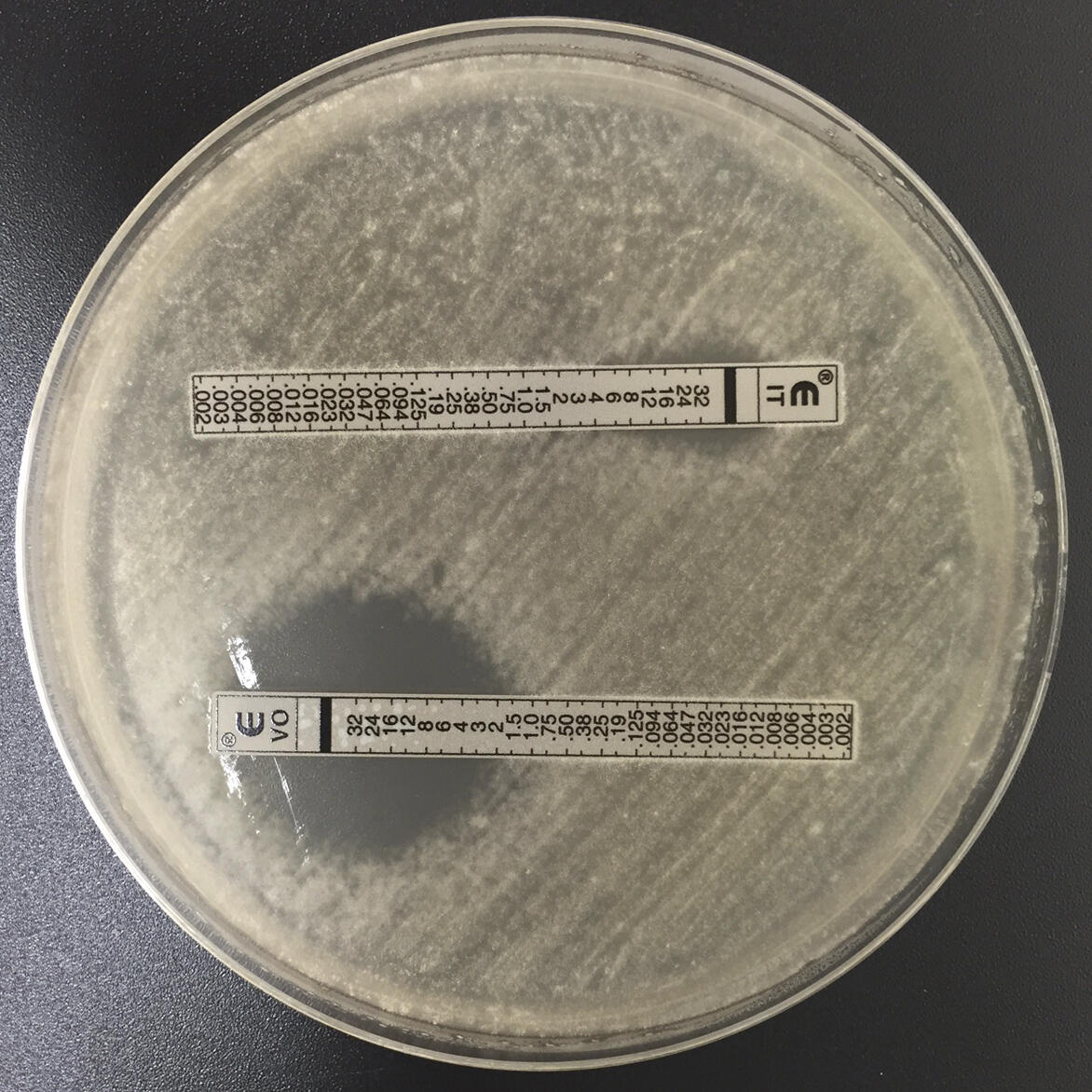
« Aux Pays-Bas, on atteint des niveaux de résistance très élevés, de l’ordre de 20 à 30 % de souches résistantes chez les patients, alors qu’en France, nous ne dépassons pas, pour l’instant, les 5 ou 6 %, observe Laurence Millon. Mais ces résistances imposent tout de même, depuis quelques années, de réaliser systématiquement désormais un « antifongigramme », c’est-à-dire une analyse biologique permettant de détecter une mycose résistante, donc un possible échec thérapeutique.
« Si le patient est porteur d’une telle mycose résistante, nous sommes donc obligés de lui proposer un autre traitement, efficace contre toutes les formes de mycoses, mais avec des risques d’effets secondaires graves », commente Laurence Millon. Compte tenu des niveaux trop élevés de résistance, les médecins des Pays-Bas sont déjà contraints de prescrire tout de suite, en première intention, cet antifongique plus toxique.
Trouver de nouveaux traitements
Pourrait-on imaginer une autre solution ? À Bordeaux, Thierry Noël a démarré il y a quelques années des recherches sur un traitement des Candida responsables d’infections vaginales qui serait basé sur l’immunothérapie, sans recourir aux antifongiques. « Il s’agit d’apprendre au propre système immunitaire du patient à reconnaître l’infection par ce pathogène, puis à s’en défendre, explique le chercheur. Mais, pour l’instant, nous n’en sommes qu’aux expérimentations sur la souris. »
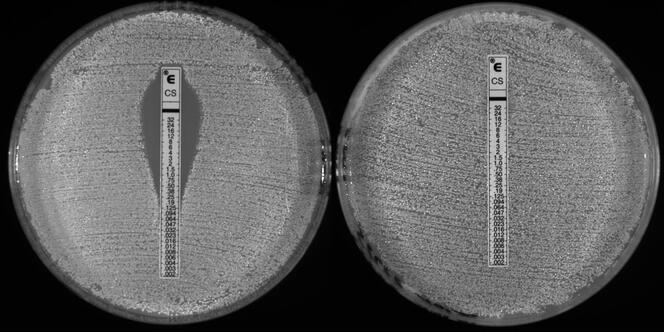

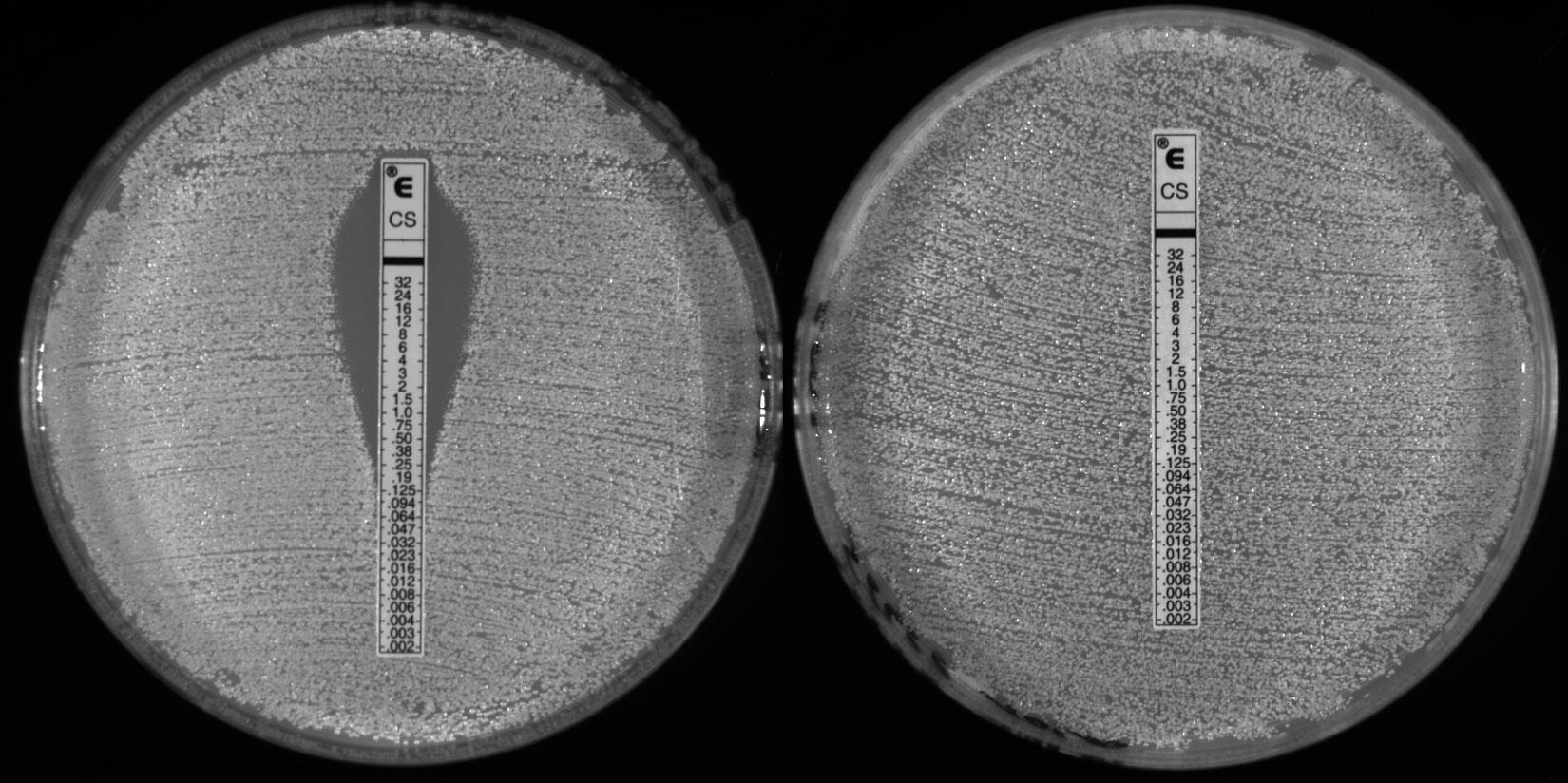
En France, on estime que 16 000 personnes ont contracté une infection fongique sévère entre 2012 et 2022, souligne Fanny Lanternier, la responsable du Centre national de référence des mycoses invasives et des antifongiques (CNRMA), qui suit de près l’évolution de ces pathologies à l’Institut Pasteur. Et, dans le monde, celles-ci seraient responsables chaque année de 1,6 million de décès.
Un projet de recherche européen5 vient par ailleurs d’être lancé, impliquant une vingtaine de pays (pays européens, mais aussi Australie, Afrique du Sud, Canada, etc.). Il doit permettre, dans un large éventail de zones géographiques (dont l’UE et l’Afrique), de détecter l’émergence d’une résistance aux antifongiques à double usage (santé humaine et agriculture) et, grâce à des outils de surveillance par échantillonnage d’air, d’étudier plus particulièrement le risque d’exposition à Aspergillus fumigatus résistant aux antifongiques. ♦
- 1. Unité CNRS/Université Marie-et-Louis-Pasteur, Besançon.
- 2. Liste OMS des 19 agents pathogènes fongiques qui présentent la plus grande menace pour la santé publique, divisée en trois catégories (priorités critique, élevée et moyenne) : https://www.who.int/publications/i/item/9789240060241
- 3. Les organismes du règne fongique sont définis par plusieurs caractéristiques, dont le fait d’être des organismes eucaryotes, mais pas seulement. Ils sont aussi dépourvus de chlorophylle, ils se nourrissent par absorption, et leur organisme est dépourvu de feuilles, de tiges et de racines, etc.
- 4. MFP, unité CNRS/université de Bordeaux.
- 5. Bridging the gap between environment and patient; investigating the risk and transmission of antifungal resistance in Aspergillus fumigatus (GAP-AFR) : https://www.jpiamr.eu/projects/gap-afr/
Voir aussi
Auteur
Journaliste en presse écrite, spécialisée des sujets sciences, société et éducation (pour Le Monde, Science et Vie, Eurêka, etc.), Marina Julienne a aussi réalisé plusieurs documentaires pour France Télévision et Arte. À la rédaction de CNRS Le Journal depuis 2023, elle suit plus particulièrement...