Vous êtes ici
Pandémies : l’éternel retour
Temps de lecture : 19 minutes
Les épidémiologistes sont à nouveau sur le qui-vive. Au cours des derniers mois, des milliers d’otaries ont été retrouvées mortes sur les plages du Chili et du Pérou. La cause : H5N1, la grippe aviaire, un virus que l’on surveille comme du lait sur le feu depuis vingt ans. Depuis sa réémergence en Chine en 2003, on craint qu’il ne soit à l’origine d’une pandémie de grande ampleur. Pour ce faire, il ne manque au virus qu’une chose : la capacité à se transmettre d’humain à humain de manière efficace. Jusqu’à présent, la plupart des infections humaines par cette souche provenaient de contacts avec des oiseaux contaminés.
C’est pourquoi la mort soudaine de tant d’otaries inquiète : une telle mortalité pourrait être le signe que la grippe aviaire s’est propagée d’un individu à l’autre. « Si cela se confirme, ce serait un fait de la plus haute importance, indique Martin Blackledge, directeur adjoint de l’Institut de biologie structurale1. Cela voudrait dire que le virus est en train de s’adapter aux mammifères. » Une crainte amplifiée par la survenue de l'épidémie de grippe H5N1 qui affecte les élevages bovins étasuniens depuis le printemps 2024, et l'annonce du décès du premier cas humain infecté par une souche H5N2 au Mexique. Et voilà que nos souvenirs de l’atroce année 2020 reviennent nous hanter.
La fin de l’optimisme
Qu’elle semble loin cette époque dorée, les années 1950 et 1960, lorsque les médecins et les autorités sanitaires des pays développés pensaient que la menace des maladies infectieuses serait bientôt du passé. « On voyait les progrès de l’hygiène, de l’infrastructure hospitalière, des vaccins et des antibiotiques. On venait d’un énorme succès contre la polio. C’était bon, on avait tout compris, il était temps de passer à autre chose », ironise Serge Morand, directeur de recherche au laboratoire Maladies infectieuses et vecteurs : écologie, génétique, évolution et contrôle2.

Il a fallu déchanter très vite. Une série de bactéries et virus inconnus, VIH, Legionella pneumophila, Ebola, Nipah, SRAS, a tordu le cou à cet optimisme béat. Les experts avaient oublié l’incroyable capacité d’adaptation des micro-organismes à toute intervention humaine. Ils avaient aussi laissé de côté d’importants facteurs qui rendent possible l’émergence de nouveaux pathogènes comme le développement des échanges commerciaux et du transport aérien, ou encore l’inexorable dégradation des écosystèmes de la planète.
Emprise agricole et pandémie
L’émergence du virus Nipah est un cas d’école. Il contient, en effet, les principaux facteurs qui, au cours des dernières décennies, ont augmenté le risque de pandémie : la progression de la frontière agricole, l’élevage intensif et l’accélération des mouvements de personnes et de marchandises. Voici son histoire. En 1998, à Nipah, un village malaisien, un groupe de chauves-souris s’installe près d’un élevage de porcs. De nouvelles plantations de palmiers à huile les ont privées de leur habitat et de leur source de nourriture. Les manguiers autour des enclos à cochons sont désormais leur garde-manger.
Or, ces chauves-souris, des renards volants, constituent le réservoir naturel d’un Henipavirus inconnu jusqu’alors. Leurs déjections contaminent les porcs qui à leur tour contaminent les travailleurs de l’élevage. Un foyer épidémique s’allume, avec quelque 300 cas et plus de 100 décès précédés d’encéphalites foudroyantes. Les exportations de viande et d’animaux vivants permettent ensuite au virus Nipah, comme on l’a appelé plus tard, de se répandre dans toute l’Asie du Sud-Est. Heureusement pour nous, Nipah ne se transmet pas très efficacement d’humain à humain. Il tue tout de même quelques dizaines de personnes par an.
Cet événement montre bien le danger que posent les zoonoses, les maladies animales. 75 % des pathogènes émergents proviennent des animaux. Le VIH (chimpanzés, gorilles et mangabeys), le syndrome respiratoire du Moyen-Orient (chameaux), Ebola, le Sars-CoV-1 et Sars-CoV-2 (chauves-souris) sont d’autres exemples récents.
L’élevage intensif accélérateur de zoonoses
Et c’est ici qu’intervient l’élevage. « Les animaux de rente constituent des hôtes intermédiaires qui fonctionnent comme amplificateurs des pathogènes », explique Serge Morand. En effet, les batteries d’animaux tous semblables génétiquement et souvent en stress à cause de leurs piètres conditions de vie, constituent d’immenses bioréacteurs où la sélection naturelle s’adonne à d’étonnantes expériences biologiques.
Cas paradigmatique ? La grippe mexicaine, ou grippe porcine, qui a fait trembler le monde en 2009. Tout porte à croire que cette souche a émergé d’un élevage de porcs au Mexique. Hautement contagieuse, elle présente une caractéristique étonnante : son génome contient des éléments de souches aviaires, humaines et porcines. Pour que cette étrange chimère voie le jour, il a fallu une série d’infections et de surinfections qui n’auraient pu survenir ailleurs que dans un milieu concentrant de milliers de bêtes.
Le passage des animaux vers les humains devient alors plus aisé. Les souches « perfectionnées » dans les élevages peuvent aussi passer dans la faune sauvage et se répandre dans le monde entier au gré des migrations. Or, l’élevage n’a cessé de se développer au cours des dernières décennies. Il y a aujourd’hui dans le monde 1,4 milliard de vaches, 1,5 milliard de cochons et environ 40 milliards de poulets. Pour nourrir tout ce beau monde, il a fallu étendre les cultures aux dépens des forêts et autres zones sauvages.
Ce changement d’usage des terres favorise aussi les pandémies. « La déforestation, l’expansion des cultures et la simplification des paysages rendent plus fréquents les contacts entre la faune sauvage et la faune domestique », rappelle Serge Morand. Nipah en est bien la preuve. Mais un autre phénomène est à l’œuvre. Dans les écosystèmes sains et riches en biodiversité, les équilibres écologiques comme la prédation ou la compétition font qu’aucune espèce animale ne peut voir sa population augmenter de façon soudaine. La propagation des pathogènes est plus difficile lorsque les hôtes sont éparpillés et peu nombreux.
Tout change lorsque l’écosystème entre en crise. « Lorsqu’un environnement est dégradé, on perd des prédateurs et des compétiteurs, et certaines espèces explosent », explique Serge Morand. Ces espèces devenues invasives, ainsi que leurs pathogènes, se répandent et entrent inévitablement en contact avec l’humain et ses bêtes domestiquées.
Un autre facteur qui favorise les émergences de pathogènes est le changement climatique. Celui-ci met les écosystèmes sous pression, pousse les espèces sauvages hors de leurs habitats naturels et étend les aires endémiques de vecteurs de pathogènes tels que les moustiques ou les tiques.
La fragile barrière des espèces
Pour un pathogène animal, s’adapter à l’humain n’est pas sans difficultés. « Il est obligé de muter pour s’adapter et exploiter les cellules humaines. Il doit “convaincre” les protéines de son hôte de travailler pour lui », explique Martin Blackledge. Mais la barrière des espèces n’est pas insurmontable. Martin Blackledge s’intéresse aux mutations qui permettent au virus de la grippe aviaire H5N1 d’infecter les cellules humaines. Lors d’une collaboration avec l’Institut Pasteur et le Laboratoire européen de biologie moléculaire, il étudie en détail les interactions avec l’hôte d’une protéine virale clé : la polymérase. Celle-ci permet de multiplier les copies de l’ARN du virus et de lancer la fabrication de protéines virales. L’équipe s’intéresse aux mécanismes par lesquels la substitution d’un unique acide aminé dans la polymérase permet au virus aviaire de se multiplier dans les cellules humaines.
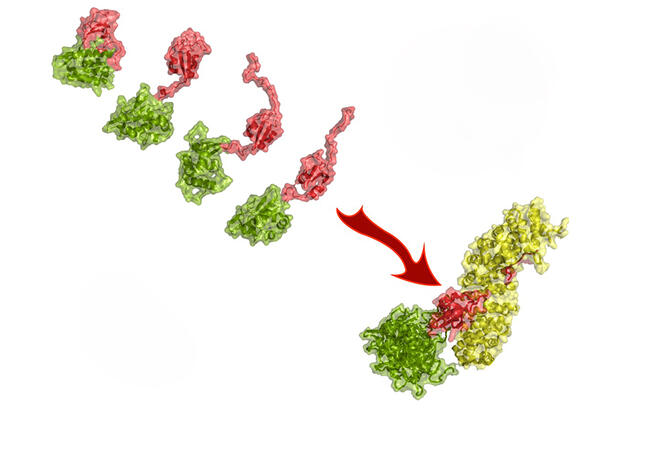

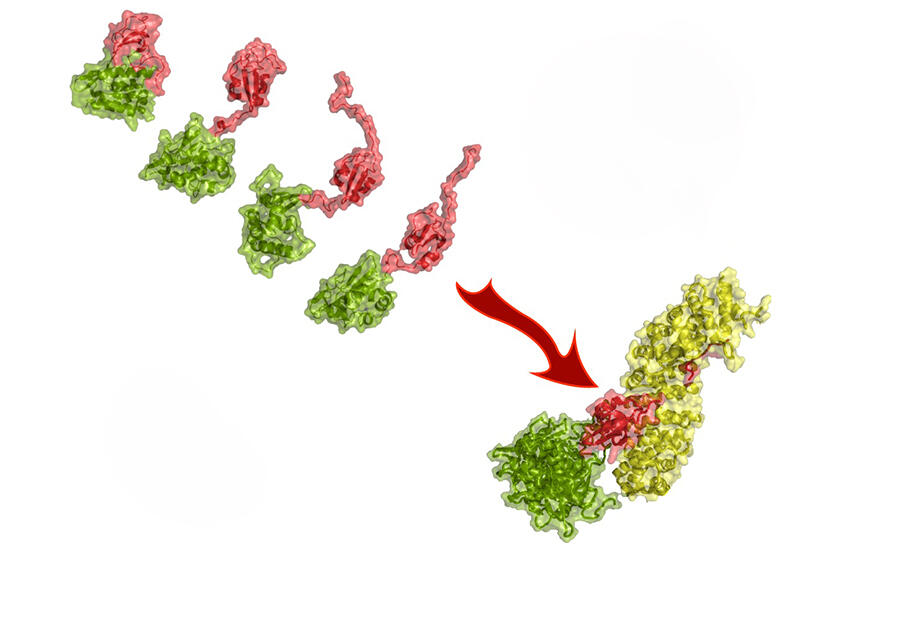
La mutation à l’origine de cette substitution existe bel et bien dans la nature. Nécessaire pour que le virus infecte les humains, mais elle n’est toutefois pas suffisante pour faire de H5N1 un pathogène humain. La question de savoir pourquoi H5N1 ne se transmet pas d’humain à humain reste ouverte. Au vu de l’incident avec les otaries, il reste à voir si cette incapacité va perdurer.
Course à l'armement chez les microbes
« Depuis l’apparition de l’Homme moderne, il s’est écoulé environ 7 500 générations. Le même nombre de générations est atteint par le VIH au sein d’une personne porteuse après 20 ans d’infection sans traitement », rappelle Samuel Alizon, directeur de recherche au Centre interdisciplinaire de recherche en biologie3 dans son livre C’est grave docteur Darwin ?4 Chaque nouvelle génération est, bien sûr, une nouvelle opportunité pour que les mutations génétiques produisent du nouveau.
Cette agilité fait que les pathogènes constituent une cible mouvante, une cible réactive : toute intervention humaine pour lutter contre un virus, une bactérie ou un champignon sélectionne les variants les plus aptes à résister à cette intervention. Une souche peut ainsi devenir plus virulente, ou plus contagieuse, ou peut acquérir des résistances qui la rendent très difficile à combattre. Elle peut aussi devenir invisible au système immunitaire, ou encore, réduire le temps qu’il lui faut pour se reproduire. Tout cela, grâce à la puissance aveugle de la sélection naturelle qui choisit, parmi les variants, ceux qui se reproduisent le plus efficacement.
Difficile, bien souvent, de prévoir comment chaque trait va évoluer. Prenons par exemple, la virulence. « La virulence est liée au fait qu’un pathogène exploite les ressources de son hôte, et que cette exploitation a un coût pour ce dernier. Généralement, les variants qui exploitent le mieux la ressource se reproduisent le mieux », explique Samuel Alizon. La virulence est le résultat d’un équilibre farouchement darwinien. Une souche qui exploite son hôte moins bien que la souche voisine risque fort d’être remplacée. En même temps, si elle tue son bonhomme trop vite, elle ne se propagera pas.
Pour les scientifiques, le Covid-19 a constitué un extraordinaire observatoire de l’évolution d’un pathogène. « On a vu à quel point l’adaptation du virus était fondamentale dans le processus épidémique », explique François Blanquart, chercheur au Centre interdisciplinaire de recherche en biologie5. La succession des variants a été particulièrement riche en enseignements. « Avec les variants, on a observé une dynamique de balayage sélectif extraordinaire. Chaque nouveau variant remplaçait les précédents en un temps record. » Ainsi, le variant Alpha, plus virulent et plus transmissible que son prédécesseur, a balayé la souche originale de Wuhan. Peu après, c’est Delta, encore plus virulent et transmissible qu’Alpha, qui a poussé ses concurrents à l’extinction.
L’arrivée des vaccins a changé le cours de l’évolution du virus. « Omicron a éliminé les variants antérieurs en partie parce qu’il se propageait très bien parmi la population vaccinée », explique François Blanquart. Les scientifiques pensent qu’à l’avenir, ce coronavirus, comme la grippe, présentera de nombreux variants en même temps, qui évolueront dans un paysage immunitaire hétérogène. Il sera impossible en tout cas de s’en débarrasser. Homo sapiens est désormais son réservoir naturel.
Les champignons font de la résistance
En octobre 2022, l’Organisation mondiale de la santé (OMS) lançait l’alerte sur une menace croissante : les champignons. L’organisation internationale publiait une liste des 19 espèces à surveiller en priorité et appelait à une intensification de la recherche scientifique sur ces pathogènes trop souvent négligés. « Depuis une dizaine d’années, on voit émerger de nouvelles espèces, ce qui pourrait être lié au changement climatique entraînant également une modification des zones de répartition de certains champignons connus », explique Sarah Dellière, chercheuse à l’Institut Pasteur et médecin microbiologiste à l’hôpital Saint-Louis AP-HP. Parmi ces émergences, celle de Candida auris a de quoi attirer l’attention. Cette levure découverte en 2009 est inoffensive lorsqu’elle colonise la peau. Mais lorsqu’elle passe dans le sang, souvent à la suite d’une intervention médicale, elle tue les patients une fois sur deux.
L’habitat naturel de Candida auris semble être le rivage des estuaires et les mangroves. Elle est extrêmement résistante à la chaleur, aux agents chimiques comme le chlore et à la plupart des antifongiques. Ces traits laissent penser qu’avant de devenir un pathogène hospitalier, elle a dû apprendre à supporter la pollution, les antifongiques azolés déversés par l’agriculture et l’augmentation des températures liée au changement climatique. Elle est si robuste que, lorsqu’elle apparaît dans un hôpital, comme en 2015 à Valence, en Espagne, il est très difficile de s’en débarrasser.
Un autre exemple de champignon dont la résistance inquiète le monde hospitalier est Aspergillus fumigatus, une moisissure ubiquitaire dans l’environnement et qui constitue un danger pour les personnes au système immunitaire affaibli. « Au Pays-Bas, où les champs de tulipes sont arrosés avec des antifongiques, 10 % des patients qui arrivent à l’hôpital avec une infection par Aspergillus présentent des souches résistantes ». Pour les traiter, les médecins doivent recourir à un antifongique de dernière ligne particulièrement toxique pour les patients. Encore une fois, l’extraordinaire capacité d’adaptation des micro-organismes et la dégradation environnementale font croître les menaces sur la santé.
Et il en est de même pour les bactéries : exposées sans cesse aux antibiotiques utilisés en milieu hospitalier et par les éleveurs, elles ont appris à s’en déjouer. Ou plutôt, pour être précis, cette exposition a sélectionné les souches résistantes. Qualifiée de pandémie silencieuse, l’antibiorésistance des bactéries pathogènes risque de renvoyer l’humanité aux temps d’avant la pénicilline, lorsque des infections courantes tuaient à tour de bras.
Se protéger de la prochaine vague
Pourra-t-on éviter que la tragédie de 2020 se répète ? Peut-on imaginer un monde sans pandémies ? Bill Gates, l’ex-PDG de Microsoft devenu philanthrope pense que oui, à condition de mettre en place sa nouvelle grande idée : une équipe de chasseurs de virus hyperspécialisée prête à débarquer n’importe où dès l’apparition du moindre foyer épidémique. Si seulement c’était aussi simple… « On pense aux épidémies comme quelque chose qui émerge et se propage rapidement. C’était le cas du Sars-CoV-2. Mais il y a aussi des propagations beaucoup plus lentes, comme les antibiorésistances. Certaines infections sont chroniques, comme le VIH, et il faut des années avant de voir apparaître les symptômes. Quand on les détecte, c’est loin des foyers initiaux », explique Samuel Alizon.
Pour réduire les risques pandémiques, il faut plutôt se tourner vers les bonnes vieilles politiques publiques. Cela passe par l’amélioration des systèmes de santé, en particulier ceux des pays du Sud où l’accès au soin n’est pas toujours acquis. « Les conditions socio-économiques jouent sur l’impact des pandémies. Par exemple, des analyses ont pointé que l’appauvrissement des systèmes de soin en Chine a pu faciliter la propagation du Sars-CoV-2 », prévient Samuel Alizon. Il faudra aussi améliorer la sécurité des laboratoires classés L3 et L4, ceux qui manipulent des pathogènes dangereux. On sait que les fuites sont possibles.
« L’exemple le plus connu est celui de la grippe dite russe de 1977 qui a tué environ 700 000 personnes. Ce variant est si proche de celui de la grippe dite espagnole de 1918 que la piste de l’erreur humaine fait peu de doute », rappelle le chercheur.
Pour le Sars-CoV-2, il y a un consensus scientifique pour dire que la pandémie est partie du marché de Wuhan. Quant à savoir comment le virus y est arrivé, la majorité des scientifiques penche pour une origine naturelle mais pour d’autres, l’hypothèse de la fuite du laboratoire ne peut pour l’instant être écartée.
Côté prévention, une autre approche prend de l’ampleur. Il s’agit de l’approche One Health (une seule santé). Promue par de grandes organisations internationales comme l’Organisation des Nations unies pour l’alimentation et l’agriculture (FAO) ou l’OMS, elle provient de ce constat : la santé des populations humaines est intimement liée à la santé des écosystèmes et à celle des animaux d’élevage. Tout dommage fait à l’un est une menace sur l’autre. Serge Morand voudrait démontrer que le corollaire est tout aussi vrai : une action en faveur de l’environnement aura un impact positif sur la santé humaine. Pour cela, il étudie l’impact sanitaire sur la population de 14 communautés de la reforestation des marges d’un parc national de la province de Nan, en Thaïlande. « Nos résultats préliminaires montrent que les espèces sauvages qui s’adaptent à l’Homme, comme les rongeurs, sont en recul. Il semble que l’incidence de la leptospirose et du typhus des broussailles soit en diminution », indique Serge Morand. Ainsi, la meilleure façon de réduire les risques de pandémie est d’entreprendre les actions qui permettront de freiner l’érosion de la biodiversité, de réduire la pollution, de limiter l’impact des systèmes agricoles et de mitiger le changement climatique.♦
------------------------------------------------------
La peste : la menace continue
Yersinia pestis n’a pas fini de nous faire peur. Le bacille de la peste, celui-là même qui, au XIVe siècle, a tué entre 30 et 50 % des Européens, fait partie des 16 pathogènes à surveiller en priorité selon l’ANRS/Maladies émergentes, une agence autonome de l’Inserm. « La peste a une grande capacité à réapparaître là où on la croyait disparue », explique Sébastien Bontemps-Gallo, chercheur au Centre d’infection et d’immunité de Lille6, qui s’intéresse aux mécanismes moléculaires de l’adaptation de la bactérie à son vecteur, la puce, afin d’identifier des cibles thérapeutiques pour un éventuel vaccin ou un médicament. « Elle est revenue récemment en Algérie et en Libye. Aux États-Unis, elle cause quelques dizaines d’infections tous les ans. En Chine, elle réapparaît de temps en temps, ce qui oblige au confinement de villes entières. » Mais c’est à Madagascar où elle reste la plus dangereuse. Elle y a trouvé chez les rats des rizières et leurs puces un réservoir naturel grâce auquel elle circule à bas bruit. Elle peut cependant y redevenir épidémique, comme en 2017, lorsqu’elle a tué 171 personnes en quelques mois. Comme tous les pathogènes, Yersinia pestis évolue. « À Madagascar on a trouvé des souches multi-résistantes aux antibiotiques. » Une raison de poids pour ne pas perdre le pathogène de vue.
------------------------------------------------------
Un nouveau laboratoire pour étudier les liens entre environnement et santé
Le CNRS, l'université Mahidol et l'université Kasetsart, officialiseront la création du laboratoire international de recherche (IRL) Health, Disease Ecology, Environment, and Policy (HealthDEEP) le 12 juillet à Bangkok. Les recherches qui seront menées au sein de ce laboratoire franco-thaïlandais porteront sur la biodiversité et ses liens avec la santé humaine. Il servira de centre non seulement pour la recherche collaborative mais aussi pour la formation et le dialogue avec les décideurs politiques. (Lire le communiqué de presse.)
À lire sur notre site
Contrer l’antibiorésistance
« La question de l'origine du SARS-CoV-2 se pose sérieusement »
Covid-19 : « L’évolution virale reste largement imprévisible »
« Face aux pandémies, les sciences de l’écologie sont plus que jamais nécessaires »
« L’urgence environnementale est bien plus pressante aujourd’hui »
Vaccination : quelle stratégie face aux variants ?
- 1. Unité CNRS/CEA/ Université de Grenoble Alpes.
- 2. Unité CNRS/ IRD/ Université de Montpellier.
- 3. Unité CNRS/Inserm/Collège de France.
- 4. C’est grave, Dr Darwin ? L’évolution, les microbes et nous, Samuel Alizon, Seuil, février 2016.
- 5. Unité CNRS/Collège de France/Inserm.
- 6. Unité CNRS/CHU Lille/Inserm/Institut Pasteur/Université de Lille.