Vous êtes ici
Ce que les nanoparticules font à nos cellules

Oxyde de silicium (ou E551) dans les aliments en poudre pour éviter leur agglomération ; phosphate de calcium (ou E341) dans les dentifrices pour nettoyer les dents ; dioxyde de titane dans les peintures blanches, pour plus d’éclat ; nano-argents antibactériens et antifongiques dans les textiles ; nanoparticules d’or pour détruire de façon ciblée des cellules cancéreuses... : depuis la fin des années 1990, les nanoparticules manufacturées (par oppositions aux nanoparticules émises par les volcans ou la pollution automobile) se sont largement répandues dans notre environnement quotidien. Fabriquées à partir notamment de métaux (titane, argent…), mais aussi de carbone, de polymères ou encore de molécules organiques (lipides, peptides…), ces substances ont, par définition, des dimensions comprises entre 1 et 100 nanomètres1, et sont donc plus de 10 000 fois plus petites qu’un grain de sel fin.

Cette taille réduite fait que leur surface (où ont lieu les interactions avec leur environnement) est plus importante par rapport à leur volume ; cela leur confère des caractéristiques inédites en termes de résistivité, de conductivité électrique, de solubilité, de réactivité chimique ou encore de propriétés antibactériennes ou anti-agglomérantes. D’où le fort intérêt des industriels pour les nanoparticules et leur succès depuis leur déploiement. Revers de la médaille, la petite taille de ces substances est aussi à l’origine de fortes inquiétudes concernant leurs possibles effets sur la santé.
Plusieurs troubles et maladies suspectés
« En raison de leurs petites dimensions, les nanoparticules peuvent traverser différentes barrières physiologiques, comme celle séparant le cerveau de la circulation sanguine (barrière hémato-encéphalique), la peau ou le placenta qui protège le fœtus, et ainsi se répartir dans l’organisme », éclaire Aurélie Niaudet, ingénieure chimiste à la Direction d’évaluation des risques de l’Anses, une agence nationale chargée de s’assurer de la sécurité sanitaire de l’alimentation, et qui a publié en 2020 un rapport consacré aux « Nanomatériaux dans les produits destinés à l’alimentation2 ». Que sait-on à ce jour des potentiels dangers sanitaires ? « Plusieurs études chez l’animal indiquent que certaines nanoparticules peuvent s’accumuler dans différents organes et avoir plusieurs conséquences, dont notamment des retards de croissance, des anomalies dans le développement, des allergies, des effets délétères sur le système nerveux ou encore des cancers », synthétise Aurélie Niaudet. Par exemple concernant le dioxyde de titane (additif E171), destiné à donner une couleur blanche aux viennoiseries et confiseries, une étude sur le rat3 publiée en 2017 par des chercheurs franco-luxembourgeois a montré qu’une exposition orale chronique à ce composé a pu induire des lésions précancéreuses dans le côlon, chez 40 % des animaux exposés. Cela a conduit à son interdiction en France dès 2020, puis en Europe depuis janvier 2022.

D’autres travaux ont permis, eux, de lever une partie du voile sur les processus via lesquels ces particules et leurs dérivés interagissent avec nos cellules. Ainsi, des travaux4 publiés en 2021 par une équipe européenne – incluant des chercheurs du CNRS –, ont pu montrer que les nanoparticules métalliques agissent via un mécanisme « sournois » : elles transforment les molécules catécholes, chargées normalement de protéger l’ADN de l’oxydation (une réaction nocive)… en molécules semiquinones et quinones, des substances au contraire très agressives pour l’ADN ! Problème, « si les recherches sur les impacts des nanoparticules se sont énormément développées ces dernières années, on a encore très peu de données épidémiologiques sur les effets sanitaires de ces substances chez l’Homme », souligne Aurélie Niaudet. De plus, il manque également des informations sur le devenir de ces substances dans l’organisme ; à ce sujet, le Comité de la prévention et de la précaution (une structure dont les membres sont nommés par le ministre de l’Écologie) indiquait dans un rapport5 de 2020 la nécessité de « caractériser et suivre la transformation des nanomatériaux dans les matrices biologiques ».
Une analyse d'ampleur sur les nanoparticules métalliques
Au laboratoire Matière et systèmes complexes6, l’équipe de Florence Gazeau, physicienne, travaille justement sur cet axe de recherche. « Afin de comprendre les possibles méfaits des nanoparticules métalliques sur les cellules vivantes, il faut au préalable mieux appréhender leur devenir dans ces mêmes cellules », souligne-t-elle. Lors de travaux7 publiés en 2019 – auxquels Alice Balfourier, désormais chercheuse au Laboratoire de biomolécules8, a participé dans le cadre de sa thèse – les chercheurs sont arrivés à un résultat surprenant. Ils ont suivi, six mois durant, les biotransformations de nanoparticules d’or capturées par des fibroblastes (les cellules du tissu conjonctif). Cela en combinant l’imagerie par microscopie électronique à transmission (une technique de microscopie dont la résolution peut atteindre 0,08 nanomètre) et l’étude de l’expression de plus de 18 000 gènes au cours du temps.
Alors que jusque-là, il était communément admis que les nanoparticules d’or restaient indéfiniment intactes dans le lysosome (une structure qui fait office de déchetterie dans la cellule), il est apparu que ces substances subissent en fait, en quelques semaines, une dégradation puis une recristallisation de l’or en une structure en nano-feuillets… Un phénomène qui avait déjà été observé pour les ions d’or. Ce qui indique, point important, que l’impact des nanoparticules d’or sur les cellules dépend plus de la nature du métal les constituant que de leur nature nanoparticulaire.
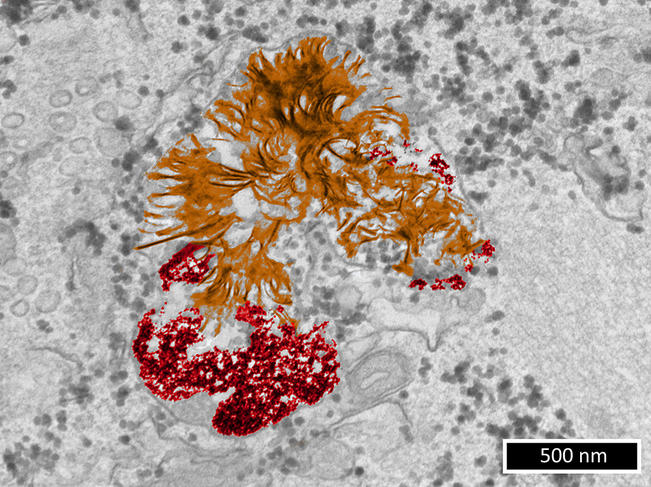

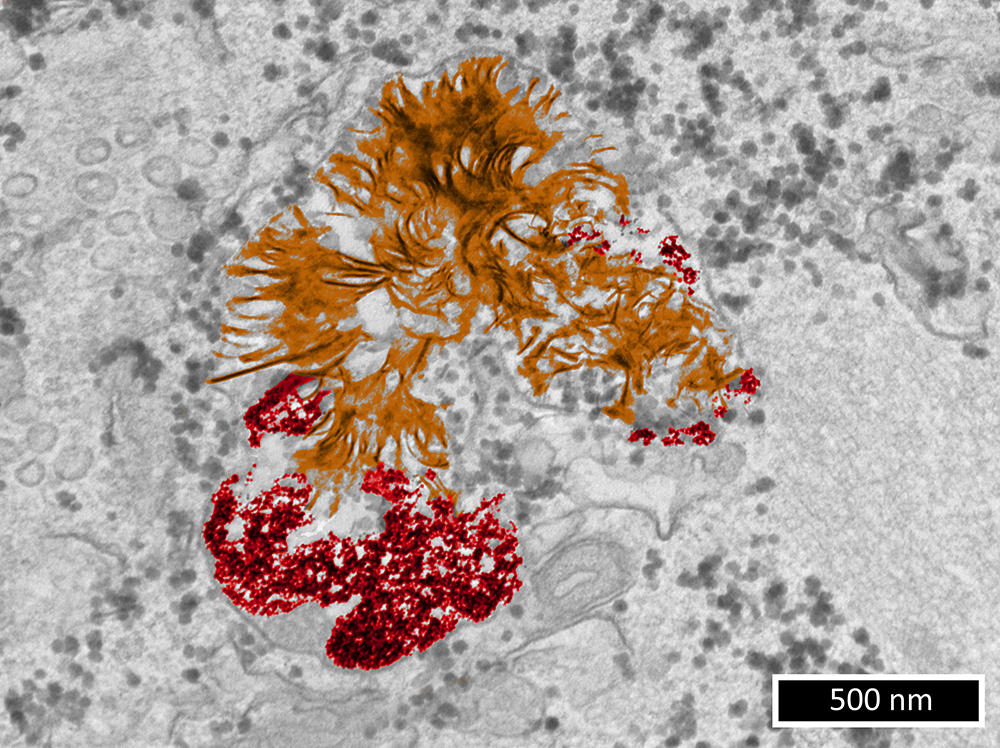
Des travaux parus en septembre dernier9, ont prolongé cette première étude : « nous voulions savoir si notre découverte surprenante concernant l’or, à savoir que les cellules répondent de façon similaire à ce métal qu’il soit sous forme d’ions ou de nanoparticules, pouvait concerner d’autres métaux », explique Florence Gazeau.
Cette fois, les chercheurs ont étudié la réponse moléculaire de cellules humaines à des nanoparticules issues de huit métaux différents : or mais aussi cadmium, cuivre, fer, platine, argent, titane et zinc. « Notre but précis était de comparer la réponse des cellules humaines à ces différents éléments, en termes d’expression des gènes et donc de production de protéines. Cela, afin de voir si cette réponse cellulaire était similaire ou variait selon la nature des métaux et leur formulation », précise Alice Balfourier.
Les chercheurs ont réalisé une méta-analyse de 56 études. Lesquelles concernaient le niveau d’expression de plusieurs milliers de gènes (14 912 au total) dans différents types de cellules (de peau, de foie, de muscles…) exposées à des ions ou des particules métalliques pendant 1 à 24 heures.
Une conclusion généralisée à tous les métaux étudiés
Il en est ressorti que pour tous les métaux susmentionnés, les gènes surexprimés après exposition des cellules étaient toujours plus ou moins les mêmes, que les cellules aient été mises en présence d’ions ou de nanoparticules dérivant de ces métaux. « Ce résultat généralise à tous les métaux étudiés ce que l’on a découvert pour l’or en 2019 : les cellules sont plus sensibles aux ions métalliques libérés par les nanoparticules qu’aux propriétés structurales intrinsèques de ces nanoparticules, comme leur taille ou leur forme », développe Alice Balfourier.


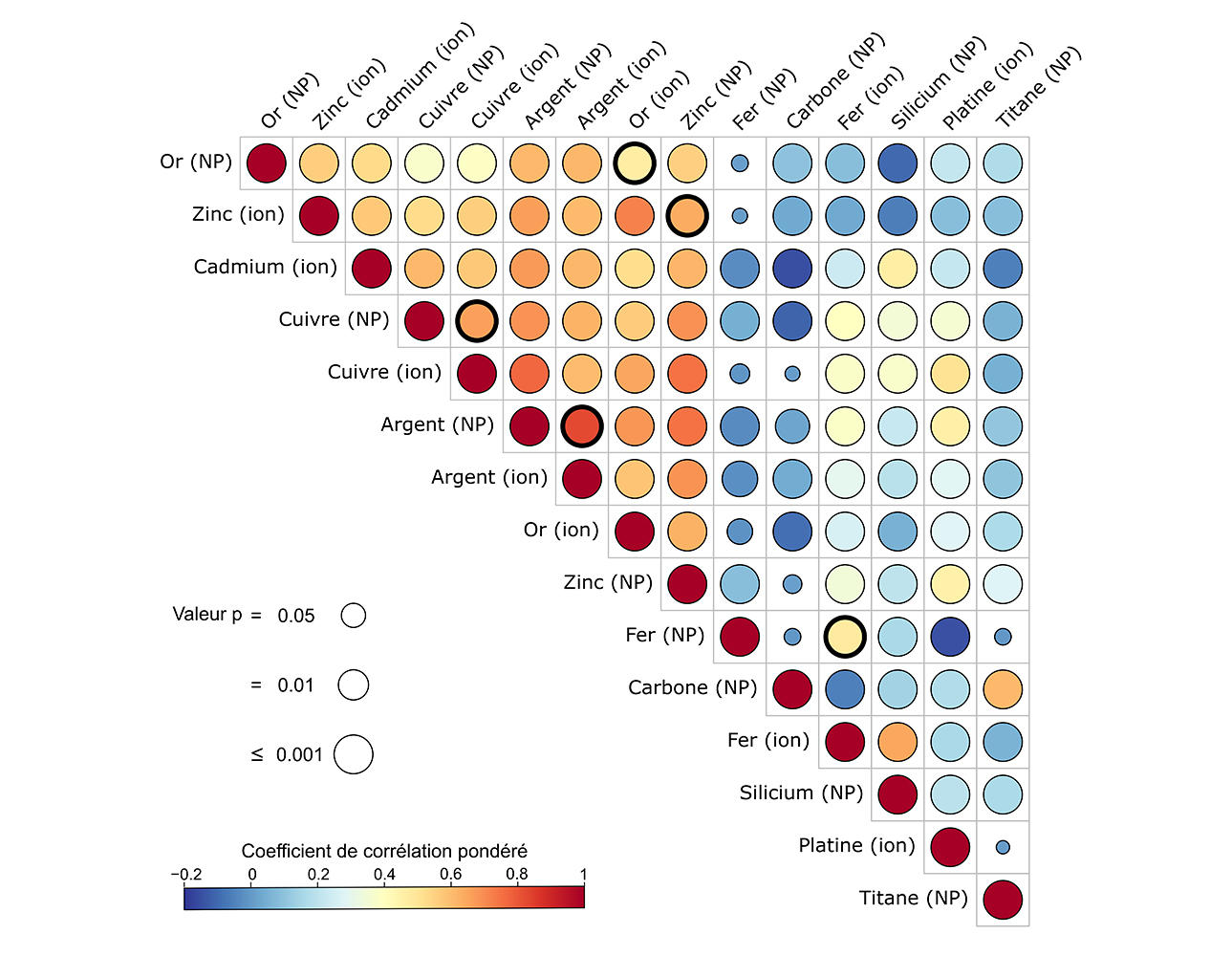
Mais ce n’est pas tout ! L’équipe a aussi observé que pour cinq des huit métaux étudiés (cadmium, cuivre, or, argent et zinc), les nanoparticules déclenchent des réactions biochimiques similaires au niveau des cellules. En effet, « pour les nanoparticules à base de ces cinq métaux, nous avons noté une surexpression d’un même ensemble de gènes, codant pour les protéines métallothionéines ; lesquelles jouent un rôle primordial dans la régulation des teneurs des cellules en métaux essentiels (cuivre, zinc...) et la détoxication des cellules des métaux non essentiels (argent, cadmium, or…) », détaille la biochimiste.
Pris ensemble, ces résultats indiquent, d’une part, que l’impact des nanoparticules métalliques au niveau cellulaire pourrait être prédit à partir de l’impact de leurs ions constitutifs, souvent mieux élucidé ; et d’autre part, que les métaux constituant les nanoparticules peuvent activer des gènes identiques. De quoi faciliter l’exploration de la toxicité des nanoparticules à l’avenir… ♦
- 1. 1 nm = 10-9 mètre = 0,000000001 mètre.
- 2. Disponible ici : https://www.anses.fr/fr/system/files/ERCA2016SA0226Ra.pdf
- 3. « Food-grade TiO2 impairs intestinal and systemic immune homeostasis, initiates preneoplastic lesions and promotes aberrant crypt development in the rat colon », Sarah Bettini et al., Scientific Report, Janvier 2017. DOI : 10.1038/srep40373.
- 4. « Copper-assisted oxidation of catechols into quinone derivatives », A.-C. Gómez-Herrero et al., Chemical Science, décembre 2020. DOI : 10.1039/D0SC04883F.
- 5. Rapport « Nanotechnologie – Nanoparticules : Quels dangers, quels risques ? ». Disponible ici : https://bit.ly/3VpaycQ.
- 6. Unité CNRS/université Paris Cité.
- 7. « Unexpected intracellular biodegradation and recrystallization of gold nanoparticles » Alice Balfourier et al., PNAS, 7 janvier 2020. Doi: 10.1073/pnas.1911734116. Epub 18 déc. 2019.
- 8. Unité CNRS/ENS/Sorbonne Université.
- 9. « Importance of Metal Biotransformation in Cell Response to Metallic Nanoparticles: A Transcriptomic Meta-analysis Study », Alice Balfourier, Anne-Pia Marty et Florence Gazeau, ACS Nanosci, 30 septembre 2022. doi.org/10.1021/acsnanoscienceau.2c00035.
Voir aussi
Auteur
Journaliste scientifique freelance depuis dix ans, Kheira Bettayeb est spécialiste des domaines suivants : médecine, biologie, neurosciences, zoologie, astronomie, physique et nouvelles technologies. Elle travaille notamment pour la presse magazine nationale.












