Vous êtes ici
De nouvelles stratégies contre la mucoviscidose
Avec 7 000 personnes atteintes en France1, la mucoviscidose est la plus fréquente des maladies rares. Cette maladie génétique d’évolution progressive se manifeste souvent tôt dans l’enfance, voire dès la naissance. Parmi les symptômes potentiellement graves : des atteintes respiratoires (infection et inflammation pulmonaires) et digestives (destruction progressive du pancréas). Depuis la généralisation du dépistage néonatal en 2002, un cas est décelé chez un nouveau-né tous les deux à trois jours… La cause de la maladie ? La mutation d’un gène, situé sur le chromosome 7, qui code pour la protéine CFTR (cystic fibrosis transmembrane conductance regulator). La maladie s’exprime chez un enfant quand les deux versions du gène – l’une provenant de la mère et l’autre du père – sont mutées ; on parle alors de transmission selon le mode autosomique récessif.
Une meilleure espérance de vie
« Ces 30 dernières années, la situation des malades s’est améliorée. Pour preuve : sur cette période, la proportion des patients de plus de 18 ans est passée de 20 à 54 % », témoigne Virginie Colomb-Jung, médecin et directrice du département médical de l’association Vaincre la mucoviscidose. Deux raisons expliquent cette évolution : d’une part, la mise en place de traitements symptomatiques très efficaces, comme la kinésithérapie respiratoire qui permet d’évacuer les sécrétions qui encombrent les poumons, ou la prescription d’enzymes digestives pour pallier la déficience pancréatique ; d’autre part, la prise en charge systématisée, dès le diagnostic, par les équipes spécialisées des centres de ressources et de compétences de la mucoviscidose (CRCM). Désormais, les personnes de plus de 18 ans atteintes de mucoviscidose poursuivent des études, mènent une vie professionnelle et peuvent dans certains cas fonder une famille.
Cependant, « cette progression de l’espérance de vie et de la qualité de vie des patients ne doit pas occulter la réalité de la maladie, tempère Virginie Colomb-Jung. Aujourd’hui encore, elle impose plusieurs heures de soins par jour, avec au moins une séance de kinésithérapie et d’aérosol d’antibiotiques, mais aussi la prise quotidienne de 30 à 40 comprimés ou gélules… » D’où les attentes fortes qui pèsent sur les stratégies thérapeutiques émergentes : des thérapies qui visent non plus les symptômes mais la cause même de la maladie – le gène muté et la protéine altérée qui en découle.
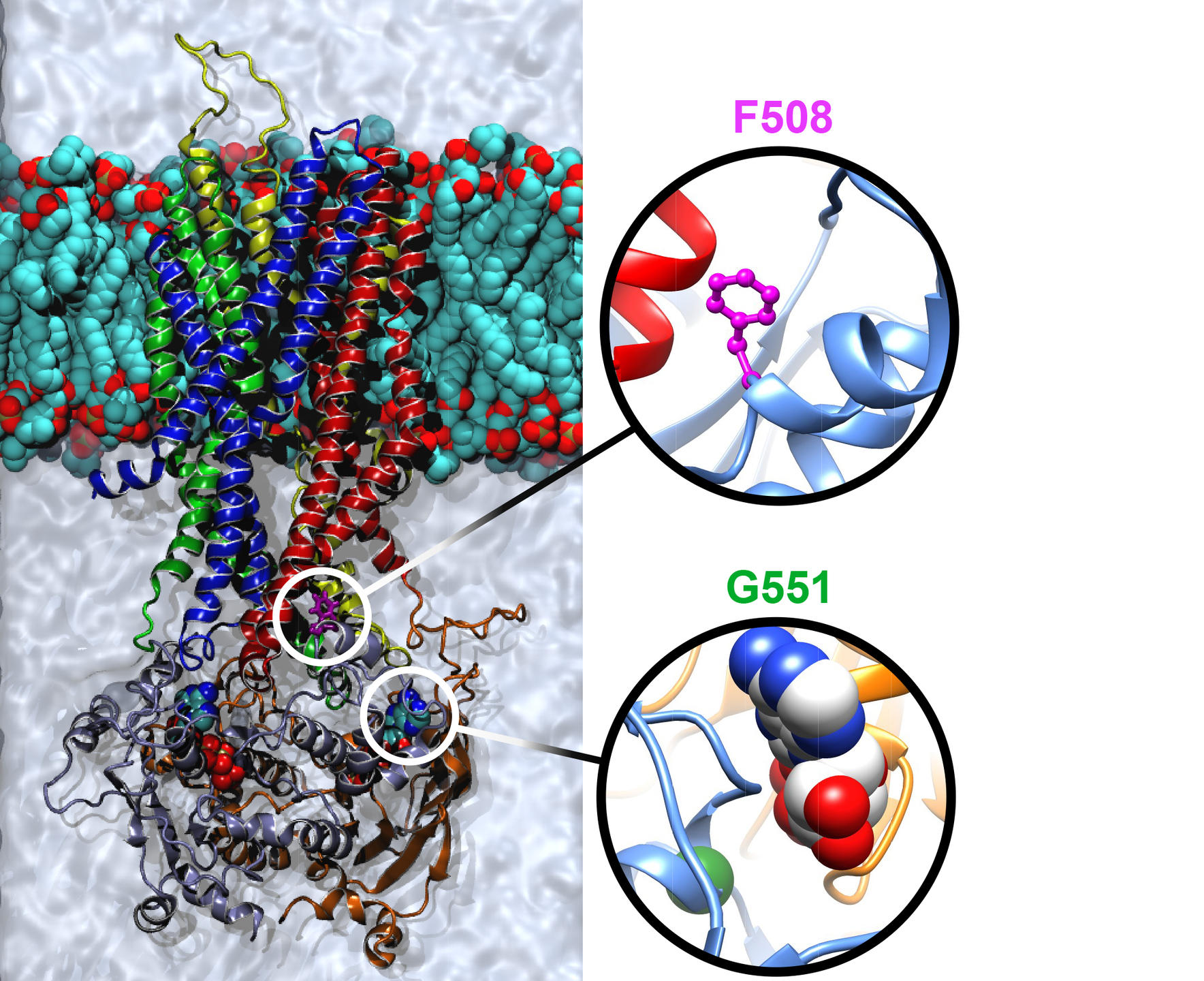
Logée dans la membrane des cellules épithéliales qui forment la muqueuse des poumons, du pancréas ou des glandes qui sécrètent la sueur, la protéine CFTR est un canal ionique. Son rôle : transporter les anions, comme le chlorure et le bicarbonate, et réguler leurs échanges entre l’intérieur et l’extérieur des cellules. Spécialisée dans l’étude de cette famille de protéines, l’équipe de Pascal Barbry, qui dirige l’Institut de pharmacologie moléculaire et cellulaire2 (IPMC), figure parmi les pionniers de l’exploration de la protéine CFTR. « Depuis le séquençage du gène CFTR en 1989, plus de 2 000 mutations ont été identifiées, avec des fréquences très variables. C’est là une des causes de la complexité de la maladie et de la diversité de ses manifestations : des mutations variées qui n’ont pas le même impact sur la protéine », précise le chercheur. Parmi les résultats marquants de l’équipe : la mise en évidence d’une activité résiduelle de la protéine issue de la mutation la plus fréquente DeltaF508 (80 % des cas), alors qu’on croyait la protéine totalement « morte ». Cette découverte a, dès lors, orienté les recherches pharmacologiques vers des traitements curatifs et non plus uniquement symptomatiques.
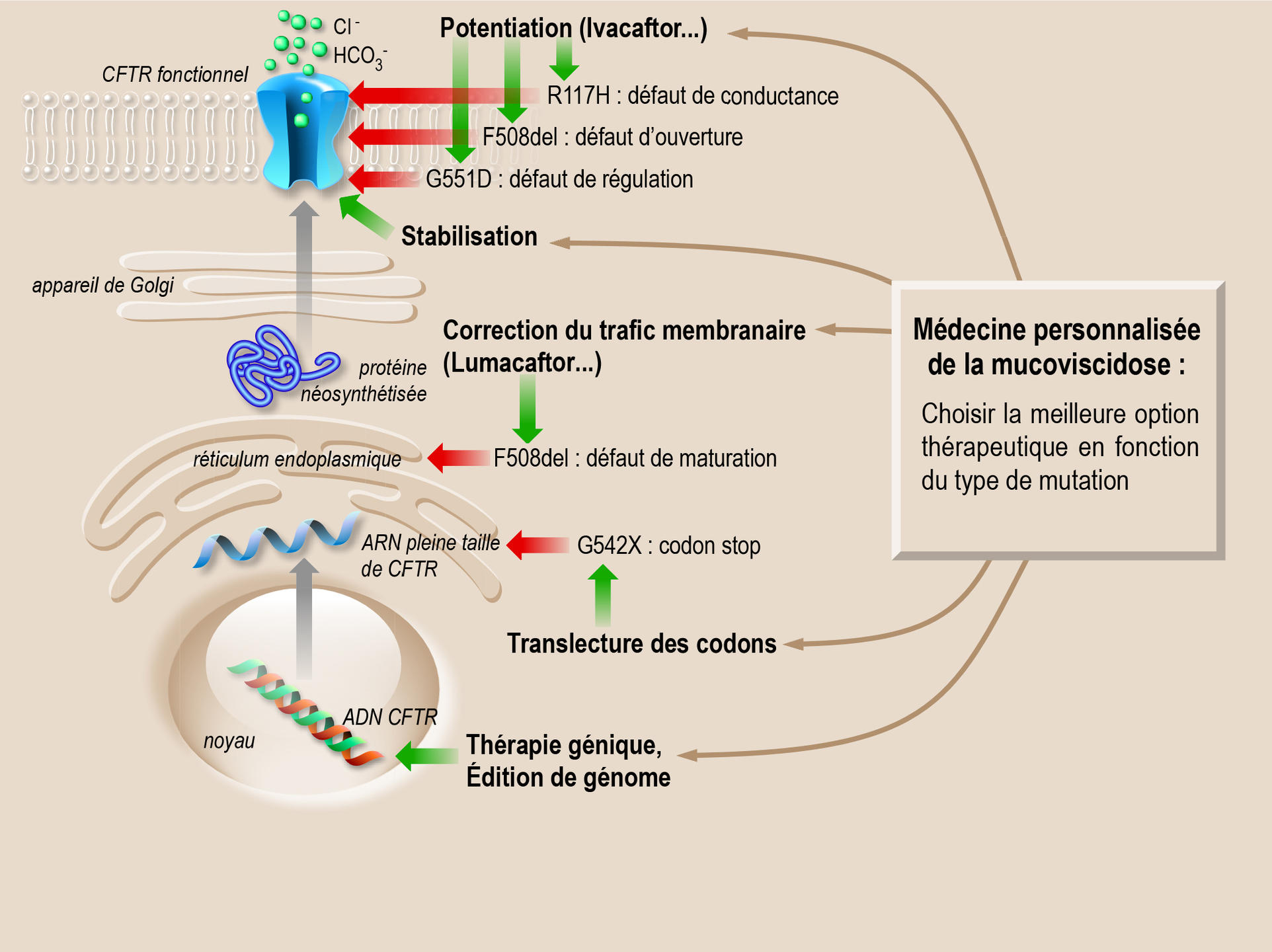
Corriger la fonction de la protéine CFTR
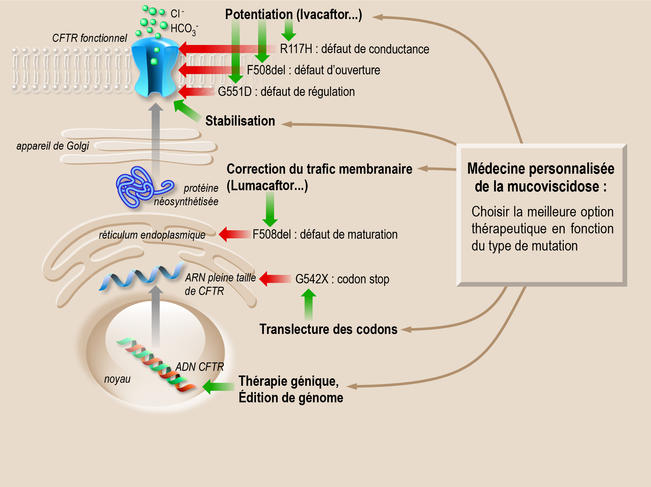
Sur les 2 000 mutations, près de 300 sont désormais bien caractérisées. Certaines entravent radicalement la production de la protéine. D’autres engendrent une protéine défectueuse qui présente soit une malformation (défaut de repliement) qui l’empêche de s’insérer correctement dans la membrane, soit une inactivation du mécanisme qui permet l’ouverture et la fermeture du canal. L’une des pistes thérapeutiques vise donc à isoler ou concevoir des molécules « chaperonnes » capables de guider la protéine jusqu’à son insertion dans la membrane (effet correcteur) ou de l’activer (effet potentiateur).
Par criblage haut débit3, plusieurs molécules d’intérêt ont été identifiées, à commencer par l’ivacaftor ou Kalydeco®, qui réactive le canal. Prescrit depuis 2014 en France, ce médicament améliore de façon flagrante les symptômes et en particulier la capacité respiratoire. Bémol : l’ivacaftor n’est efficace que pour certaines mutations, comme la mutation G551D. « Certes, cette molécule ne permet de traiter que 6 % de la population des malades, mais sa découverte a révolutionné l’approche thérapeutique de la mucoviscidose. Pour la première fois, il est possible d’agir directement sur la cause de la maladie », commente Pascal Barbry.
D’autres médicaments font l’objet d’essais cliniques, comme l’Orkambi® (phase 34) qui vise à corriger les deux défauts liés à la mutation DeltaF508 (la plus fréquemment rencontrée chez les malades), à savoir une mauvaise insertion membranaire et un canal peu actif. L’Orkambi® est une combinaison thérapeutique qui associe l’ivacaftor pour activer le canal et le lumacaftor pour améliorer le repliement de la protéine. Les résultats sont encourageants, même si l’efficacité s’avère variable selon les patients.
Ces travaux dessinent les contours d’une thérapie personnalisée de la mucoviscidose, accessible à moyen terme. « Il devient envisageable de proposer aux patients des molécules efficaces selon la mutation dont ils sont porteurs. De plus, pour une même mutation, on peut projeter de tester différentes molécules sur des tissus prélevés chez le patient (frottis de cellules nasales, par exemple) afin de cibler celle qui rétablit le mieux la fonction de la protéine CFTR », précise Isabelle Sermet, professeure et directrice de recherche à l’institut Necker-Enfants malades5.
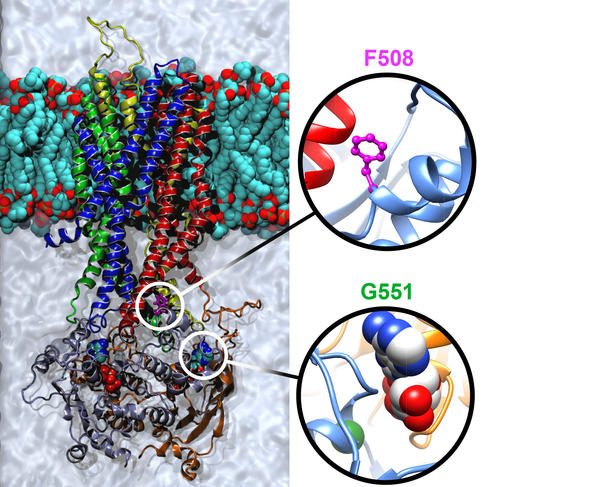
Le criblage haut débit a ainsi permis d’isoler plusieurs molécules d’intérêt. Mais cette technique « à l’aveugle » ne donne pas d’indication sur leur mode d’action. D’où l’intérêt d’une autre approche actuellement développée : partir de la structure de la protéine CFTR normale et de ses formes mutées pour décrypter les mécanismes d’action des modulateurs (correcteurs ou potentiateurs). C’est l’enjeu des travaux de l’équipe d’Isabelle Callebaut, directrice de recherche CNRS à l’Institut de minéralogie, de physique des matériaux et de cosmochimie6. Sa spécialité : analyser les séquences de protéines pour modéliser leurs caractéristiques structurale et fonctionnelle. « En 2015, nous avons achevé un modèle de simulation de la structure tridimensionnelle de la protéine CFTR qui décrit la position de ses 1480 acides aminés. Il s’avère être aujourd’hui le modèle le plus performant et le plus fidèle, tant à la dynamique de la protéine qu’aux données obtenues expérimentalement », explique la chercheuse. À l’aide de cet outil, les chercheurs peuvent étudier l’impact des différentes mutations génétiques sur la structure de la protéine, ses mécanismes de repliement et ses diverses conformations (ouverture/fermeture du canal). Et, dès lors, essayer de concevoir de façon rationnelle des stratégies thérapeutiques spécifiques à chaque mutation et à chaque défaut protéique. D’ores et déjà initiés pour créer des modulateurs ciblant la mutation DeltaF508, ces travaux contribueront au développement d’une médecine de précision, adaptée au profil de chaque patient.
La piste génétique toujours d’actualité
Pour la communauté investie dans l’étude de la mucoviscidose, la thérapie génique est apparue dès les années 2000 comme une des pistes à explorer. Son principe : introduire, à l’aide d’un vecteur viral, une version normale du gène dans les cellules pulmonaires malades où elle pallierait la déficience du gène. Malgré l’engouement des débuts, les essais se sont avérés décevants, jusqu’au dernier en date, mené par un consortium britannique, qui misait sur l’utilisation originale de vecteurs synthétiques.
Désormais, les regards se portent sur les lentivirusFermergenre de virus de la famille des rétrovirus, caractérisés par une incubation lente et l’élimination des cellules contaminées (les VIH en font partie) qui pourraient se révéler des vecteurs efficaces. Mais, précise Pascal Barbry, « cibler spécifiquement les cellules respiratoires, corriger le génome de cellules qui se divisent peu ou franchir la barrière du mucus restent des verrous majeurs pour concrétiser les approches de thérapie génique. Ces mêmes verrous devront aussi être levés pour permettre le développement des techniques utilisant les enzymes CRISPR, récemment découvertes, capables de découper de façon ciblée des séquences de l’ADN. »
L’apparition de codons-stop, une mutation à part
Autre challenge important pour les chercheurs : cibler les codons-stop, ces signaux normalement situés à la terminaison du gène et qui marquent la fin du processus de fabrication d’une protéine. Certaines mutations du gène CFTR conduisent en effet à l’apparition de ces codons-stop au milieu du gène, ce qui fait avorter la synthèse de la protéine. Des molécules visant à corriger ces anomalies sont actuellement testées dans le cadre d’essais cliniques. Les enjeux de ces travaux sont considérables, tant du point de vue fondamental que thérapeutique. « Même si le chemin à parcourir est encore long, l’aboutissement d’une telle stratégie permettrait non seulement de traiter les patients atteints de mucoviscidose porteurs de ce type de mutation, mais aussi tous ceux qui sont concernés par les autres maladies génétiques impliquant des codons-stop, comme les myopathies », déclare Isabelle Sermet.

De gros efforts sont ainsi produits pour contrer l’origine de la mucoviscidose, mais la recherche se poursuit aussi sur les traitements symptomatiques. Dans le viseur notamment : l’infection et l’inflammation pulmonaires, qui restent les causes majeures de mortalité. De nouvelles approches d’antibiothérapie sont étudiées, notamment par des laboratoires du CNRS, afin de lutter contre diverses souches bactériennes comme Pseudomonas aeruginosa, particulièrement difficiles à éradiquer chez ces malades. D’autres travaux visent l'inflammation. Ainsi, la roscovitine, une molécule découverte par l’équipe de Laurent Meijer7 à partir d’œufs d’étoiles de mer, est actuellement évaluée dans le cadre d’un essai clinique de phase 2, chez des patients atteints de mucoviscidose.
Grâce au soutien des associations de patients et en particulier Vaincre la Mucoviscidose, la recherche foisonne. Des travaux fondamentaux aux études cliniques les plus avancées, des stratégies thérapeutiques émergent, préfigurant une médecine de plus en plus personnalisée répondant à la grande diversité d’expression de la maladie. Tous les espoirs sont donc permis…
- 1. La mucoviscidose touche 70 000 personnes dans le monde.
- 2. Unité CNRS/Univ. de Nice Sophia-Antipolis.
- 3. La technique consiste à tester des milliers de molécules sur des échantillons cellulaires et à isoler celles qui sont les plus efficaces pour améliorer la fonction de la protéine CFTR.
- 4. Les essais cliniques de phase 1 et 2 correspondent à la première administration du médicament chez l’homme puis chez les patients ; les essais de phase 3 évaluent ensuite l’efficacité du médicament sur un plus grand nombre de patients.
- 5. Centre de médecine moléculaire (Unité CNRS/Univ. Paris Descartes/Inserm).
- 6. Unité CNRS/UPMC/IRD/MNHN.
- 7. Chercheur à la Station biologique de Roscoff (Unité CNRS/UPMC) et cofondateur de la start-up ManRos Therapeutics.
Voir aussi
Auteur
Rédactrice scientifique depuis plus de dix ans, Stéphanie Belaud s’est notamment spécialisée dans les domaines de la biologie, de la médecine et de l’environnement.