Vous êtes ici
L’épigénétique mène le génome à la baguette
Depuis une petite dizaine d’années, l’épigénétique a le vent en poupe. Cette branche de la biologie s’intéresse aux mécanismes moléculaires capables de réguler l’expression des gènes sans pour autant modifier la séquence nucléotidique dont ils découlent. Parce qu’elle ne modifie pas la partition du code génétique mais la manière dont celle-ci sera lue, l’épigénétique tient en quelque sorte le rôle de chef d’orchestre du génome. Aussi surprenant que cela puisse paraître, l’identification des tout premiers facteurs de régulation épigénétique, les protéines appartenant au groupe Polycomb, a précédé celle de la structure en double hélice de l’ADN. Leur mise en évidence par la biologiste américaine Pamela Lewis remonte en effet à 19471. C’est en examinant les mutations dominantes chez la mouche drosophile que la scientifique découvre, presque par hasard, les gènes codant ces complexes protéiques. En s’appuyant sur les travaux précurseurs de son épouse, le célèbre généticien Edward Lewis2 montre ensuite, vers la fin des années 1970, que les protéines Polycomb limitent l’expression de gènes impliqués dans le plan d’organisation des êtres vivants. Dans les années qui suivent, d’autres travaux menés chez la drosophile révéleront l’existence des protéines Trithorax, dont le mode d’action est opposé à celui des protéines Polycomb3.
La biochimie à la rescousse de la génétique
Malgré des premiers résultats prometteurs, l’étude de ces facteurs de régulation épigénétique va ensuite être quelque peu délaissée par la recherche scientifique durant plusieurs décennies. Il faudra attendre le tournant des années 2000 pour identifier avec précision leur mode de fonctionnement. Grâces aux progrès de la biochimie, on découvre alors que la structure et la fonction des protéines Polycomb et Trithorax ont été conservées au fil de l’évolution depuis les plantes jusqu’aux animaux en passant par les champignons. « En s’immisçant dans le champ de la génétique, la biochimie va permettre de caractériser ces complexes protéiques sur le plan moléculaire et comprendre ainsi qu’ils interviennent dans les modifications épigénétiques des queues d’histones, ces protéines autour desquelles l’ADN vient s’enrouler pour être compacté à l’intérieur du noyau de la cellule », rappelle Andrew Saurin, chercheur à l’Institut de biologie du développement de Marseille (IBDM)4 où il dirige sa propre équipe scientifique. Ces mécanismes de régulation, qui s’apparentent à de simples modifications chimiques de la chromatineFermerSubstance de base des chromosomes constituée de la molécule d’ADN à laquelle sont associés de l’ARN et des protéines., vont d’abord être identifiés au niveau des gènes homéotiques. Qualifiés parfois de gènes architectes, ceux-ci veillent au bon agencement des organes les uns par rapport aux autres tout au long du développement de la plupart des animaux. Dans ce contexte, les protéines Polycomb sont plus particulièrement chargées d’empêcher l’expression des gènes homéotiques, tandis que les protéines Trithorax les activent dans certains types de cellules lorsque cela s’avère nécessaire à la croissance de l’individu.
Une forme de régulation anti-tumorale
« La principale fonction de ces deux complexes moléculaires est de maintenir la mémoire des états de régulation des gènes à travers les divisions cellulaires depuis le stade embryonnaire jusqu’à l’organisme adulte », détaille Giacomo Cavalli, directeur de recherche à l’Institut de génétique humaine5 à Montpellier. Dans son laboratoire, ce biologiste moléculaire s’évertue depuis plusieurs années à percer les subtils modes de fonctionnement des facteurs de régulation épigénétique. En mettant à profit une méthode innovante de séquençage à très haut débit, Giacomo Cavalli et ses collègues ont réussi à cartographier avec une très grande précision l’organisation tridimensionnelle de la totalité des chromosomes de la mouche drosophile. Par la suite, ils ont découvert que cette structure en trois dimensions peut être transmise de génération en génération, contribuant ainsi au maintien de la régulation épigénétique du génome6. Plus récemment, l’équipe est parvenue à mettre en évidence chez ce même organisme modèle la fonction anti-tumorale d’un complexe protéique de la famille des Polycomb7. « En se fixant de manière spécifique à des centaines de gènes impliqués dans la formation de tumeurs, comme les gènes assurant le contrôle de la prolifération cellulaire, cette combinaison de protéines parvient à réguler leur action, tant du point temporel que spatial, explique le chercheur. Nous avons en outre pu observer une forme de régulation anti-tumorale similaire dans des lignées de cellules humaines en culture. »
Maillon essentiel de divers mécanismes
À l’instar de ces résultats, les études scientifiques témoignant du rôle clé des protéines Polycomb au-delà des simples processus développementaux, se sont multipliées ces dernières années : plasticité et renouvellement des cellules souches, détermination du destin cellulaire, inactivation du chromosome X... Ce dernier mécanisme de régulation constitue le sujet de recherche de prédilection d’Edith Heard, professeure au Collège de France où elle occupe la chaire « épigénétique et mémoire cellulaire ». Dans ce domaine, les travaux de la généticienne ont contribué à mieux comprendre comment, chez les femelles de mammifères, l’une des copies du chromosome X provenant soit du père soit de la mère, est inactivée de façon aléatoire dans chaque cellule au cours de l’embryogenèseFermerChez l’animal, l’embryogenèse correspond à la phase de développement de l’organisme, depuis la fécondation jusqu’à sa naissance.. Ce solide modèle d’étude des mécanismes de régulation épigénétique que constitue l’inactivation du chromosome X a notamment permis d’établir de nouvelles règles d’interactions entre les protéines Polycomb et la chromatine. « Dans le cas de certains cancers, il semblerait que l’association étroite entre le chromosome X inactif et les facteurs de régulation Polycomb est perturbée, ces derniers se retrouvant alors dispersés dans toute la cellule », illustre Edith Heard qui dirige par ailleurs l’unité Génétique et biologie du développement8 à l’Institut Curie. Au sein de ce laboratoire, la scientifique et son équipe poursuivent leurs investigations autour de l’inactivation du chromosome X. Comme d’autres groupes de chercheurs de l’Institut Curie collaborant étroitement avec des cliniciens, ils espèrent déterminer les principales formes de dérégulations épigénétiques qui se produisent lors des cancers, dans l’espoir de faire le lien avec les mutations génétiques qui les accompagnent.
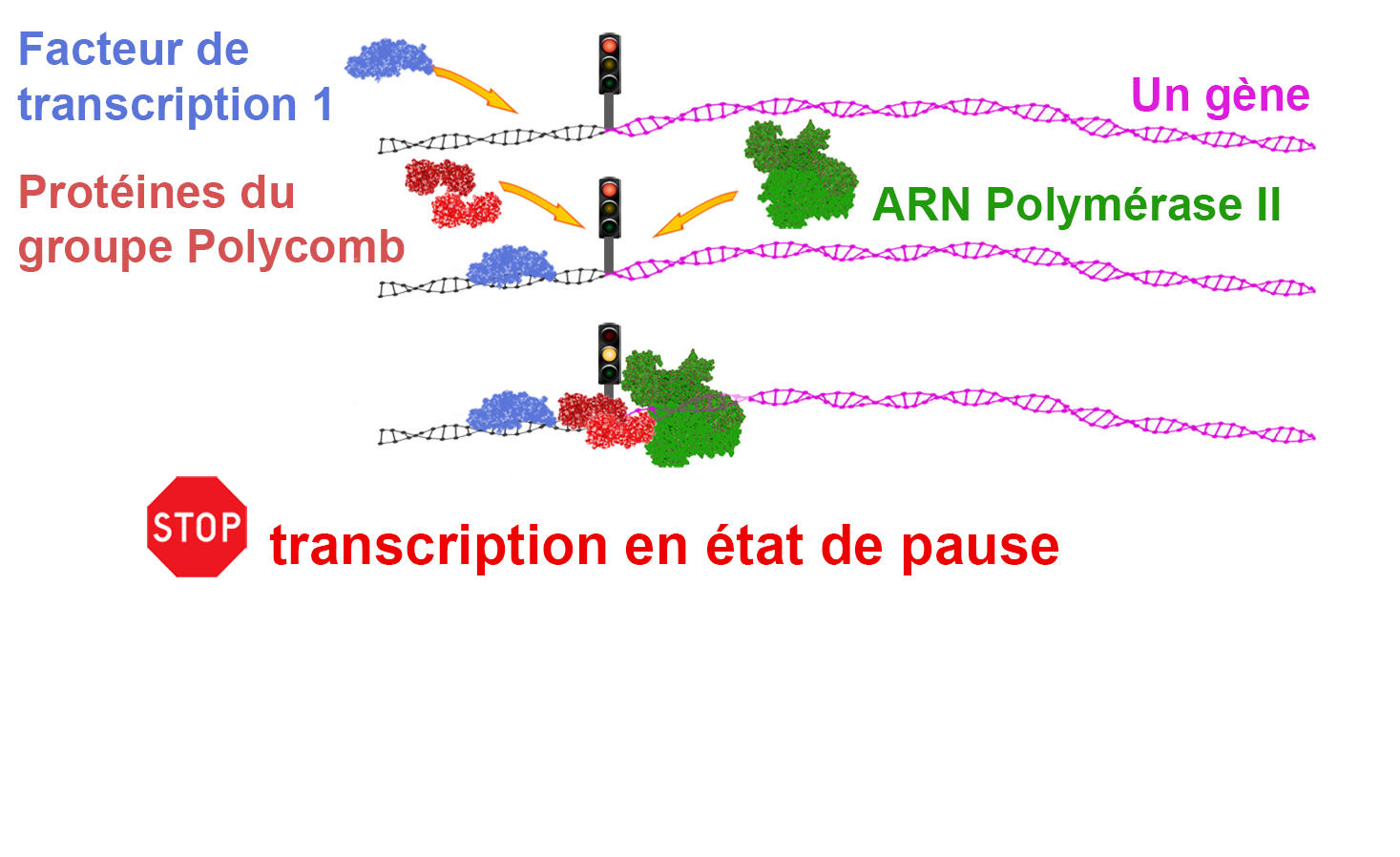
Deux tiers des gènes sous influence
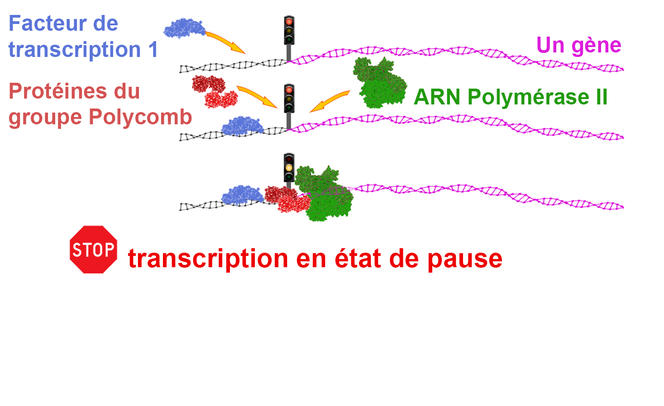
Dans un tout autre registre, les protéines Polycomb apparaissent aujourd’hui comme des leviers essentiels du contrôle de la transcriptionFermerLa transcription est le processus correspondant à la synthèse d’ARN à partir de l’ADN de la cellule. d’un très grand nombre de gènes. Ces formes de régulations originales, dont on ignorait l’existence il y a encore 15 ans, font désormais l’objet de publications régulières, à l’image des travaux menés par l’équipe d’Andrew Saurin à l’IBDM. Dans une étude publiée en 20179, ces chercheurs ont montré que certaines unités protéiques du groupe Polycomb étaient en mesure d’empêcher l’action de la polyméraseFermerComplexe enzymatique qui intervient dans la transcription de l’ADN en ARN. en se fixant au niveau des séquences promotrices, ces régions de l’ADN situées à proximité des gènes indispensables à la transcription de l’ADN en ARN. « Dans l’état actuel des connaissances scientifiques, on estime que cette forme de régulation de l’expression génétique à laquelle participe Polycomb concerne près de deux tiers des 20 000 gènes de notre génome », souligne Andrew Saurin. Parmi eux figurent notamment des gènes métaboliques dont la dérégulation de l’expression est connue pour aboutir à l’apparition de cancers. « Si la répression stable et héritable des gènes homéotiques par Polycomb est essentielle puisqu’elle détermine le plan d’organisation des individus tout au long de leur vie, elle n’en demeure pas moins un cas spécifique, constate le chercheur de l’IBDM. C’est donc dans le contexte plus général de la régulation de la transcription, où le rôle de Polycomb reste peu exploré, que réside sans doute les principaux modes d’action de ces protéines, notamment dans le domaine de la cancérogenèse. »
Espoirs thérapeutiques
À la différence des mutations génétiques qui affectent directement notre génome, les marques épigénétiques se traduisent par de simples modifications chimiques de l’ADN ou des protéines qui lui sont associées au sein de la chromatine. De telles marques n’altérant en rien la séquence de nucléotides, elles doivent donc pouvoir être modifiées sans empêcher le gène concerné de s’exprimer correctement, soulevant ainsi de nouveaux espoirs pour le traitement de certaines maladies. « Bien que de nombreuses aberrations épigénétiques ont pu être mise en évidence dans différentes formes de cancers, leurs rôles respectifs restent encore mal compris», tempère Edith Heard. Des scientifiques supposent malgré tout que ces anomalies pourraient engendrer l’inactivation de gènes suppresseurs de tumeurs ou, à l’inverse, l’activation d’oncogènes, ces gènes dont la surexpression favorise le développement de cancers. « Dans le cas de Polycomb, la possibilité de neutraliser le site actif de la protéine responsable de son action négative ouvre la voie à de nouvelles formes de traitements thérapeutiques, assure Giacomo Cavalli. Des molécules testées dans le cadre d’essais cliniques ont d’ailleurs donné des résultats encourageants pour le traitement de tumeurs circulantes comme les lymphomes ainsi que pour certaines tumeurs solides. » Mais, alors qu’une stratégie de ce type semble avoir un effet bénéfique sur l’évolution de plusieurs formes de cancers, elle peut aussi se révéler totalement inefficace, comme l’a démontré une étude menée par des chercheurs de l’Institut Curie10. Si la perspective de soigner un large éventail de pathologies à l’aide de molécules ciblant les mécanismes épigénétiques paraît séduisante à première vue, il ne s’agit donc encore que d’un vœu pieux tant le mode d’action de ces formes de traitement et leurs conséquences pour les futurs patients demeurent encore largement méconnus. ♦
Sur le même sujet : Edith Heard ou la révolution épigénétique
- 1. James Watson et Francis Crick établirent la structure en double hélice de l’ADN en 1953.
- 2. Edward Lewis est colauréat du prix Nobel de médecine 1995 pour ses travaux sur le contrôle génétique du développement précoce de l’embryon.
- 3. « Genome Regulation by Polycomb and Trithoilrax: 70 Years and Counting », B. Schuettengruber et al., Cell, publié en ligne le 21 septembre 2017. Doi: 10.1016/j.cell.2017.08.002
- 4. Unité CNRS/Aix Marseille Université.
- 5. Unité CNRS/Université de Montpellier.
- 6. « Stable Polycomb-dependent transgenerational inheritance of chromatin states in Drosophila », F. Ciabrelli et al., Nature Genetics, publié en ligne le 24 avril 2017. Doi :10.1038/ng.3848
- 7. « Massive Coordinate redeployment of PRC1 proteins suppresses tumor formation during Drosophila development », V. Loubière et al., Nature Genetics, publié en ligne le 19 septembre 2016. Doi:10.1038/ng.3671
- 8. Unité CNRS/Institut Curie/ Inserm /Université Pierre et Marie Curie.
- 9. « The Hox proteins Ubx and AbdA collaborate with the transcription pausing factor M1BP to regulate gene transcription », A. Zouaz et al., EMBO Journal, publié en ligne le 4 septembre 2017. Doi: 10.15252/embj.201695751
- 10. « Uveal melanoma cells are resistant to EZH2 inhibition regardless of BAP1 status », M. Schoumacher et al, Nature Medecine, publié en ligne le 7 juin 2016. Doi: 10.1038/nm.4098
Voir aussi
Auteur
Grégory Fléchet est né à Saint-Étienne en 1979. Après des études de biologie suivies d’un master de journalisme scientifique, il s’intéresse plus particulièrement aux questions d’écologie, d’environnement et de santé.