A la une
En première ligne face au changement climatique, les plantes capturent le carbone atmosphérique grâce à de minuscules orifices sur leurs feuilles : les stomates. L’ouverture de ces pores, régie par une mécanique cellulaire complexe, est au cœur des recherches du projet NetFlux. En s’intéressant à la coordination des flux d’ions dans les cellules de garde, les chercheurs ont levé une part du voile sur ce processus fondamental.
 Plants d’Arabidospsis thaliana, espèce couramment utilisée en physiologie végétale comme modèle, y compris dans le cadre du projet NetFlux © Alexis De Angeli
Plants d’Arabidospsis thaliana, espèce couramment utilisée en physiologie végétale comme modèle, y compris dans le cadre du projet NetFlux © Alexis De Angeli
Les ions sont des atomes ou molécules chargés, dont la circulation entre les différents compartiments cellulaires intervient dans de nombreux processus physiologiques. Un exemple emblématique est la régulation stomatique, qui dépend de déplacements d’ions entre l’extérieur, le cytoplasme et la vacuole des cellules de garde, lesquelles délimitent et forment le stomate. Ces flux causent un déséquilibre osmotique en créant une différence de concentrations d’ions entre chaque compartiment, finalement compensée par l’entrée d’eau dans la vacuole, qui gonfle alors et entraîne l’ouverture du stomate.
Un système bien huilé, grâce auquel la plante contrôle ses échanges gazeux et minimise ses pertes d’eau. Mais qui orchestre ce réseau d’ions, et comment ? L’équipe du projet NetFlux1, dirigé par Alexis De Angeli2, Nathalie Leonhardt3 et Christophe Godin4, s’est plongée dans l’étude méticuleuse de cette question.
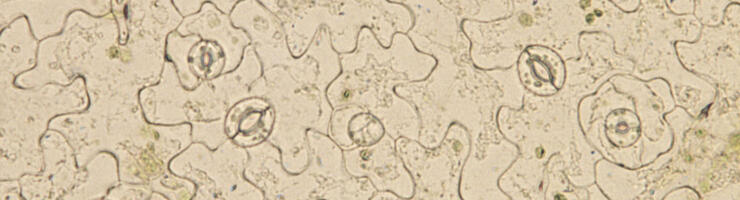
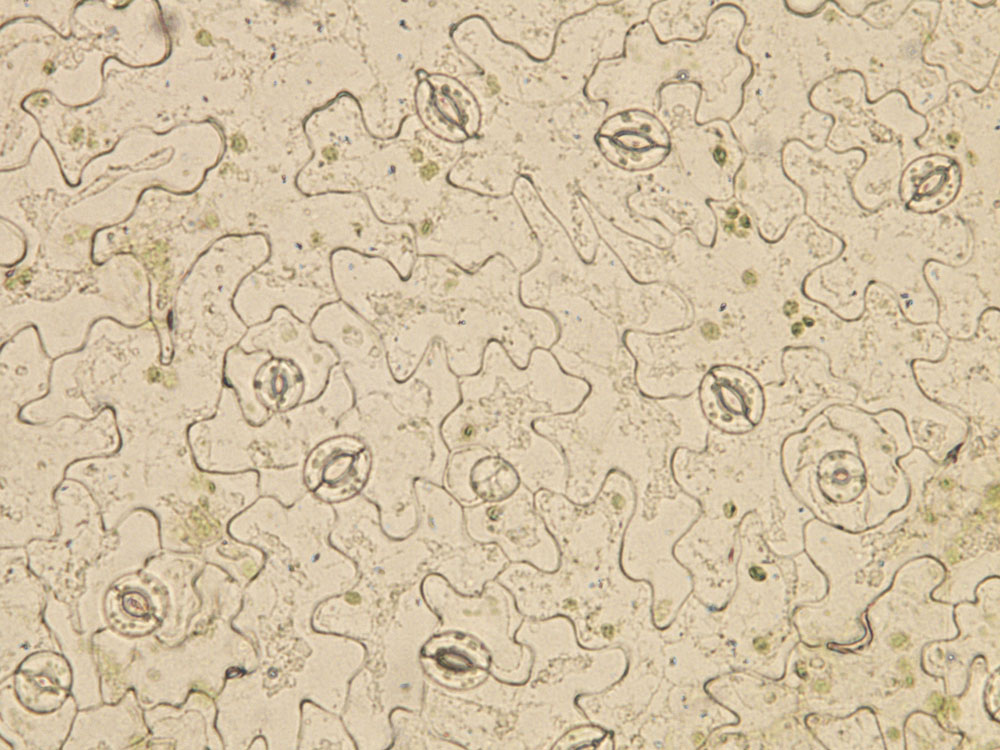 Épiderme de feuille d’Arabidospsis thaliana, avec plusieurs stomates visibles à sa surface. © Alexis De Angeli
Épiderme de feuille d’Arabidospsis thaliana, avec plusieurs stomates visibles à sa surface. © Alexis De Angeli
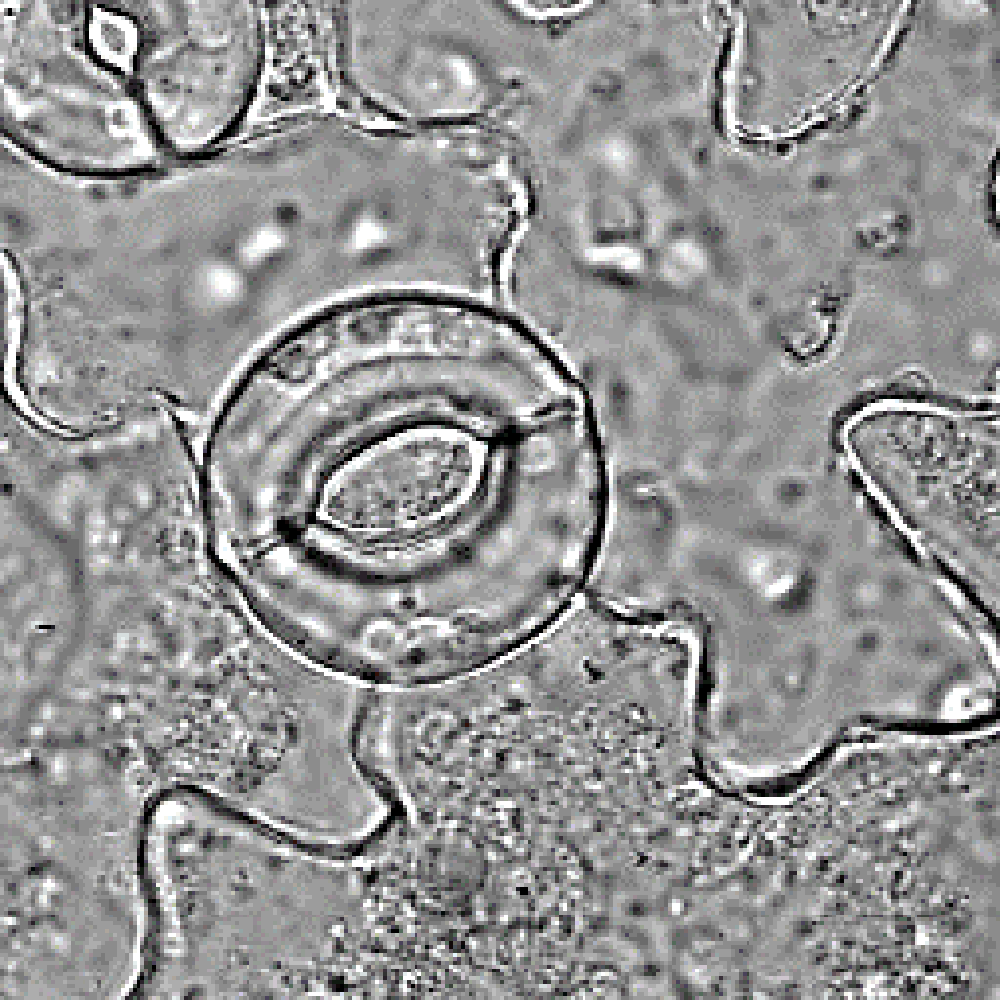 Zoom sur un stomate chez Arabidospsis thaliana, montrant les deux cellules de garde entourant le pore du stomate. © Alexis De Angeli
Zoom sur un stomate chez Arabidospsis thaliana, montrant les deux cellules de garde entourant le pore du stomate. © Alexis De Angeli
De la paillasse à l’ordinateur
L’expérimental ne suffit pas toujours pour obtenir certaines réponses, aussi la biologie a-t-elle parfois recours aux simulations numériques qui, d’après Alexis De Angeli, apportent un éclairage nouveau : « L’intérêt peut être de synthétiser des données expérimentales d‘horizons différents dans un modèle, pour étudier des phénomènes difficiles à saisir avec les outils actuels. » Des équipes ont donc déjà cherché à coder une cellule de garde artificielle pour décortiquer la régulation stomatique, résultant en des modèles très complexes.
Le projet NetFlux a opté pour une stratégie différente : « Plutôt que de modéliser tous les composants cellulaires, on a représenté les forces en jeu dans un système à deux membranes, représentant celles de la cellule et de sa vacuole, pour voir comment des perturbations font passer d’un état A à un état B. ». La force du modèle est double : générique et modulaire, il permettra d’ajouter de nouvelles briques aux côtés des forces chimique, électrostatique et mécanique considérées ici.
Les simulations ont dévoilé un effet de levier : un transfert minime de protons à travers la membrane déclenche une cascade de flux d’ions, qui résolvent et perturbent successivement différents équilibres, jusqu’au rétablissement de l’équilibre osmotique par l’entrée massive d’eau dans la vacuole : « Cela génère une pression dans la cellule équivalente à celle d’un pneu de camion ! ». Un impact considérable par rapport aux quelques protons initialement déplacés, qui s’expliquerait par la hiérarchie des forces suggérée par les simulations : « C’est quelque chose qui m’avait toujours intrigué : pourquoi les cellules végétales utilisent-elles le proton, présent qu’en quelques milliers d’exemplaires, comme moteur pour déplacer d’autres molécules par centaines de milliers ? On a maintenant une hypothèse à tester expérimentalement. »
Les canaux ALMT, gardiens de l’équilibre ionique
Pour aller plus loin, les chercheurs ont pointé leur microscope sur les membranes pour faire plus ample connaissance avec des molécules clés des flux d’ions : les protéines de transport. Ils ont notamment étudié la famille des Aluminum-activated malate transporters (ALMT), des canaux ioniques régulant l’entrée des ions dans la vacuole.
Ils ont découvert que le canal ALMT-5 intervient dans la gestion de l’équilibre entre deux ions issus de la fixation du CO2, le malate et le fumarate, en transportant ce dernier dans la vacuole : « La perturbation de cet équilibre, provoquée par la suppression d’ALMT-5, engendre jusqu’à 90 % de perte de biomasse. On aurait ainsi mis la main sur un système régulant l’assimilation du CO2 en molécules organiques. »
Son cousin, ALMT-9, transporte le malate dans la vacuole, et permet aussi le passage de l’ion chlorure, pourtant bien différent. Pour comprendre cette capacité, l’équipe a étudié sa structure moléculaire, en collaboration avec une équipe sud-coréenne5 : « C’est désormais l’un des rares canaux vacuolaires chez la plante pour lequel on a une structure 3D ! ». Ils ont ensuite recouru aux mathématiques pour résoudre la question du co-transport malate/chlorure en modélisant les dynamiques moléculaires : « Pour cela, on fournit à un logiciel les coordonnées des atomes du canal, on génère une membrane dans laquelle on l’insère, on ajoute de l’eau et des ions, puis on fixe une température, pour observer l’évolution du système. »
Ils ont ainsi compris comment ALMT-9 transporte ces ions, et montré qu’une faible concentration de malate facilite le passage du chlorure. En étudiant ce canal, ils ont aussi fait une découverte étonnante : les lipides influencent son ouverture en y pénétrant par des fentes latérales. Ce phénomène bouscule la vision classique des membranes : « On les voyait jusqu’alors comme des lipides imperméables aux molécules chargées, dans lesquels nageaient les protéines de transport. On pensait donc qu’il n’y avait pas de lipides dans ces protéines, puisque les molécules chargées y passent. »
De la recherche fondamentale aux nouvelles pratiques agronomiques
Pour la suite, l’équipe dispose d’une série de mutants à étudier, générés pendant le projet en ciblant des protéines du transport membranaire avec les ciseaux génétiques CRISPR-Cas96. Sur d’autres plantes, ils ont aussi provoqué des mutations au hasard pour réaliser un criblage génétique : « On voulait repérer des mutants où l’équilibre ionique aurait été perturbé, grâce à un biosenseur fluorescent. Ça nous a permis d’identifier deux canaux ioniques importants pour la régulation stomatique. »
Mieux connaître les protéines de la coordination des flux d’ions dans les cellules de garde ouvrira de nouvelles voies en agronomie : « Ce sont des perspectives à très long terme, mais on pourra par exemple sélectionner des variants génétiques naturellement présents, conférant un phénotype intéressant. Une autre piste serait d’utiliser les structures connues des molécules clés, pour introduire des peptides qui les réguleraient sur demande. » Ce dernier axe sera étudié dès ces prochaines années, en poursuivant la collaboration avec l’équipe sud-coréenne.
Une optique réjouissante, car une telle régulation contribuerait sur plusieurs fronts à une agriculture plus durable : limiter le stress hydrique en contrôlant les stomates, promouvoir l’absorption du CO2, booster la production de biomasse… Autant d’applications, certes encore lointaines, mais porteuses d’espoir face aux enjeux du changement climatique.
-------------------------------------------------------------------------------------------------------------------
Ces recherches ont été financées en tout ou partie, par l’Agence Nationale de la Recherche (ANR) au titre de l'ANR NetFlux - AAPG2021. Cette communication est réalisée et financée dans le cadre de l’appel à projet Science Avec et Pour la Société - Culture Scientifique Technique et Industrielle pour les projets JCJC et PRC des appels à projets génériques 2021 (SAPS-CSTI JCJC et PRC AAPG 21).
- 1. NetFlux - Comprendre le réseau de flux d'ions dans la cellule de garde d'Ararbidopsis pour le contrôle des échanges gazeux https://anr.fr/Projet-ANR-21-CE13-0039
- 2. Directeur de recherche CNRS, à l’Institut des Sciences des Plantes de Montpellier (IPSiM - Unité CNRS / INRAE / Université de Montpellier)
- 3. Directrice de recherche à l'Institut biosciences et biotechnologie d'Aix-Marseille (BIAM - Unité Aix-Marseille Université, CEA, CNRS)
- 4. Directeur de recherche INRIA au laboratoire Reproduction et développement des plantes (RDP - Unité CNRS / ENS Lyon / INRAE)
- 5. Collaboration avec le Prof. Sangho Lee, de la SKK University en Corée du Sud
- 6. CRISPR-Cas9 (Clustered Regularly Interspaced Short Palindromic Repeats – Cas9) est un outil de manipulation génétique, qui permet de cibler une séquence spécifique de l’ADN pour y introduire des modifications



