A la une

Quel est le point commun entre rattraper une balle de tennis lancée à vive allure, synchroniser nos dix doigts au piano, ou maintenir notre équilibre sur une surface instable ? Tous ces exploits impliquent le cervelet, et plus précisément sa remarquable capacité à contrôler nos actions et gérer le temps. Dans son laboratoire, à Strasbourg, Philippe Isope explore les secrets de ce « petit cerveau » qui synchronise notre corps et notre esprit à la milliseconde près. Véritable maître du temps, il s’avère indispensable à bien de nos fonctions motrices et cognitives.
Si le rôle du cervelet dans la coordination motrice est connu de longue date – il fut même longtemps cantonné à cette unique fonction –, les neurosciences révèlent aujourd’hui une dimension plus fondamentale et surprenante : ce « petit cerveau » est avant tout un calculateur temporel exceptionnel.
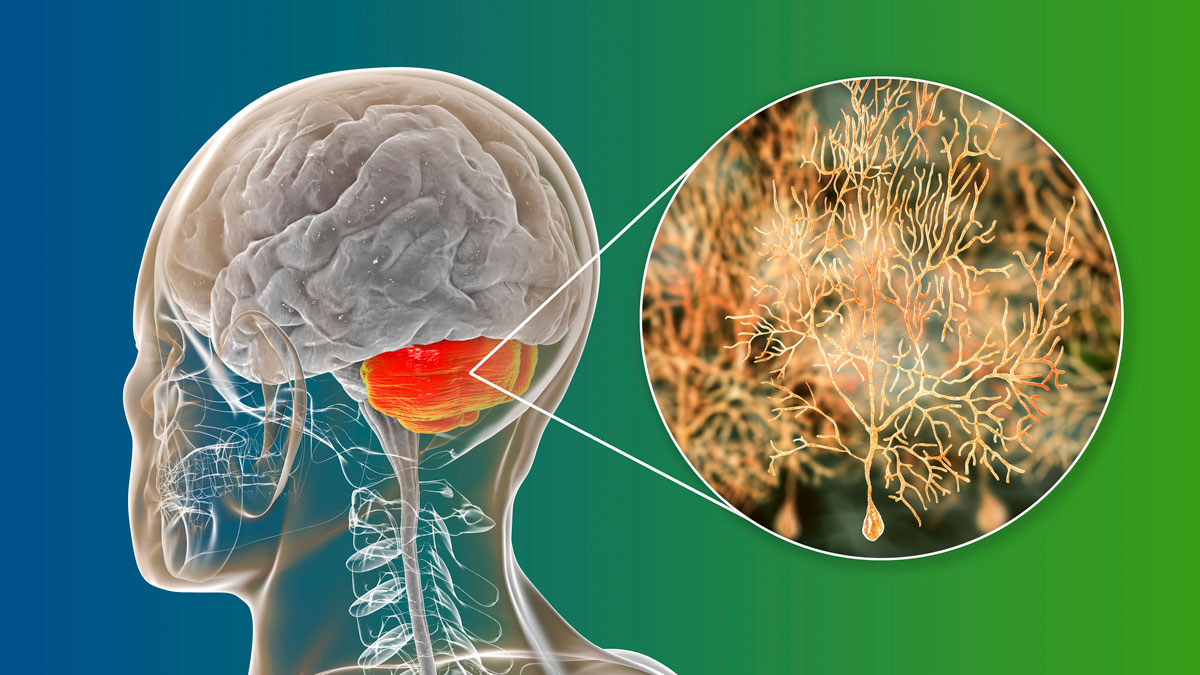 Illustration localisant le cervelet et les cellules de Purkinje © Dr Microbe/iStock.com
Illustration localisant le cervelet et les cellules de Purkinje © Dr Microbe/iStock.com
Mais de quel type de calcul temporel parle-t-on ? « Il ne s’agit pas de lire l’heure sur un cadran, mais bien de “représenter” précisément des intervalles de temps et des séquences d’événements », détaille Philippe Isope, directeur de recherche spécialiste de l’électrophysiologie cérébrale à l’Institut des neurosciences cellulaires et intégratives1. Autrement dit, le cervelet excelle dans le calcul du timing relatif entre différents signaux, avec une précision souvent de l’ordre de la milliseconde.
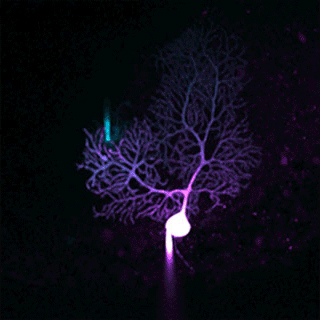 Cellule de Purkinje individuelle mise en évidence par fluorescence. Le soma blanc et l’arborisation dendritique violette révèlent la structure plane et très ramifiée de ce neurone « chef d’orchestre » du cervelet. Image © Kevin Dorgans, INCI, CNRS
Cellule de Purkinje individuelle mise en évidence par fluorescence. Le soma blanc et l’arborisation dendritique violette révèlent la structure plane et très ramifiée de ce neurone « chef d’orchestre » du cervelet. Image © Kevin Dorgans, INCI, CNRS
En temps quasi réel et en permanence
Cette faculté et la nécessité de jongler avec les millisecondes est omniprésente. Pour retourner une balle de tennis, par exemple, il ne suffit pas de la voir arriver : le cervelet doit impérativement calculer sa trajectoire, prédire l’impact et synchroniser la frappe au bon instant, en s’ajustant en continu. Et quand on sait la vitesse que la balle peut atteindre, mieux vaut s’ajuster (très) rapidement !
Cette précision s’avère tout aussi cruciale pour jouer d’un instrument de musique avec le bon tempo, marcher sur un sol instable, anticiper la trajectoire d’un obstacle, danser, tout comme pour assurer la fluidité de notre parole et comprendre le langage, voire pour décoder la subtilité d’une interaction sociale.
Autant dire que le moindre dysfonctionnement peut se révéler lourd de conséquences quant à nos facultés cognitives et motrices, et que mieux comprendre cet organe apparaît dès lors indispensable…
Décrypter le chronomètre cérébral
Mais, concrètement, comment l’équipe de Philippe Isope s’y prend-elle pour décrypter ce chronomètre cérébral ? Sa force particulière réside dans une approche dite « intégrée », naviguant autrement dit entre différents niveaux d’analyse, allant de la plus petite molécule au comportement animal et humain.
« Nous avons conservé une approche à différents ordres de grandeur », explique le chercheur. Cette démarche multi-échelle est essentielle pour relier les mécanismes fins opérant au niveau de la synapse (jonction entre deux neurones) avec les fonctions globales, à l’échelle de l’individu.
Si l’on sait aujourd’hui que le cervelet est organisé en une mosaïque complexe de « modules » fonctionnels distincts, comprendre précisément comment ces modules collaborent pour réaliser les calculs temporels, notamment via l’étude fine de leurs connexions synaptiques, est un axe majeur des travaux de Philippe Isope.
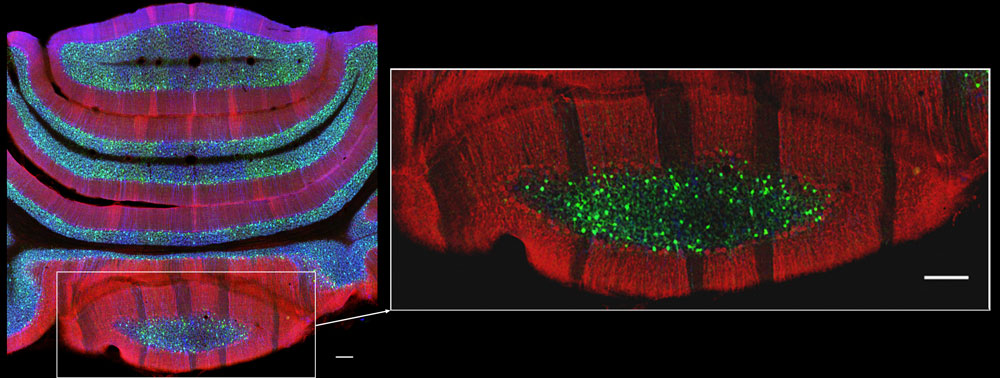 Cartographie cellulaire du cortex cérébelleux de souris. Les neurones de Purkinje (en rouge) côtoient deux sous-types de cellules de Golgi (vert/bleu). Cette imagerie 3D (traits échelles = 100 µm) révèle la position et l’interaction des familles cellulaires. Images © Jean-Luc Dupont / INCI / CNRS Images
Cartographie cellulaire du cortex cérébelleux de souris. Les neurones de Purkinje (en rouge) côtoient deux sous-types de cellules de Golgi (vert/bleu). Cette imagerie 3D (traits échelles = 100 µm) révèle la position et l’interaction des familles cellulaires. Images © Jean-Luc Dupont / INCI / CNRS Images
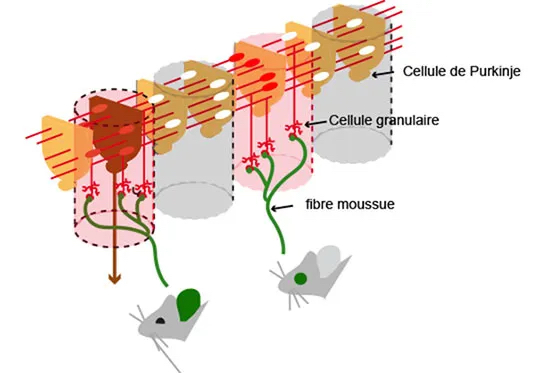 Organisation type d’un micro-circuit cérébelleux. Les fibres moussues (vert) activent les cellules granulaires (astérisques rouges) ; leurs fibres parallèles (rouge) croisent les dendrites des cellules de Purkinje (brun) avant d’envoyer la sortie hors du cervelet. © Philippe Isope, INCI, CNRS
Organisation type d’un micro-circuit cérébelleux. Les fibres moussues (vert) activent les cellules granulaires (astérisques rouges) ; leurs fibres parallèles (rouge) croisent les dendrites des cellules de Purkinje (brun) avant d’envoyer la sortie hors du cervelet. © Philippe Isope, INCI, CNRS
Cette organisation en modules s’accompagne aussi d’une diversité au niveau cellulaire, par exemple entre différents sous-types de cellules granulaires, les neurones les plus nombreux du cerveau, dont on cherche à déterminer les rôles spécifiques dans le traitement temporel.
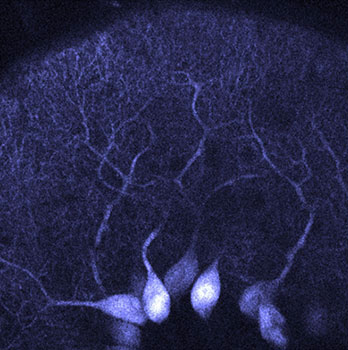 Cellule de Purkinje (bleu) dans le cortex cérébelleux. Le soma volumineux et l’arbre dendritique en éventail illustrent le rôle d’intégrateur clé de ces neurones. Image © Kevin Dorgans, INCI, CNRS
Cellule de Purkinje (bleu) dans le cortex cérébelleux. Le soma volumineux et l’arbre dendritique en éventail illustrent le rôle d’intégrateur clé de ces neurones. Image © Kevin Dorgans, INCI, CNRS
Observer l’activité précise des synapses
Pour explorer cette organisation complexe à toutes les échelles, l’équipe combine des outils de pointe. Elle peut ainsi cartographier en 3D l’organisation des neurones – parfois, avec des marqueurs génétiques multicolores pour distinguer les « familles » de cellules qui permettent alors de recouper les neurones qui se colorent de manière identique.
Ces travaux sont menés en collaboration avec l’équipe de Fekrije Selimi au Centre interdisciplinaire de recherche en biologie2. Les chercheurs observent alors l’activité précise des synapses en temps réel chez l’animal éveillé, capturant ainsi la dynamique du circuit en action, élément indispensable pour comprendre le fonctionnement à l’échelle de l’individu.
Ils peuvent même tester spécifiquement le rôle d’un module ou d’un type cellulaire en l’activant ou le rendant silencieux, par exemple avec l’optogénétique, qui utilise la lumière pour activer ou désactiver à souhait une région de neurones.
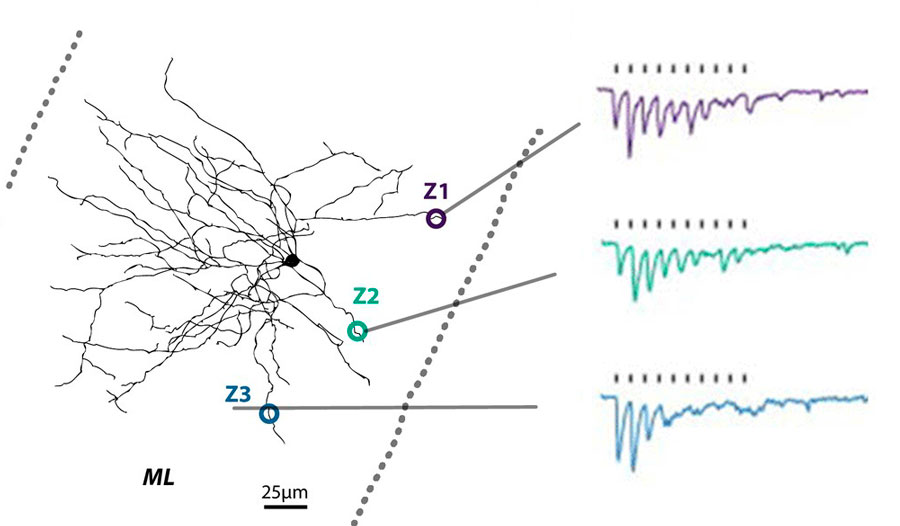 Cartographie fonctionnelle d’une dendrite de Purkinje. La stimulation ciblée de trois zones (Z1-Z3) déclenche des réponses synaptiques différentes, montrant la spécialisation spatiale du traitement des signaux. Image © Kevin Dorgans, INCI, CNRS
Cartographie fonctionnelle d’une dendrite de Purkinje. La stimulation ciblée de trois zones (Z1-Z3) déclenche des réponses synaptiques différentes, montrant la spécialisation spatiale du traitement des signaux. Image © Kevin Dorgans, INCI, CNRS
Enfin, ces précieuses données expérimentales sont ensuite cruciales pour construire et affiner des modèles informatiques. Cette synergie entre expérimentation ciblée et modélisation numérique permet de simuler le fonctionnement du cervelet, de tester des hypothèses plus efficacement et de mieux comprendre cette incroyable machinerie temporelle, tout en réduisant au strict minimum indispensable le recours au modèle animal.
Quand le timing déraille : les enjeux pour la santé
Mais alors, à quoi servent concrètement ces expériences sur les souris, ces cartographies complexes et ces explorations moléculaires ? Pour Philippe Isope, la réponse est claire : comprendre les mécanismes fondamentaux du fonctionnement cérébral, notamment ce rôle crucial du cervelet dans le temps et sa diversité interne, est une étape indispensable pour pouvoir, un jour, développer des approches thérapeutiques ciblées contre un large éventail de troubles neurologiques et psychiatriques.
« Ce n’est pas parce qu’on étudie les mécanismes fondamentaux que cela n’a pas d’intérêt pour la santé humaine, bien au contraire », insiste le chercheur.
Conséquences des atteintes cérébelleuses sur la santé
Les liens avec la santé sont nombreux et vont au-delà des troubles moteurs classiques comme l’ataxie (caractérisée par des problèmes de coordination), la dystonie (contractions involontaires) ou les tremblements. Des atteintes cérébelleuses peuvent aussi causer des problèmes cognitifs et émotionnels, comme dans le syndrome cognitif affectif cérébelleux, aussi appelé, syndrome CCAS (pour « Cerebellar Cognitive Affective Syndrome »).
Des anomalies dans ces circuits sont également suspectées de jouer un rôle dans les troubles du spectre autistique (TSA), où l’intégration sensorielle et la coordination sociale sont affectées, ainsi que dans le trouble déficitaire de l’attention avec ou sans hyperactivité (TDAH).
Le lien le plus surprenant concerne peut-être la schizophrénie. Des travaux, notamment ceux d’Anne Giersch, médecin et directrice de recherche au laboratoire Neurosciences & psychiatrie translationnelles de Strasbourg3, qui collabore avec l’équipe de Philippe Isope, suggèrent que certains patients souffrent en effet d’une perception temporelle fragmentée.
L’une des hypothèses avancées, que les recherches du laboratoire sur les mécanismes de prédiction temporelle explorent, est celle dite de la « soustraction du retour sensoriel attendu ». Normalement, le cervelet prédit et supprime la perception de nos propres actions, comme le son de notre voix. C’est aussi ce qui explique que le fait qu’il n’est pas possible de s’auto-chatouiller.
« Si ce mécanisme défaille à cause d’un problème de timing, on peut pourtant interpréter une information venant de soi comme extérieure, ce qui pourrait expliquer certaines hallucinations, retrouvées dans les troubles schizophréniques », explique Philippe Isope,
Vers de nouvelles pistes thérapeutiques
En définitive, démêler les secrets du calcul temporel cérébelleux et comprendre sa fine organisation est la clé pour ouvrir des perspectives thérapeutiques nouvelles. Mieux cerner comment le timing précis est affecté dans chaque pathologie est essentiel pour envisager des approches plus ciblées.
L’objectif n’est alors souvent pas tant de « réparer » un câblage altéré que d’exploiter la plasticité cérébrale restante, comme le résume Philippe Isope : « C’est cette logique que j’aimerais appliquer : utiliser le cervelet comme un outil pour réentraîner les réseaux cérébraux afin de permettre une réadaptation en cas de pathologie en utilisant des stimulations cérébrales non-invasives ». Avec à terme pour objectif de transformer sensiblement la prise en charge de plusieurs maladies neurologiques et psychiatriques, offrant ainsi un nouvel espoir aux patients.
Consultez aussi sur CNRS Le Journal
Une carte pour visualiser l’énergie dans le cerveau
Dans le cerveau, ce sont les connexions qui commandent !
Notre cerveau en super résolution (vidéo)
__________________
Ces recherches et cet article ont été financés en tout ou partie par l’Agence Nationale de la Recherche (ANR) au titre des projets ANR-NetOnTime-AAPG2019 et ANR-GraCeFORCe-AAPG2022. Cette communication est réalisée et financée dans le cadre de l’appel à projet Sciences Avec et Pour la Société - Culture Scientifique Technique et Industrielle.
__________________
Publications
• Ludovic Spaeth, Jyotika Bahuguna, Theo Gagneux, Kevin Dorgans, Izumi Sugihara, Bernard Poulain, Demian Battaglia & Philippe Isope, Cerebellar connectivity maps embody individual adaptive behavior in mice., Nature Communications, 31 janvier 2022. DOI: 10.1038/s41467-022-27984-8
• Ludovic Spaeth & Philippe Isope, What Can We Learn from Synaptic Connectivity Maps about Cerebellar Internal Models?, The cerebellum, 7 avril 2022. DOI: 10.1007/s12311-022-01392-6
Sur les ANR concernées, voir aussi :
• Binda F, Spaeth L, Kumar A, Isope P. Excitation and Inhibition Delays within a Feedforward Inhibitory Pathway Modulate Cerebellar Purkinje Cell Output in Mice. J Neurosci. 2023 Aug 16;43(33):5905-5917. doi: 10.1523/JNEUROSCI.0091-23.2023
• Özcan OO, Wang X, Binda F, Dorgans K, De Zeeuw CI, Gao Z, Aertsen A, Kumar A, Isope P. Differential Coding Strategies in Glutamatergic and GABAergic Neurons in the Medial Cerebellar Nucleus. J Neurosci. 2020 Jan 2;40(1):159-170. doi: 10.1523/JNEUROSCI.0806-19.2019



