A la une

En 2022, le paludisme a tué 608 000 personnes dans le monde. Parmi elles, 95 % vivent en Afrique, 80 % sont des enfants de moins de cinq ans. En 2016, l’Organisation des nations unies (ONU) se fixait comme objectif pour 2030 la fin de l’épidémie de paludisme. Un défi d’autant plus ardu que, après le déclin observé ces deux dernières décennies, la maladie a atteint un plateau, et a même connu un rebond lors de la crise Covid-19.
Parmi les principaux leviers d’action, la démoustication, la distribution de moustiquaires traitées aux insecticides, le traitement des personnes malades. Un angle mort demeure : les infections chroniques asymptomatiques. En l’absence d’autre réservoir que l’homme, elles permettent au parasite Plasmodium falciparum de subsister à la saison sèche, et de patienter jusqu’au retour des moustiques. Les personnes asymptomatiques, dont l’infection peut persister de manière chronique plusieurs mois (voire plusieurs années), constituent le réservoir dans lequel les moustiques se rechargent en parasite au début de la saison des pluies.
« Si nous voulons éradiquer le paludisme, nous ne pouvons pas nous satisfaire d’attendre que les personnes viennent à l’hôpital pour se faire soigner. Il faut aller sur le terrain, regarder quelles personnes sont positives à Plasmodium falciparum, puis les traiter », explique Antoine Claessens, chercheur au Laboratoire des pathogènes et de l’immunité de l’hôte1.
 Prélèvement d'échantillons par piqûre au doigt pour le diagnostic de P. falciparum dans les zones rurales de Gambie © Antoine Claessens.
Prélèvement d'échantillons par piqûre au doigt pour le diagnostic de P. falciparum dans les zones rurales de Gambie © Antoine Claessens.
Le projet MIRaGe, quête d’un parasite bien caché
L’infection asymptomatique demeure peu étudiée, du fait de divers obstacles techniques. Négatives aux tests de diagnostic rapide (TDR) de nature antigénique, les personnes affectées ne peuvent être dépistées que par PCR quantitative. Un examen certes plus sensible, mais peu accessible aux fragiles systèmes de santé du continent africain. « Ces personnes présentent une parasitémie très faible, de l’ordre d’un globule rouge infecté pour 100 000, voire un pour un million. Il est donc très difficile d’en extraire le matériel biologique, qu’il s’agisse d’ADN ou d’ARN », ajoute Antoine Claessens.
Au-delà de leur intérêt sanitaire, les infections asymptomatiques constituent un excellent modèle de relations hôte-pathogène. Pour les étudier, Antoine Claessens s’est rendu dans un village gambien, testant la présence du parasite à l’issue de la saison des pluies. Parmi les 42 personnes initialement dépistées, trois ont rapidement développé des symptômes. Quant aux 39 restantes, certaines ont spontanément éliminé le parasite, d’autres sont demeurées infectées tout au long de la saison sèche, sans symptôme. Chaque mois, les chercheurs ont effectué des prélèvements sanguins sur chacune de ces personnes, puis les ont traitées en début de saison des pluies afin d’empêcher qu’elles ne servent d’amorce à de nouvelles transmissions.
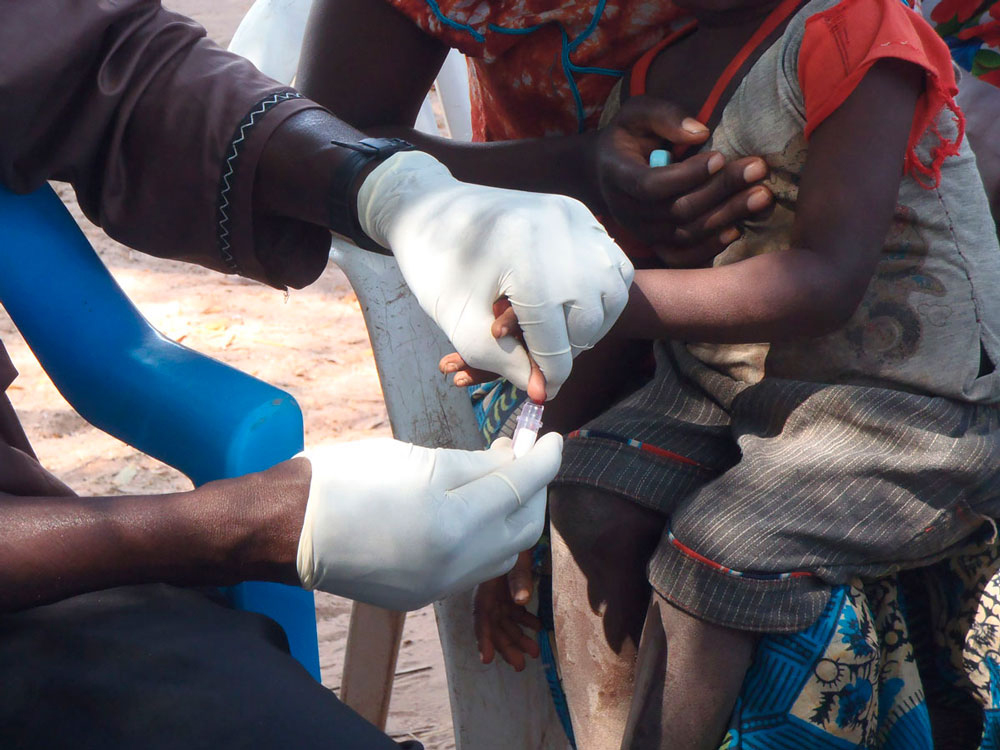 Prélèvement d'échantillons par piqûre au doigt pour le diagnostic de P. falciparum dans les zones rurales de Gambie © Antoine Claessens.
Prélèvement d'échantillons par piqûre au doigt pour le diagnostic de P. falciparum dans les zones rurales de Gambie © Antoine Claessens.
C’est grâce à cette précieuse collection d’échantillons qu’Antoine Claessens explore les mécanismes en cause derrière ces infections à bas bruit, dans le cadre de son projet MIRaGe (Malaria Infectious Reservoir and Genomics)2. Dans sa ligne de mire, une famille de 60 gènes parasitaires dénommés « var », codant pour différentes versions de la protéine Pfemp1. Situé à la surface des globules rouges infectés, cet antigène permet de les arrimer à la paroi des vaisseaux sanguins, empêchant ainsi leur destruction par la rate – et donc l’élimination du parasite. Mais cette protéine exogène constitue aussi, pour le système immunitaire, un moyen de détecter la présence d’une infection, donc de détruire les globules infectés.
La variation antigénique, gage de survie pour le parasite
Selon les travaux menés par Antoine Claessens, la compréhension des infections asymptomatiques réside dans la « variation antigénique ». « Le parasite exprime des antigènes, qui vont se retrouver à la surface du globule. Dans les cas chroniques asymptomatiques, il va régulièrement changer d’antigène . C’est comme s’il forçait le globule à mettre une veste différente tous les jours, ce qui lui permet d’échapper au système immunitaire pendant des mois », explique le chercheur.
Selon son hypothèse, « à la sortie du foie , le parasite doit d’abord exprimer différents gènes var. Il teste son hôte : si celui-ci présente peu d’immunité, la parasitémie augmente de manière exponentielle, entraînant des symptômes parfois graves . Si le système immunitaire est assez efficace , l’infection peut rester asymptomatique à l’état chronique ».
L’ampleur des symptômes résulterait donc d’un ’dialogue’ entre l’hôte et son parasite, via l’interaction entre gènes var et système immunitaire3. C’est cette hypothèse qu’Antoine Claessens souhaite désormais évaluer, dans le cadre d’une collaboration avec des équipes marseillaise et toulousaine. Optant pour un village du Ghana, pays dont l’incidence de paludisme est plus élevée que celle de la Gambie, les chercheurs ont suivi des enfants initialement indemnes du paludisme, les testant chaque semaine. Au bout de deux mois, « 85 % d’entre eux étaient infectés. La moitié ont développé des symptômes en deux semaines, tandis que les autres sont restés asymptomatiques. Du fait qu’ils étaient initialement négatifs, notre étude nous permet de détecter le début de l’infection », ajoute Antoine Claessens.
À partir des échantillons récoltés, les chercheurs souhaitent analyser la réponse immunitaire et le comportement du parasite au fil des mois, notamment en termes d’expression des gènes var. Objectif, déterminer ce qui, in fine, différencie une infection symptomatique d’une infection asymptomatique. « Mon hypothèse, c’est qu’il ne s’agit pas seulement d’un parasite plus virulent, d’un système immunitaire moins efficace, mais plutôt du bon parasite dans le bon hôte. Grâce à ces travaux, nous allons pouvoir caractériser l’expression des gènes var avant la survenue des symptômes. À ce jour, cela reste une inconnue ».
-------------------------------------------------------------------------------------
Ces recherches ont été financées en tout ou partie, par l’Agence nationale de la recherche (ANR) au titre de l'ANR MIRAGE- AAPG2018. Cette communication est réalisée et financée dans le cadre de l’appel à projet Science Avec et Pour la Société - Culture Scientifique Technique et Industrielle pour les projets JCJC et PRC des appels à projets génériques 2018-2019 (SAPS-CSTI JCJC et PRC AAPG 18/19).
-------------------------------------------------------------------------------------
Pour aller plus loin...
Paludisme : des pistes pour enrayer la prolifération du parasite - Diaporama
Pharmacognosie : de la nature à l'armoire à pharmacie - Entretien
- 1. LPHI - Unité CNRS / Université de Montpellier
- 2. A cohort study on the duration of Plasmodium falciparum infections during the dry season in the Gambia, Collins et al., J Infect Dis. 2022 Aug 12;226(1):128-137. doi: 10.1093/infdis/jiac116
- 3. Understanding host-pathogen-vector interactions with chronic asymptomatic malaria infections, Nyarko et al., Trends Parasitol. 2021 Mar;37(3):195-204. doi: 10.1016/j.pt.2020.09.017



