Vous êtes ici
Peut-on voir dans le noir ?

C’est un effet secondaire étonnant de la photothérapie dynamique, ce traitement associant lumière et médicament photosensible, utilisé pour traiter des cancers comme le cancer de la peau, de l’œsophage ou encore des bronches, mais aussi certaines infections bactériennes. « Au début des années 2000, des articles ont paru qui faisaient état de patients soignés avec de la chlorine e6, une molécule photosensible, qui commençaient à voir des silhouettes et des contours dans le noir et en étaient assez perturbés », raconte Antonio Monari, chimiste au laboratoire de physique et chimie théoriques1 et spécialiste de simulation moléculaire.
Le principe de ces traitements par photothérapie est bien connu : le médicament est activé par un faisceau laser localisé au niveau de la tumeur – un rayonnement infra-rouge capable de diffuser à faible profondeur dans les tissus – et détruit les cellules tumorales par la production d’une espèce d’oxygène très réactive, l’oxygène singulet. Mais comment la chlorine e6 utilisée pour éliminer les cellules tumorales se retrouve-t-elle à interagir avec le système visuel ? C’est ce qu’Antonio Monari et ses confrères ont cherché à savoir en utilisant une méthode nouvelle en biologie : la simulation moléculaire, qui permet de mimer des réactions biochimiques entièrement sur ordinateur, sans paillasse ni microscope.
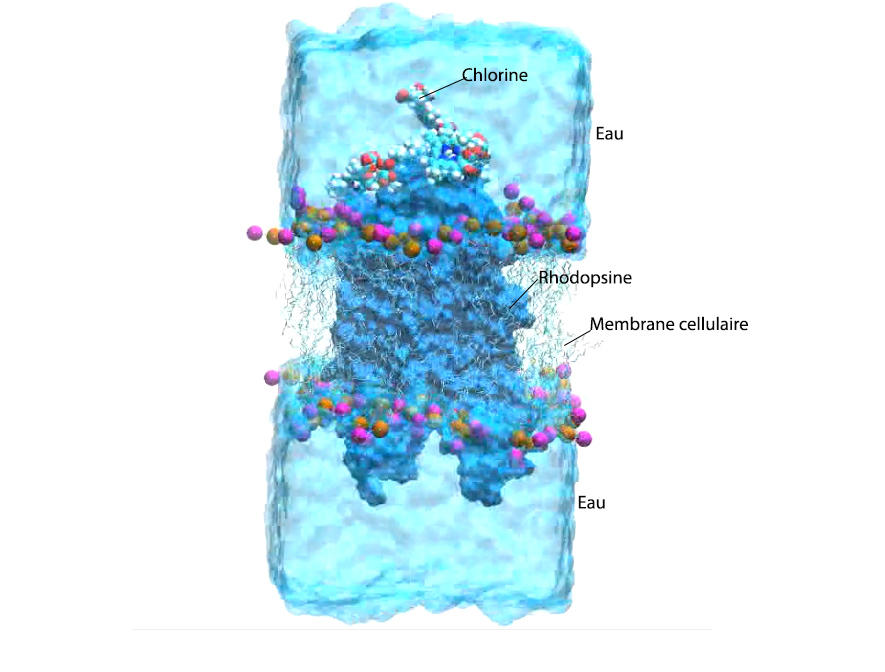
Lors du processus de vision, la lumière est collectée par un ensemble de récepteurs localisés dans la rétine : les cônes et les bâtonnets. Les bâtonnets contiennent une grande quantité de rhodopsine, une protéine photosensible capable d’absorber la lumière visible grâce à un groupement actif appelé rétinal, un dérivé de la vitamine A. « Lorsqu’il reçoit de la lumière, le rétinal change de structure chimique et se dissocie de la protéine, permettant la traduction du signal lumineux en signal électrique interprétable par le cortex visuel », explique Antonio Monari. Dans des conditions de faible luminosité, et notamment la nuit, le rayonnement lumineux prédominant ne se trouve plus dans le domaine du visible mais dans des longueurs d’onde plus élevées, les infrarouges, auxquelles le rétinal n’est pas sensible. Raison pour laquelle nous ne pouvons pas voir dans le noir, comme beaucoup d’autres espèces animales.
Mimer le biologique
« Grâce aux expérimentations menées par les biologistes ces dernières années, on sait que sous rayonnement infrarouge, la structure chimique du rétinal est modifiée après injection de chlorine – on parle d’isomérisation – de la même façon que lorsqu’il reçoit de la lumière visible. C’est ce qui explique cette augmentation de l’acuité visuelle nocturne, explique Antonio Monari. Cependant, on n’avait aucune idée de la façon précise dont la rhodopsine et son groupement rétinal interagissaient avec la chlorine. C’est ce mécanisme que nous avons réussi à élucider grâce à la simulation moléculaire. »
Cette méthode utilisée en biologie depuis une dizaine d’années permet, grâce à des algorithmes intégrant les lois de la physique newtonienne et de la physique quantique, toutes deux à l’œuvre au niveau atomique, de mimer le fonctionnement d’un système biologique dans le temps. Le mouvement de chacun des atomes est modélisé en fonction de son attirance ou de sa répulsion pour les atomes voisins, de même que la rupture ou au contraire la création de nouvelles liaisons chimiques.
« Pour notre simulation, nous avons mis en présence une protéine de rhodopsine virtuelle insérée dans sa membrane lipidique, plusieurs molécules de chlorine e6 et de l’eau, soit quelques dizaines de milliers d’atomes, raconte Antonio Monari. Nos supercalculateurs ont tourné plusieurs mois et réalisé des millions de calculs avant de pouvoir simuler l’intégralité de la réaction biochimique déclenchée par le rayonnement infrarouge. C’est dire toute la complexité de ces phénomènes qui se produisent en quelques centaines de nanosecondes… »
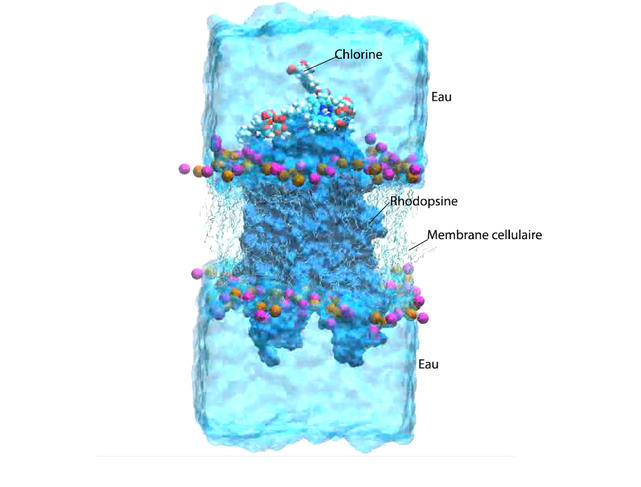
En absorbant le rayonnement infrarouge, la chlorine e6 interagit avec l’oxygène présent dans les tissus de l’œil et le transforme en oxygène réactif, ou oxygène singulet, comme cela a pu être observé au niveau des lésions cancéreuses. Antonio Monari et ses confrères des universités espagnoles de Alcala de Henares et Valence, et de Nankai en Chine, ont réussi à montrer que cet oxygène singulet pénétrait dans la molécule de rhodopsine et venait s’accumuler à côté du rétinal, provoquant son isomérisation. « Comme nous sommes en présence d’un faible rayonnement infrarouge – rien à voir avec la puissance du faisceau laser utilisé en photothérapie –, il n’y a pas production de suffisamment d’oxygène réactif pour provoquer la destruction de cellules de l’œil, rassure Antonio Monari. Mais il y en a suffisamment pour que la vision nocturne soit légèrement améliorée. »
Pistes thérapeutiques
La compréhension de ce mécanisme pourrait permettre, à terme, de neutraliser cet effet secondaire chez les patients traités par photothérapie dynamique, et ouvre des perspectives intéressantes pour développer des traitements alternatifs pour la cécité ou l’hypersensibilité lumineuse. « On pourrait aussi imaginer reproduire ce mécanisme et l’améliorer pour permettre de voir la nuit, de façon intentionnelle cette fois », commente Antonio Monari.
Ce résultat montre tout l’intérêt de la simulation moléculaire pour la compréhension des systèmes biologiques. « Nous n’en sommes qu’au début, car il est difficile de mimer des systèmes intégrant de trop grosses molécules. Mais la simulation moléculaire est déjà utilisée pour éclairer des mécanismes fondamentaux – pourquoi certaines lésions de l’ADN sont mieux réparées que d’autres, par exemple –, et permet de sélectionner de potentielles molécules thérapeutiques en mimant leur interaction avec la cible visée », conclut le chercheur. ♦
A lire
« Induced night-vision by singlet-oxygen-mediated activation of rhodopsin », Journal of physical chemistry letters, octobre 2019.
- 1. Unité CNRS/Université de Lorraine.
Voir aussi
Auteur
Journaliste scientifique, Laure Cailloce est rédactrice en chef adjointe de CNRS Le Journal et de la revue Carnets de science.