Vous êtes ici
Du cœur aux poumons, l’incroyable mécanique des fluides humains
Observer le mouvement de l’air dans les poumons, voir la poussée du sang gonfler les artères au rythme des battements du cœur. Pour mieux comprendre le fonctionnement global du corps humain, il faut non seulement être capable de représenter les organes qui le composent, mais aussi les fluides qui le parcourent. C’est pourquoi les physiciens viennent aujourd’hui prêter main-forte aux médecins. Grâce à la mécanique des fluides, discipline qui décrit le comportement des gaz et des liquides, ils tentent de modéliser le plus fidèlement possible la manière dont les fluides biologiques s’écoulent dans le réseau sanguin et les voies aériennes. Avec, à la clé, la possibilité d’améliorer les diagnostics médicaux et d’adapter les traitements.
Dépister les risques d’athérosclérose
Considérer les poumons et le système vasculaire comme de simples objets régis par la mécanique des fluides... Voilà une idée qui était loin d'être évidente il y a encore quinze ans. Mais aujourd’hui, de plus en plus de médecins comprennent les bénéfices qu’ils peuvent tirer de cette approche qui commence à faire son entrée dans les hôpitaux. Un exemple révélateur : l’athérosclérose. Cette maladie vasculaire se caractérise par le dépôt d’une plaque composée essentiellement de graisses sur la paroi interne d’une artère. Le diamètre de celle-ci diminue, ce qui peut entraver la circulation sanguine, avec des conséquences parfois dramatiques.
les poumons et le
système vasculaire
comme des objets
régis par la
mécanique des
fluides n’était pas
évident il y a
quinze ans.
Grâce aux physiciens, qui font appel à des simulations numériques et à des maquettes du réseau sanguin plus vraies que nature, on sait maintenant que le développement de ce trouble vasculaire est lié en grande partie aux contraintes mécaniques qui s’exercent sur les parois des artères. « En aval d’une bifurcation du réseau sanguin, le flux ralentit, explique Gwennou Coupier, du Laboratoire interdisciplinaire de physique1, à Saint-Martin-d’Hères. Résultat : certaines cellules, les globules blancs en particulier, qui ne sont pas emportées par le courant à cet endroit, parviennent à pénétrer dans la paroi de l’artère, favorisant ainsi la croissance d’une plaque, à l’origine de la maladie. »
Forts de ce constat, les médecins peuvent désormais élaborer un diagnostic précoce pour cette affection pour des sujets dont on sait déjà qu’ils présentent un risque. À partir de la morphologie de leurs vaisseaux reconstituée par IRM, on simule numériquement l’écoulement sanguin dans ce réseau. Et on peut alors pointer du doigt les zones qu’il faut surveiller en priorité.
Guider les chirurgiens dans leurs interventions
Mais ce n’est pas tout : la modélisation peut également guider les chirurgiens dans leurs interventions. « Aujourd’hui, dans le cas de l’athérosclérose, on décide d’opérer un patient selon des critères moyens de taux d’obstruction des artères, précise Gwennou Coupier. En mesurant précisément la contrainte mécanique qui s’exerce sur la paroi de l’artère touchée, on dispose d’un critère plus fin pour prendre la bonne décision. » En fonction des résultats donnés par les modèles, le chirurgien peut ainsi décider d’intervenir ou non. Et, si le choix est fait d’intervenir, les modèles servent à orienter le geste chirurgical. Faut-il dériver le sang en aval de la plaque en effectuant un pontage ? Ou faut-il dilater l’artère à l’aide d’un ballonnet ? Ces deux scénarios peuvent être simulés afin de retenir celui qui rétablira le mieux la circulation sanguine.
Bien d’autres pathologies peuvent être traitées par cette approche biomécanique : les sténoses, ces rétrécissements inhabituels de vaisseaux, ou encore les anévrismes, ces dilatations anormales de la paroi d’une artère qui menacent d’éclater. Objectif des physiciens dans ce dernier cas : évaluer la répartition des pressions et la résistance des parois pour situer le point faible, et tenter de prédire où et quand l’anévrisme va céder. Une fois le diagnostic posé, les calculs permettent là encore de planifier le geste chirurgical. Mais les modélisations de l’écoulement sanguin servent aussi à la conception et à l’optimisation des dispositifs médicaux implantables tels que les stents, les valves ou encore les cathéters. Et permettent une nouvelle fois d’orienter le choix des médecins, qui sauront où les placer exactement chez chaque patient, et quel type utiliser.
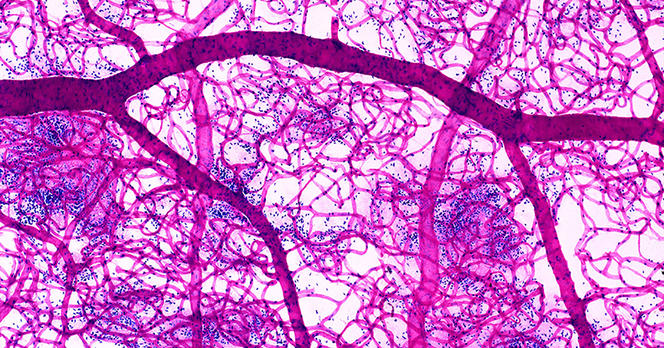
Dans leur quête d’une description complète des écoulements biologiques, les physiciens ne se focalisent pas seulement sur les plus gros vaisseaux comme les artères et les veines. Ils étudient également le déplacement du sang dans les plus petits capillaires, qui ne mesurent que quelques micromètres de diamètre. « À cette échelle, le fluide ne s’écoule plus de manière homogène, précise Anne-Virginie Salsac, du laboratoire Biomécanique et bioingénierie2, à Compiègne (lire https://lejournal.cnrs.fr/articles/anne-virginie-salsac-et-la-petite-mecanique-du-corps-humainson portrait). Cela est dû au fait que le sang est composé de cellules, et notamment de globules rouges, en suspension. Et, pour se frayer un chemin dans les capillaires, qui à certains endroits sont deux fois plus petits qu’eux, ces derniers doivent se déformer. De leurs déformations dépendront les propriétés de l’écoulement sanguin. »
Diagnostiquer le paludisme
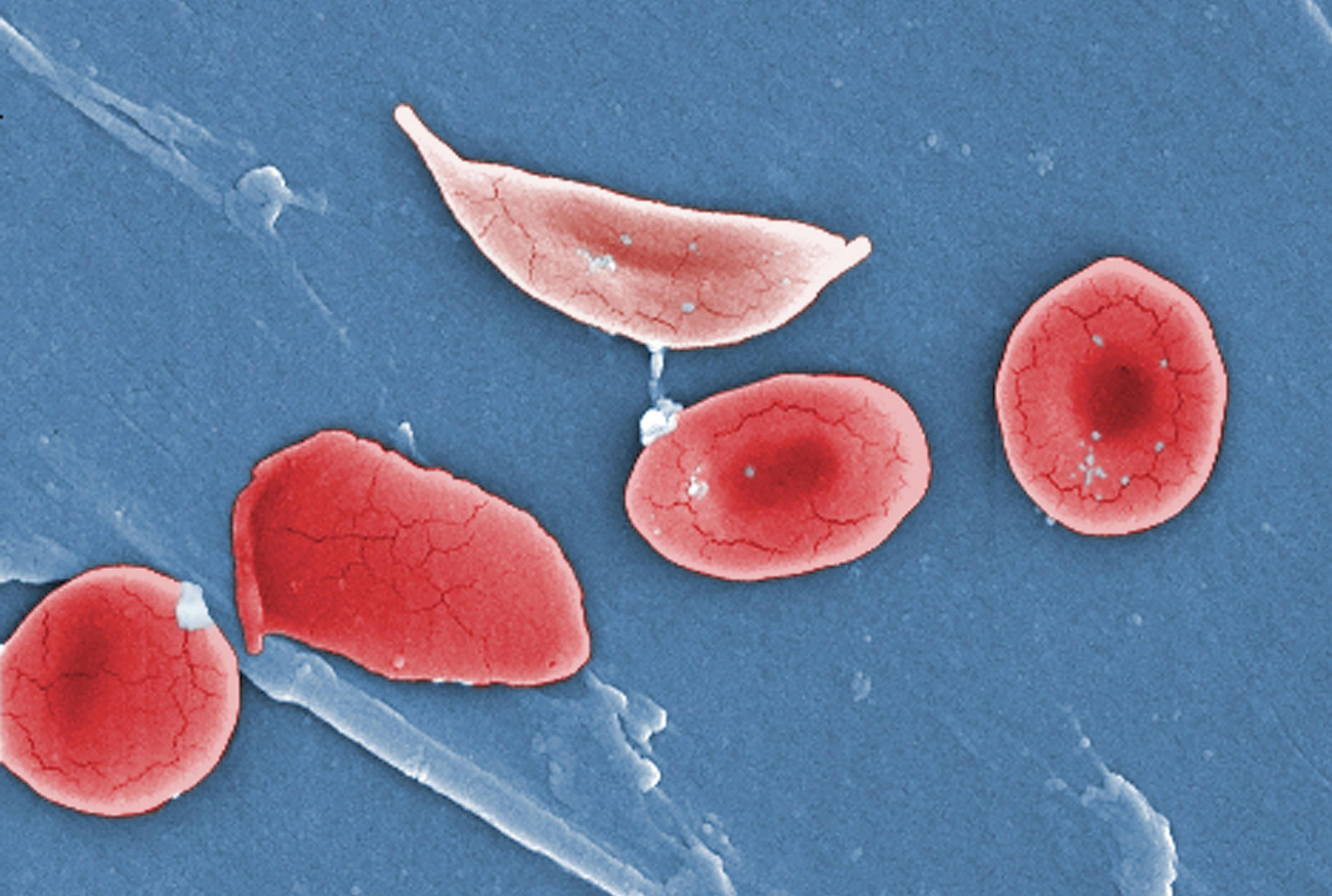
Les scientifiques souhaitent tirer parti de cette observation pour diagnostiquer certaines maladies. À commencer par le paludisme. « Le moustique responsable de cette maladie injecte un parasite qui modifie les propriétés mécaniques des globules rouges, explique Magalie Faivre, de l’Institut des nanotechnologies de Lyon3. Ces derniers qui étaient mous et déformables deviennent rigides. Résultat : ils se bloquent dans les capillaires, avec des conséquences parfois graves. »
D’où l’idée de la chercheuse et de son équipe de développer un dispositif qui utilise la déformabilité des globules rouges pour détecter la présence du paludisme. « Notre dispositif microfluidique est constitué d’un canal de taille micrométrique qui se rétrécit à intervalle régulier, confie-t-elle. On y injecte du sang et on mesure individuellement le déplacement de chaque globule rouge d’un bout à l’autre du canal : capables de se déformer facilement, les globules sains vont vite ; les globules infectés, eux, au contraire, vont beaucoup plus lentement. »
ont développé
un dispositif
qui utilise la déformation des
globules rouges
pour détecter
la présence
du paludisme.
Aujourd’hui, l’équipe lyonnaise teste son outil avec du sang dont une partie des globules rouges a été modifiée chimiquement pour imiter les cellules infectées par le parasite. Mais l’année prochaine, les essais commenceront sur des échantillons de sang pathologique. Et d’ici à cinq ans, les chercheurs espèrent pouvoir tester le dispositif, qui à terme fera la taille d’une carte à puce, dans les pays touchés par le paludisme.
Une fois opérationnelle, la technique présentera de nombreux atouts par rapport aux autres méthodes de diagnostic. Premier avantage : on sera quasiment certain de la présence du parasite dans le sang. Ce qui n’est pas le cas actuellement avec une autre technique qui vise à détecter une protéine libérée par le parasite. « On n’est pas à l’abri de faux positifs avec cette méthode biochimique, car la protéine peut persister dans le sang quand bien même tous les parasites ont été éliminés par des médicaments antipaludiques », note Magalie Faivre.
Autre avantage de l’analyse biomécanique : en mettant en évidence deux types de globules rouges – rapides et lents – et en comptant individuellement chacun d’entre eux, il sera possible de mesurer précisément la proportion de cellules infectées. Un paramètre important pour décider du bon traitement à administrer aux malades. Que ne fournit pas actuellement la méthode biochimique.
Prédire les crises de drépanocytose
Autre maladie affectant les globules rouges et qui pourrait bénéficier de l’apport de la mécanique des fluides : la drépanocytose. Cette maladie génétique modifie la structure de l’hémoglobine transportée par les globules rouges. Comme dans le cas du paludisme, ces derniers deviennent plus rigides et obstruent alors les capillaires, ce qui provoque des crises douloureuses extrêmement fortes. La transfusion sanguine est bien souvent le seul remède possible pour soulager les patients. Mais, pour qu’elle soit efficace, il faut qu’elle ait lieu juste avant une crise.
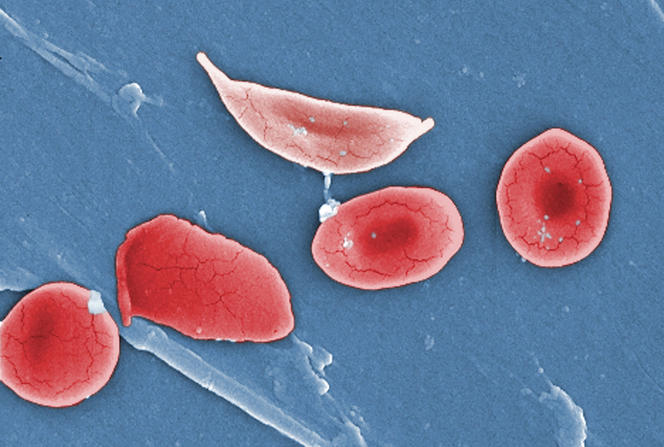
L’approche mécanique pourrait justement permettre de prédire la survenue de ces crises. « Nous faisons circuler du sang de malades dans des canaux microfluidiques qui reproduisent le réseau capillaire avec ses rétrécissements et ses bifurcations, explique Gwennou Coupier. Le réseau finit par se boucher à certains endroits. Et nous essayons d’expliquer pourquoi. Est-ce à cause de la rigidité des globules rouges ? Est-ce parce qu’ils s’agrègent les uns aux autres ? Est-ce dû à la géométrie du réseau ? » En répondant à ces questions, le chercheur et son équipe espèrent mieux comprendre le phénomène pour pouvoir un jour mieux anticiper l’apparition des crises.
Au-delà du diagnostic, l’étude de l’écoulement sanguin à l’échelle microscopique offre même la perspective de mettre au point de nouvelles techniques thérapeutiques. Ainsi, les chercheurs travaillent actuellement au développement de micro- et de nanocapsules injectables dans le sang pour délivrer des médicaments à des endroits bien précis. De cette façon, on minimiserait la quantité de médicament et on l’apporterait uniquement à la région malade.
« Si on arrive à bien comprendre le devenir des capsules une fois injectées dans la circulation sanguine, on pourra contrôler là où elles vont aller et la façon dont elles vont relarguer les médicaments, que ce soit par diffusion à travers la membrane ou par sa rupture », explique Anne-Virginie Salsac. Avec ses collègues, la biomécanicienne a développé une nouvelle technique numérique pour simuler le comportement d’une capsule dans un écoulement sanguin. Et ils ont montré que c’est en jouant sur les différentes propriétés mécaniques d’une capsule (taille, élasticité, forme, porosité…) qu’on pourra maîtriser la délivrance du médicament.
Traiter le syndrome de détresse respiratoire aiguë
Il est une maladie en particulier pour laquelle la mécanique des fluides pourrait être d'une aide précieuse : le syndrome de détresse respiratoire aiguë (SDRA), une inflammation des poumons qui provoque la mort de plus de 10 000 personnes chaque année en France. Un traitement existe pour soulager les malades : il consiste à injecter dans les poumons, via la trachée, un liquide appelé "surfactant", afin qu'ils puissent se gonfler plus facilement. Ce traitement est largement utilisé pour soigner les bébés prématurés qui souffrent de ce syndrome, car le surfactant naturel leur fait souvent défaut, et a permis de faire chuter significativement la mortalité des nourrissons. En revanche, les essais chez les adultes se sont révélés à ce jour inefficaces.
Les travaux d’une équipe de chercheurs internationale pourraient néanmoins changer la donne. Ces derniers ont mis au point le premier modèle numérique qui simule l’écoulement de surfactant dans les poumons. Grâce à ce modèle, ils sont parvenus à expliquer pourquoi la thérapie est un succès chez les nourrissons, alors qu’elle a échoué jusqu’ici chez les adultes. Et ils ont montré qu’en réalité il était possible d’utiliser aussi ce traitement chez l’adulte4.
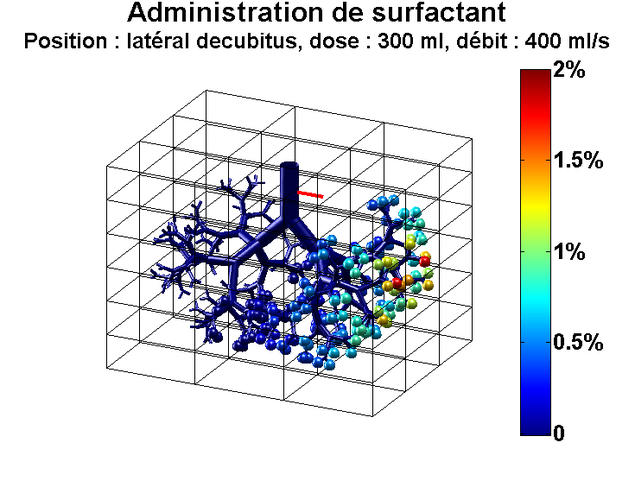

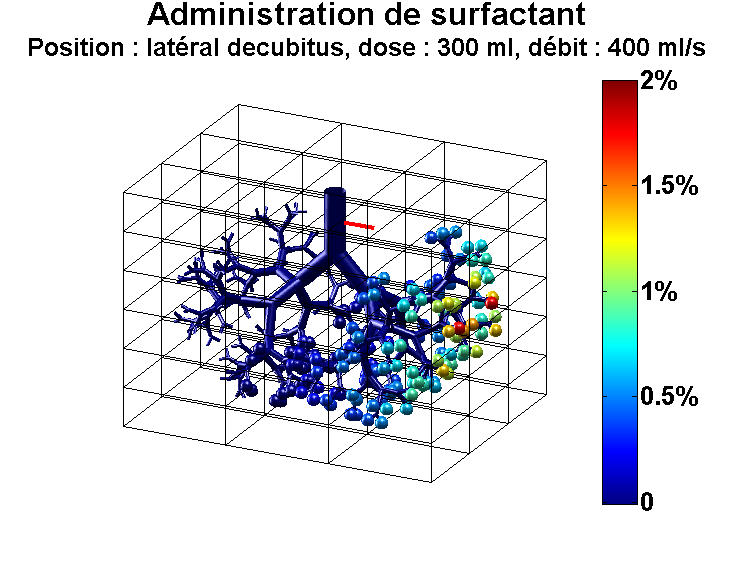
« La différence fondamentale entre les poumons d’un nourrisson et ceux d’un adulte, c’est leur taille, explique Marcel Filoche, du Laboratoire de physique de la matière condensée5 à Palaiseau, un des auteurs de ces travaux. Lorsqu’on injecte du surfactant à un bébé, le liquide n’a pas trop de difficulté à se répandre dans l’ensemble de l’arbre respiratoire, de la trachée jusqu’aux minuscules alvéoles pulmonaires. Chez l’adulte, c’est différent. Pour une dose de médicament donnée, si le volume de liquide est trop petit, il n’atteindra pas l’extrémité du réseau pulmonaire. » C’est précisément ce qui s’est passé lors des essais de cette thérapie et qui explique leur échec.
Le modèle développé par les chercheurs met ainsi en évidence toute l’importance du volume à injecter au patient pour assurer le succès du traitement ; il pointe également d’autres paramètres cruciaux à prendre en compte : la vitesse d’injection, la densité du liquide, sa viscosité, mais aussi la position du patient dans l’espace, la gravité aidant le surfactant à diffuser dans les poumons en fonction de l’angle des différents embranchements pulmonaires.« Nos résultats vont permettre de rouvrir d’ici quelques années une voie thérapeutique abandonnée », se réjouit Marcel Filoche. Mieux encore : avec ce modèle, il sera possible d’adapter le traitement à chaque patient. Une fois la géométrie des poumons de chacun connue par imagerie médicale, il suffira de simuler l’écoulement de surfactant dans son système respiratoire. Et de déterminer ensuite les paramètres (volume, densité, viscosité, etc.) qui aboutiront au meilleur résultat possible. La mécanique des fluides n’a pas fini de faire progresser la médecine.
Voir aussi
Auteur
Julien Bourdet, né en 1980, est journaliste scientifique indépendant. Il a notamment travaillé pour Le Figaro et pour le magazine d’astronomie Ciel et Espace. Il collabore également régulièrement avec le magazine La Recherche.