Vous êtes ici
Les pouvoirs méconnus du microbiote, peuple de nos intestins
Temps de lecture : 14 minutes
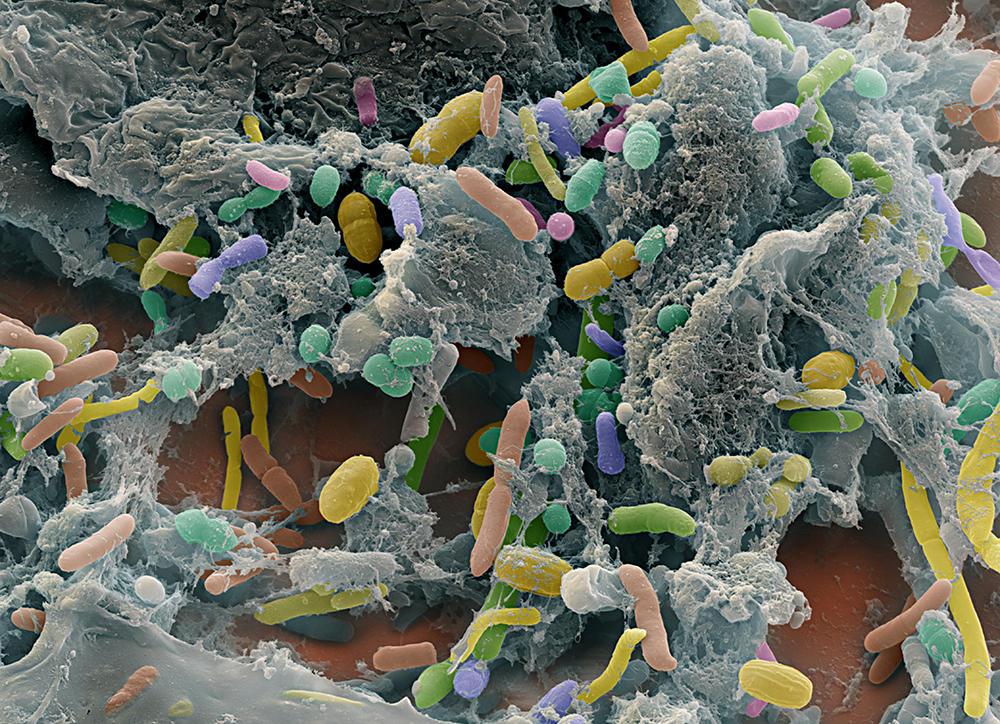
Longtemps cantonné au rôle de tuyauterie où transitent des aliments, le tube digestif a définitivement gagné ses galons d’organe noble et multifonctionnel. Promu « deuxième cerveau », fort de ses 500 millions de neurones répartis tout le long, notre intestin héberge en effet une foule de bactéries, phages, archées, virus et autres champignons non pathogènes affairés à notre bien-être quotidien. Ces 100 000 milliards de micro-organismes, qui se forment durant l’accouchement à partir de la flore fécale et vaginale maternelle, logent pour l’essentiel dans l’intestin grêle et le côlon, représentent plus de la moitié de nos cellules, et pèsent jusqu’à deux kilogrammes chez l’adulte. Baptisé « microbiote intestinal », cet écosystème n’en finit pas d’intriguer les biologistes.
« Le séquençage haut débit de l’ADN a déjà permis d’identifier plus de mille espèces microbiennes différentes dans l’intestin humain (le métagénome intestinal), mais certaines séquences génétiques ne correspondent à aucune espèce connue, pointe François Leulier, directeur de l’Institut de génomique fonctionnelle de Lyon1. Nous sommes donc encore loin de connaître tous les acteurs de cette communauté ». Les interactions qui lient ces microbes entre eux, et celles existant entre cette population et son hôte, sont également constellées de points d’interrogations…
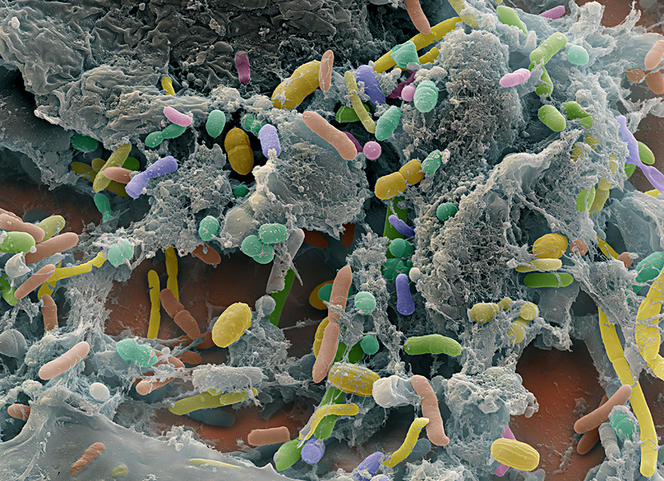
Cela n’empêche pas les secrets de la flore intestinale de tomber les uns après les autres. À commencer par ceux liés aux fonctions digestives et nutritives. Une ribambelle de micro-organismes assurent ainsi la fermentation des aliments non digestibles, facilitent l’assimilation des nutrimentsFermerSubstances alimentaires pouvant être entièrement assimilées sans avoir à subir les modifications de la digestion. Décomposés à partir des aliments dans l’estomac, les nutriments passent ensuite dans l’intestin pour être absorbés par le sang et utilisés par l’organisme. Les protéines, les glucides, les lipides, les vitamines, les sels minéraux et les oligoéléments sont des nutriments. en fournissant des enzymesFermerProtéines accélérant les réactions chimiques de l’organisme., contribuent à l’absorption des acides gras, du calcium, du magnésium, et participent à la production de plusieurs vitamines (K, certaines du groupe B). Mieux encore : le microbiote compense les effets négatifs d’une nutrition pauvre en protéines sur la croissance infantile.
« Les bactéries de la flore intestinale permettent en effet d’optimiser les réactions physiologiques impliquées dans la croissance au cours de la phase juvénile, même lorsque l’apport en protéines est insuffisant, détaille François Leulier. Nous avons été les premiers à montrer que des souris axéniques (c’est-à-dire sans microbiote intestinal), qu’elles soient ou non en sous-nutrition, prennent moins de poids et sont également plus petites que les souris standards2. Autrement dit, le stress nutritionnel provoqué par des carences protéiques a davantage d’impact sur l’organisme en l’absence de microbiote intestinal fonctionnel. »
Un allié indispensable contre les infections
Le microbiote s’avère également indispensable au système immunitaire. Bien sûr, il lutte contre l’implantation dans l’intestin d’intrus nuisibles. Mais « “il arme” aussi à distance les poumons contre les infections virales et bactériennes. Et ce en libérant diverses molécules comme des fragments de bactéries ou des métabolitesFermerProduits de transformation d’un corps organique au sein d’une cellule, d’un tissu ou du milieu sanguin., en particulier les acides gras à chaîne courte, commente François Trottein, du Centre d’infection et d’immunité de Lille3. La recherche réunit de plus en plus de preuves de l’influence du microbiote intestinal sur l’immunité pulmonaire ». Tandis que les bactéries intestinales synthétisant la vitamine B2 sécrètent aussi un métabolite indispensable au développement d’un type-clé de globules blancsFermer(Ou leucocytes) Cellules du sang, et du tissu lymphoïde, capables de se déplacer dans les différents tissus pour participer à la défense immunitaire contre les agents pathogènes (bactéries, virus, etc.). Il existe trois principaux types de globules blancs : les polynucléaires, les lymphocytes et les monocytes.. « Il s’agit des cellules MAIT (Mucosal Associated Invariant T). Ce sont des lymphocytes T FermerCatégorie de globules blancs qui jouent un rôle important dans la réponse immunitaire adaptative (activée suite à la reconnaissance d’agents infectieux par le système immunitaire inné). Ils permettent de détruire les cellules infectées par un virus, les cellules cancéreuses reconnues étrangères à l’organisme, etc. via des mécanismes complexes. particuliers qui participent à la défense contre les agents pathogènes dans la muqueuse intestinale et qui sont également très présents dans le sang, le foie, les poumons, le tissu adipeux, le pancréas… » ajoute Agnès Lehuen, directrice de l’équipe Immunologie du diabète à l’Institut Cochin4.
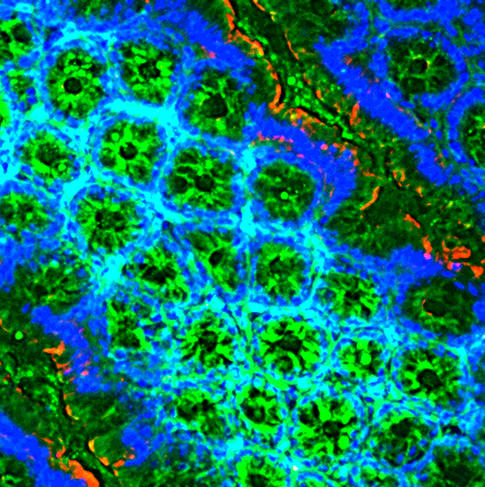
Un intermédiaire dans le dialogue entre l'intestin et le cerveau
Autre champ d’intenses investigations : les relations entre l’intestin et le cerveau. Le dialogue qu’entretiennent en permanence l’écosystème intestinal et notre matière grise, par la voie sanguine, immunitaire ou nerveuse, nourrit en effet quantité de découvertes. Par exemple, des neurobiologistes ont récemment démontré chez la souris, grâce à des techniques d’imagerie cérébrale, que des composants du microbiote agissent sur une zone cérébrale régulant l’appétit.
« Lorsque nous mangeons, des fragments de bactéries intestinales (appelés muropeptides) passent dans le sang au bout de quelques minutes et se dirigent vers le cerveau, explique Pierre-Marie Lledo, directeur du Laboratoire perception et mémoire5. Après avoir franchi différentes barrières, ils sont détectés par un récepteur6 présent à l’intérieur des cellules, en particulier les cellules immunitaires, qui met au repos des neurones situés dans l'hypothalamus et contrôlant la faim. En clair, résume le chercheur, le microbiote intestinal envoie au cerveau un signal de satiété par l’intermédiaire de composés bactériens ».
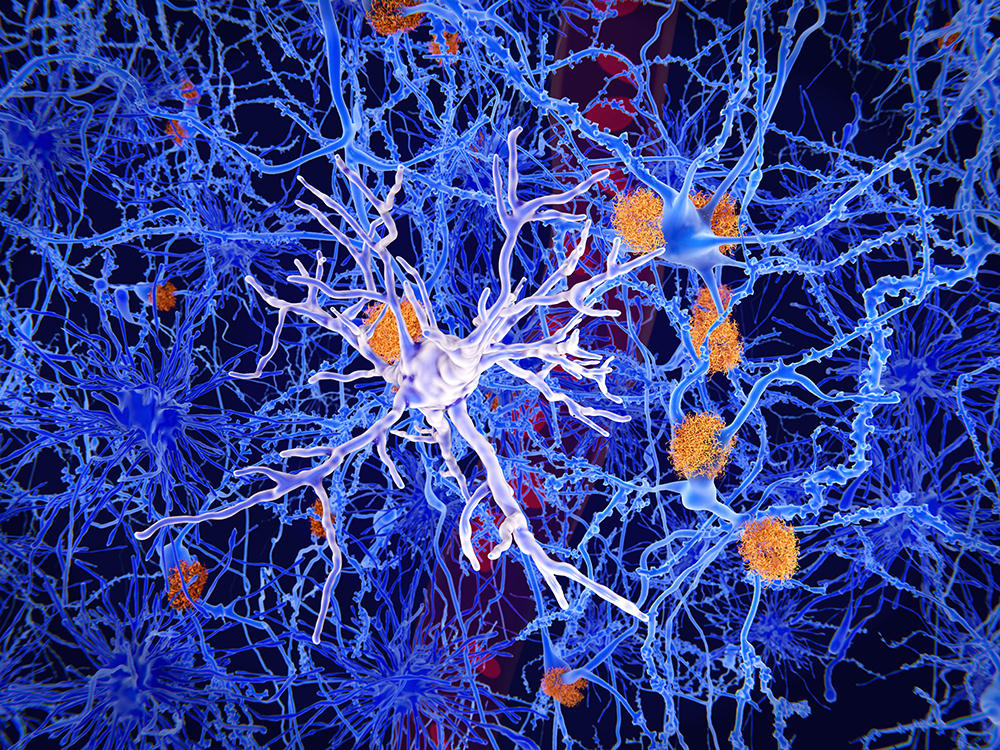
Les microgliesFermerCellules du cerveau de forme étoilée et de petite taille, faisant partie des cellules entourant et protégeant les neurones (cellules gliales ou glie). Elles peuvent se mouvoir, ingérer des particules étrangères (capacités phagocytaires) et ont pour rôle d’assurer l’immunité du système nerveux., cellules immunitaires du cerveau qui le protègent des lésions et des infections, montrent elles aussi des liens avec le microbiote. Ces cellules, qui participent à l’élagage des neurones et des connexions surnuméraires, colonisent le parenchyme cérébral pendant le développement fœtal. Les chercheurs les ont étudiées chez les souris axéniques.
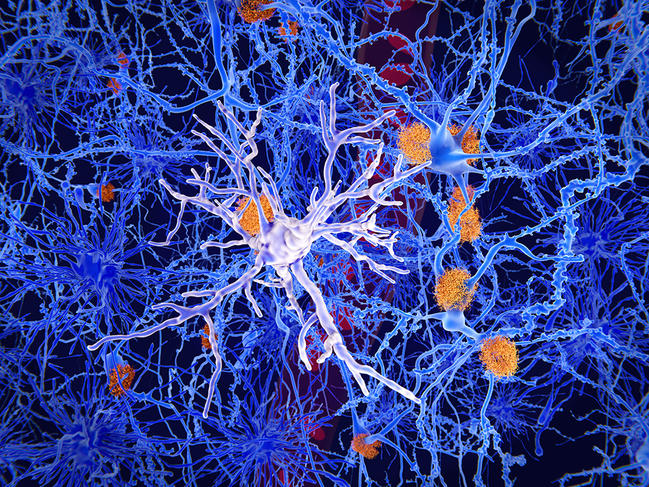
Résultat : « les microglies de leurs embryons sont affectées par l’absence de microbiote maternel durant la gestation, et ce davantage chez les embryons mâles, indique Morgane Thion, de l’Institut de biologie de l’École normale supérieure7. Mais une fois ces embryons parvenus au stade adulte, ce sont surtout les souris femelles qui voient leurs microglies altérées. Ce dimorphisme sexuel, encore peu compris, fait écho à celui observé dans certaines pathologies associées à des dysfonctions microgliales : par exemple, nombre de troubles du neurodéveloppement sont plus élevés chez les hommes, alors que d’autres pathologies auto-immunes ou neurodégénératives, comme la maladie d’Alzheimer, sont prévalentes chez les femmes ».
Un rôle clé face aux virus et maladies auto-immunes ?
Une pléthore d’études cliniques et expérimentales scrute aussi les liens entre dysbiose (déséquilibre de la flore intestinale) et maladie, à commencer par la grippe et le Covid-19. « On savait que les infections respiratoires d’origine virale perturbent la composition et la fonctionnalité du microbiote intestinal, explique François Trottein. De manière générale, l’infection provoque un appauvrissement des bactéries bénéfiques (Actinobacteria, Bifidobacteria, Faecalibacterium prausnitzii…) et une augmentation des bactéries délétères (Escherichia, Shigella, Prevotella…). Nos travaux récents sur la grippe montrent que, parallèlement aux troubles locaux (douleurs abdominales, diarrhées, rupture de l’intégrité de la barrière intestinale…), la dysbiose intestinale peut amoindrir les défenses au niveau pulmonaire et entraîner une surinfection bactérienne des poumons ».
D’où l’idée de renforcer préventivement le microbiote des sujets les plus sensibles aux infections respiratoires aiguës (personnes âgées, individus présentant des comorbidités, etc.). « La prise de compléments alimentaires enrichis en fibres végétales afin de nourrir nos bonnes bactéries, de même que l’administration de probiotiquesFermerMicro-organismes vivants (bactéries ou levures), étrangers à l’organisme, naturellement présents dans certains aliments fermentés (yaourts, laits fermentés, choucroute…), et ayant un effet positif sur la santé., permettrait de limiter la gravité de telles infections, surtout si on fait reposer cette stratégie sur l’analyse du microbiote intestinal dans les populations à risque », plaide François Trottein.

De multiples études soulignent par ailleurs l’importance de la flore intestinale dans le champ des maladies auto-immunes, dysfonctionnements conduisant le système immunitaire à s’attaquer aux constituants normaux de l’organisme. En ligne de mire notamment : la maladie de CrohnFermerMaladie inflammatoire chronique de l’intestin (Mici) pouvant toucher tout le tube digestif, de la bouche à l’anus. Le plus souvent, elle atteint la partie terminale de l’intestin grêle qui relie l’estomac au côlon, le côlon et l’anus. Elle est favorisée par des prédispositions génétiques, des facteurs environnementaux et un dysfonctionnement du système immunitaire., la polyarthrite rhumatoïdeFermerMaladie inflammatoire chronique des articulations évoluant par poussées. C’est une maladie auto-immune, mais plusieurs facteurs immunologiques, génétiques, hormonaux, environnementaux... sont nécessaires pour qu’elle se déclenche. et le diabète de type 1. Dans le cadre de ce dernier, le système immunitaire s’attaque à certaines cellules du pancréas qui produisent l’insuline. Or l’insuline est l’hormone qui permet aux cellules de stocker le glucose.
Ce glucose, non pris en charge, se retrouve en excès dans le sang et provoque une hyperglycémie chronique qui condamne les patients à des injections d’insuline pour le reste de leur vie. « On sait aussi que les cellules du système immunitaire (lymphocytes T) qui s’attaquent aux cellules pancréatiques peuvent migrer dans l’intestin et y déclencher une inflammation qui altère la composition du microbiote, indique Agnès Lehuen. Les bactéries filamenteuses segmentées, connues pour stimuler l’ensemble du système immunitaire, diminuent alors fortement. » Résultat : l’inflammation de la barrière intestinale et celle du pancréas s’amplifient mutuellement et endommagent les deux organes, dommages qui contribuent aux réactions immunitaires anormales justement à l’origine du diabète de type 1.
Comment enrayer ce cercle vicieux ? « De nouvelles stratégies thérapeutiques s’appuient sur la manipulation du microbiote (administration de probiotiques, transplantation fécale autologueFermerOpération consistant à administrer dans le tube digestif du patient une préparation obtenue à partir de ses propres selles.…). Ces approches, à risque limité, pourraient améliorer la prise en charge de la maladie, estime Agnès Lehuen. Elles sont actuellement testées dans plusieurs essais cliniques internationaux de phases 1 et 2. »



Régime alimentaire et dépression
D’autres chercheurs tentent de percer les relations entre anomalies du microbiote et troubles neuropsychiatriques comme la schizophrénie, l’autisme ou la dépression. C’est la psychomicrobiotique, domaine d’étude en plein essor. Plus personne ne doute aujourd’hui que la sérotonine, un neurotransmetteur impliqué dans la gestion des humeurs et associé à l’état de bien-être, est produite à plus de 90 % par les bactéries grouillant dans l’intestin. Ni qu’un déséquilibre de cette population, induit par un stress chronique, provoque un effondrement des endocannabinoïdesFermerMolécules qui se fixent sur les mêmes récepteurs cellulaires que le THC, la substance active du cannabis. dans le sang et le cerveau.
« Nous avons découvert il y a peu8, chez la souris, que l’absence de ces molécules dans l’hippocampe, une petite structure cérébrale intervenant dans la formation des souvenirs et des émotions, entraîne des comportements dépressifs, commente Pierre-Marie Lledo. Ces troubles disparaissent quand on complémente l’alimentation des souris déprimées en lactobacilles, une famille de bactéries intestinales. Celles-ci favorisent l’absorption par le microbiote de l’acide arachidonique, un acide gras polyinsaturé présent dans les œufs, le poisson, la viande de poulet ou de bœuf, et précurseur des endocannabinoïdes. Il est très probable que, dans un délai raisonnable, une modification du régime alimentaire, couplé ou non à un apport de prébiotiquesFermerComposés nutritifs, principalement des glucides, et plus précisément des oligosaccharides (fructoses, galactoses, glucose…) et des polysaccharides (cellulose, amidon), présents dans les fibres et propices à la croissance et à l’activité des micro-organismes intestinaux bénéfiques., de probiotiques ou de postbiotiquesFermerMétabolites sécrétés par les probiotiques et responsables de leurs effets bénéfiques (acides gras à courte chaîne, vitamines, peptides, enzymes…)., apportera un réel bénéfice contre la dépression. ».
Obésité, maladies cardiovasculaires, allergies, maladies neurodégénératives, cancers… sont également corrélés à une dysbiose, que celle-ci en soit la cause ou la conséquence. Conjuguer traitements classiques et interventions visant à rétablir un bon fonctionnement du microbiote pourrait donc prochainement se généraliser. Par exemple, tout indique que la réponse à certaines chimiothérapies et aux immunothérapiesFermerTraitements destinés à « booster » le système immunitaire en vue de lutter contre le cancer. dépend de la composition de la flore intestinale (dont une bonne part de la composition est propre à chaque individu). Des études visant à compléter la liste des bactéries en cause et développer des outils pour améliorer la réponse antitumorale des patients sont en cours. Et le microbiote nous réserve sans doute encore de nombreuses bonnes surprises médicales. De quoi aiguiser un peu plus l’appétit des labos pour le plus grand réservoir de bactéries de l’organisme ! ♦
À lire aussi sur notre site :
Comment le microbiote influe sur notre santé (audio)
Les nouvelles frontières du vivant
Le vivant a sa matière noire
Microbiote : des bactéries qui nous veulent du bien
- 1. Unité CNRS/ENS de Lyon/Université Claude Bernard Lyon 1/Inrae.
- 2. “Lactobacillus plantarum strain maintains growth of infant mice during chronic undernutrition”, M. Schwarzer, K. Makki, G. Storelli et al., Science, 351(6275):854-7, 19 février 2016. DOI: 10.1126/science.aad8588
- 3. Unité CNRS/Inserm/Université de Lille/CHU Lille/Institut Pasteur de Lille.
- 4. Unité CNRS/Inserm/Université Paris Cité.
- 5. Unité CNRS/Institut Pasteur.
- 6. Ce récepteur s’appelle Nod2 ou Nucleotide Oligomerization Domain.
- 7. Unité CNRS/ENS-PSL/Inserm.
- 8. "Effect of gut microbiota on depressive-like behaviors in mice is mediated by the endocannabinoid system", G. Chevalier, E. Siopi, L. Guenin-Macé et al., Nature Communications, 11 décembre 2020. En ligne
Voir aussi
Auteur
Philippe Testard-Vaillant est journaliste. Il vit et travaille dans le Sud-Est de la France. Il est également auteur et coauteur de plusieurs ouvrages, dont Le Guide du Paris savant (éd. Belin), et Mon corps, la première merveille du monde (éd. JC Lattès).