Vous êtes ici
Quelle éthique pour les ciseaux génétiques ?

Peut-on toucher au génome humain ? La question ne cesse d’être posée depuis les années 1990 avec l’arrivée des thérapies géniques. Pourtant, elle est en passe de prendre aujourd’hui une dimension totalement nouvelle, avec l’émergence, en 2013, de l’édition génomique. Les outils TALEN1, ZFN2 et bien sûr CRISPR-Cas9 permettent de couper, à la base près, des séquences d’ADN choisies. Grâce à cette chirurgie du génome, il devient possible d’inactiver ou de supprimer n’importe quel gène, voire de le remplacer par un autre.
Parmi ces trois outils d’ingénierie génomique, CRISPR est roi. Alors que les TALENs et les ZFNs font intervenir une protéine reconnaissant l’ADN à couper, CRISPR, lui, identifie directement l’ADN, grâce à un ARN guide. À titre d’exemple, il faut plusieurs mois pour développer une ZFN spécifique à un gène, contre quelques heures pour un CRISPR… « C’est beaucoup plus simple ! Il suffit de synthétiser un ARN complémentaire à l’ADN que l’on souhaite cibler, c’est facile à obtenir et à utiliser », précise Carine Giovannangeli, directrice de recherche en biologie moléculaire au laboratoire Structure et instabilité des génomes3.
Une technique au succès fulgurant
Plus précis, plus rapides et surtout moins chers que les thérapies géniques classiques, les CRISPR se sont répandus comme une traînée de poudre dans les laboratoires du monde entier. « Désormais, les chercheurs utilisent presque exclusivement le système CRISPR-Cas9 », précise Carine Giovannangeli, qui développe des outils d’ingénierie génomique au sein de l’équipe TACGENE. En à peine deux ans d’existence, les CRISPR comptabilisent déjà un millier d’études publiées. Et des millions d’euros investis dans des start-up ou des projets de recherche. « La technique va plus vite que la recherche fondamentale », ajoute Patrick Gaudray, directeur de recherche en génomique au sein de l’unité Génétique, immunothérapie, chimie et cancer4 et membre, de 2008 à 2016, du Comité consultatif national d’éthique.
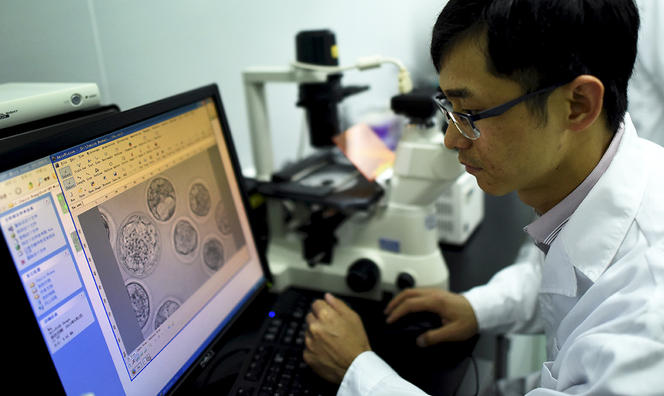
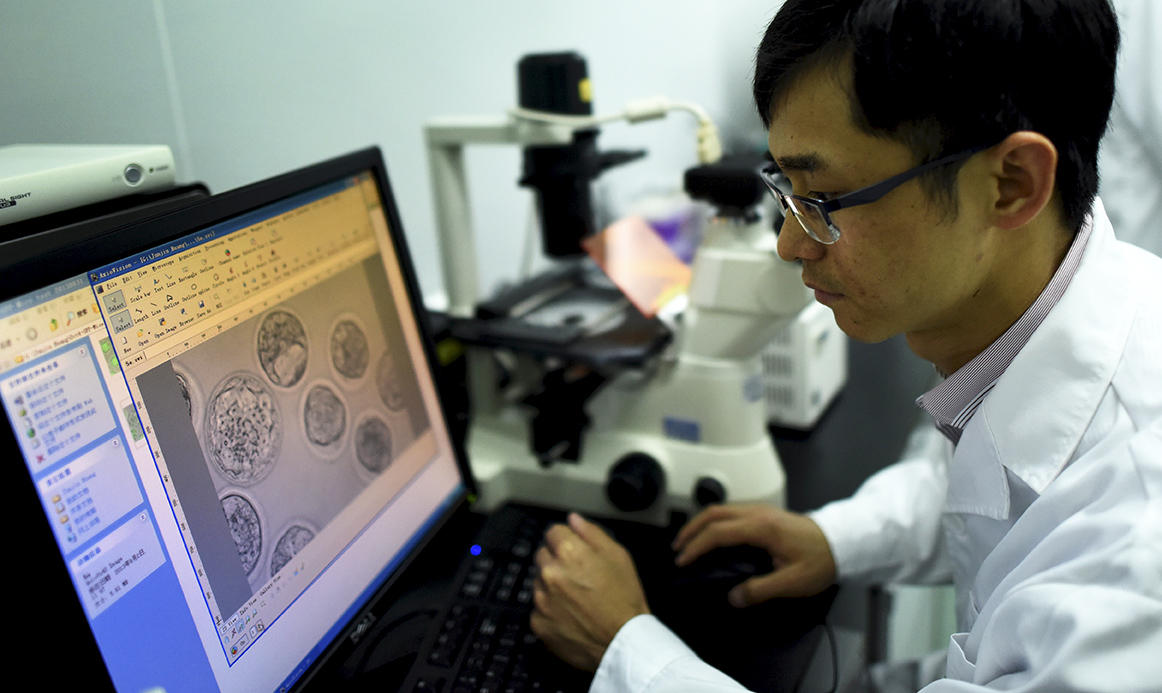
En avril 2015, la question cesse d’être théorique avec la publication d’une étude chinoise expérimentale. Les chercheurs ont utilisé ces ciseaux moléculaires pour modifier l’ADN d’embryons humains atteints d’une maladie monogénique : la bêta-thalassémie. Dès lors, impossible d’ignorer les interrogations éthiques soulevées par l’ingénierie du génome. A-t-on le droit de modifier le génome d’embryons humains et ainsi celui de générations futures ? Comment contrôler ces nouveaux organismes génétiquement modifiés par cette technique ? Autant de questions auxquelles la société civile et le monde de la recherche vont devoir répondre rapidement. « Il n’y a pas que l’aspect bénéfice-risque qui compte, il faut aussi voir ce qui est compatible avec les valeurs sociales sur lesquelles est fondée notre société », indique Anne Cambon-Thomsen, médecin, directrice de recherche émérite5 et experte auprès du comité d’éthique du CNRS. Elle préside également la Société française de génétique humaine, société qui a mis en place un groupe de réflexion interdisciplinaire sur ces questions.
Fondamentalement, l’ingénierie génomique ne pose aucune question nouvelle par rapport la thérapie génique, qui consiste à introduire un gène « médicament » dans un organisme. Et pourtant : « CRISPR permet un véritable saut technologique, un changement d’échelle. Parce qu’il est simple et peu cher, il ouvre à tous des capacités encore inexplorées », ajoute Anne Cambon-Thomsen, qui analyse les enjeux sociétaux des biotechnologies appliquées à la santé. « CRISPR fait un peu caisse de résonance. Mais, en fin de compte, il n’existe pas de rupture quant aux possibilités d’applications thérapeutiques », précise Patrick Gaudray.
Crispations autour de la modification d’embryons
Les inquiétudes médiatiques et sociétales autour des CRISPR se cristallisent principalement sur la modification d’embryons humains et la transmission à la descendance, « car c’est irréversible », souligne Anne Cambon-Thomsen. En mai dernier, un sondage commandé par l’association conservatrice et anti-avortement Alliance Vita présentait 76 % des Français comme défavorables à cette modification génétique. « Mais on n’a pas attendu CRISPR pour se poser ces questions », informe Patrick Gaudray. Et effet, en la matière, les règles sont claires depuis une vingtaine d’années. En 1997, la France signe, avec 28 autres pays, la convention d’Oviedo, ratifiée en 2011. Celle-ci interdit, entre autres, de pratiquer des modifications génétiques transmissibles à la descendance. Actuellement, les thérapies géniques, tout comme les CRISPR, ne peuvent être utilisées que pour une application thérapeutique sur les cellules somatiques, du foie ou des muscles par exemple.
envisageable
de reposer
la question de
la modification
génétique des
embryons dans un
but thérapeutique.
« On nage dans les ambiguïtés », souligne Patrick Gaudray. Alors que les chercheurs ont la possibilité d’utiliser des CRISPR pour provoquer des mutations dans les cellules germinales comme les spermatozoïdes ou les ovules, « ils n’ont pas le droit de fabriquer un embryon pour vérifier ce qu’ils ont fait », ajoute Anne Cambon-Thomsen. La recherche utilise en général des embryons issus de projets parentaux abandonnés. « En éthique, il faut savoir s’adapter. Il pourrait être envisageable de reposer la question de la modification génétique des embryons dans un but thérapeutique, ou au moins d’envisager quelques exceptions », suggère le médecin. Une chose est sûre : les applications thérapeutiques des CRISPR soulèvent d’immenses espoirs. « Les patients poussent pour qu’on les utilise, car ils sont motivés par le bénéfice possible sur leur maladie », indique Anne Cambon-Thomsen.
Un procédé sûr et efficace ?
L’édition génomique est en passe de bouleverser le monde de la santé, et de nombreuses applications thérapeutiques sont en cours de développement. En particulier contre les maladies dont les gènes sont bien identifiés, comme la myopathie de Duchenne. Cette dystrophie musculaire est en effet liée à une anomalie du gène DMD. En décembre dernier, plusieurs équipes de recherche ont démontré, dans Science, qu’il était possible, chez la souris, d’introduire un CRISPR dans le muscle pour venir modifier le gène déclenchant de la maladie. Résultats : les souris retrouvaient de la force musculaire ! VIH, leucémie ou encore mucoviscidose, les CRISPR sont expérimentés sur de nombreuses autres maladies.
Il reste cependant une poignée d’obstacles techniques à franchir avant d’envisager la commercialisation de traitements chez l’homme. Les CRISPR peuvent par exemple manquer leur cible et couper un autre gène que celui désiré. Cependant, ces effets dits « off-target » deviennent de mieux en mieux prévisibles informatiquement. « Des outils bio-informatiques sont disponibles aujourd’hui pour identifier les séquences qui ressemblent beaucoup à la cible et pour prédire, limiter, voire éviter, ces cassures indésirables. De plus, des améliorations du système CRISPR-Cas9 ont permis récemment de diminuer fortement ces effets hors cible », explique Carine Giovannangeli. Si, en recherche fondamentale, les effets off-target ne présentent finalement que peu de risque, en clinique, les enjeux sont tout autres… Que faire si, au lieu de supprimer un gène « malade », le traitement élimine un gène indispensable au fonctionnement du système immunitaire par exemple ? « La sécurité doit être assurée, mais ce n’est sans doute qu’une question de temps avant d’y arriver », ajoute Patrick Gaudray. Depuis 2013, des protéines Cas9 de plus en plus performantes et spécifiques sont régulièrement mises sur le marché.
« Une autre question à régler, en particulier dans le cadre d’applications thérapeutiques, est celle de la délivrance du système CRISPR-Cas9. En général, on va cibler des organes que l’on sait atteindre, comme les yeux, le foie ou les muscles », précise Carine Giovannangeli. Il pourrait également être possible d’administrer ce bistouri génétique à l’aide d’un virus, ou directement en sortant les cellules de l’organisme pour les réimplanter une fois modifiées… Une utilisation sûre et efficace des CRISPR chez l’homme reste donc encore à développer. Par ailleurs, « il ne faut pas exagérer les conséquences que peuvent avoir les gènes sur certaines pathologies multifactorielles. Ce serait une dérive scientifiquement non justifiée qui pourrait être utilisée par des compagnies privées notamment pour faire du profit, sans résultats pertinents », met en garde Anne Cambon-Thomsen.
Le génome, un patrimoine sacré ?
En définitive, derrière la question de l’embryon humain se cache celle de la valeur qu’accorde notre société au génome. « Est-ce qu’on considère que le gène est une valeur en soi, sacrée ?, s’interroge Anne Cambon-Thomsen. Dans ce cas, on n’y touche pas. »
ensuite de vouloir
modifier des gènes
qui codent pour
un trait n’ayant
rien à voir avec
une maladie,
comme la couleur
des yeux.
Sur ce point, deux camps s’opposent. D’un côté, pour une majorité, le génome doit être considéré comme le fruit d’un héritage commun à préserver. Ce patrimoine, résultat d’années d’évolution humaine, ne doit donc en aucun cas être corrompu par l’intervention d’outils biotechnologiques dont nous contrôlons encore mal la portée. D’un autre côté, les partisans de l’homme augmenté considèrent que la nature a parfois besoin d’un coup de pouce pour supprimer ou corriger ses imperfections.
Cette approche transhumaniste recèle cependant des dérives potentiellement graves. « Le risque serait ensuite de vouloir modifier des gènes qui codent pour un trait n’ayant rien à voir avec une maladie, comme la couleur des yeux », avertit Anne Cambon-Thomsen. Les CRISPR deviendraient alors des outils privilégiés d’une forme d’eugénisme, allant à l’encontre des principes fondamentaux de justice et d’égalité entre les hommes.
Des outils capables de détruire une espèce
Comme toute découverte révolutionnaire, les CRISPR brassent derrière eux leur lot de polémiques, à commencer par la question de la propriété intellectuelle. D’un côté, les chercheuses Jennifer Doudna et Emmanuelle Charpentier revendiquent depuis 2012 la paternité de la découverte du mécanisme spécifique de CRISPR-Cas9. De l’autre, une seconde demande de brevet, déposée par Feng Zhang, a été déposée en 2013, briguant l’application des CRISPR sur les cellules mammifères. « Mais, derrière ces figures médiatiques, il ne faut pas oublier toute la démarche scientifique en amont impliquant des chercheurs de tous horizons », rappelle Patrick Gaudray. Depuis 2013, une dizaine d’entreprises spécialisées dans les CRISPR ont été créées.
Selon Patrick Gaudray, la question cruciale autour des CRISPR reste celle des applications non humaines. « Nous avons désormais des outils à portée de main qui permettraient de faire disparaître une espèce », souligne-t-il, faisant référence à une expérience de 2015 qui avait rendu stérile le moustique tigre, à l’aide des CRISPR, pour limiter la transmission de la dengue. « L’éradication du moustique est une réalité totalement envisageable aujourd’hui ! Les approches techno-centrées sont-elles justifiées, sachant qu’on affecte de manière irréversible la biodiversité ? », s’interroge le chercheur. Cette vision utilitariste est, en tout cas, déjà de mise aux États-Unis, où la Food and Drug Administration a autorisé la commercialisation de champignons de Paris modifiés, via des CRISPR, pour ne jamais noircir. A-t-on réellement besoin de modifier durablement ces organismes vivants dans un tel but ?
Quand l’éthique se confronte au marché
OGM ? Thérapie innovante ? La définition des objets issus des CRISPR n’est pas encore établie. Seule certitude : « Les grandes entreprises vont breveter à tout-va le moindre gène modifié, sans que cela ne leur coûte beaucoup d’argent », indique Patrick Gaudray. Les CRISPR amplifient ainsi le débat sur la brevetabilité du vivant. « Est-ce qu’un agriculteur devra payer une firme s’il voit la mutation apparaître spontanément dans son champ ? », ironise Patrick Gaudray. Si le débat éthique est indispensable, il pâtit de pressions industrielles conséquentes. « La pression induite par la peur de perdre des parts de marché ne doit pas être un obstacle à l’évaluation éthique des applications de la méthode », écrit ainsi l’Inserm dans une saisine sur la question.
« Nous sommes face à un modèle économique et social dans lequel les décisions sont prises en majorité par les lobbies qui ne représentent pas la société dans son ensemble », déplore Patrick Gaudray, encourageant à « un vrai débat de société intelligent autour de l’ingénierie du génome, qui intègre scientifiques, société civile, citoyens, mais sans oppositions de principe ». Des groupes de travail dirigés par deux sociétés savantes6 ont d’ailleurs été formés dans ce but. Carine Giovannangeli évoque, quant à elle, la mise en place d’« un cahier des charges et de standards à adapter en fonction des applications ». Concernant les CRISPR, la décision finale sera, dans tous les cas, tranchée au niveau législatif.
- 1. Transcription activator-like effector nuclease.
- 2. Zinc-finger nuclease.
- 3. Unité CNRS/Inserm/MNHN.
- 4. Unité CNRS/Univ. François-Rabelais Tours.
- 5. Unité Épidémiologie et analyses en santé publique (Inserm/UPS).
- 6. Société française de génétique humaine et Société française de thérapie cellulaire et génétique.
Voir aussi
Auteur
Léa Galanopoulo est journaliste scientifique indépendante.