Vous êtes ici
Contre le VIH, la recherche sur tous les fronts

Depuis la découverte du VIHFermervirus de l'immunodéficience humaine en 1983, le statut de la maladie a considérablement évolué. Maladie mortelle dans les années 1980, le sidaFermersyndrome d’immunodéficience acquise est devenu, depuis la mise sur le marché des trithérapies en 1996, une maladie chronique pour les personnes ayant la possibilité d’accéder au traitement – soit la moitié des 37 millions de personnes séropositives dans le monde. Cette combinaison d’au moins trois molécules antirétrovirales a permis de lutter efficacement contre le virus, en contrôlant l’une de ses principales caractéristiques : son extrême mutabilité. Mieux, les trithérapies évitent que les personnes séropositives ne transmettent le VIH et constituent de ce fait un outil de prévention à part entière.
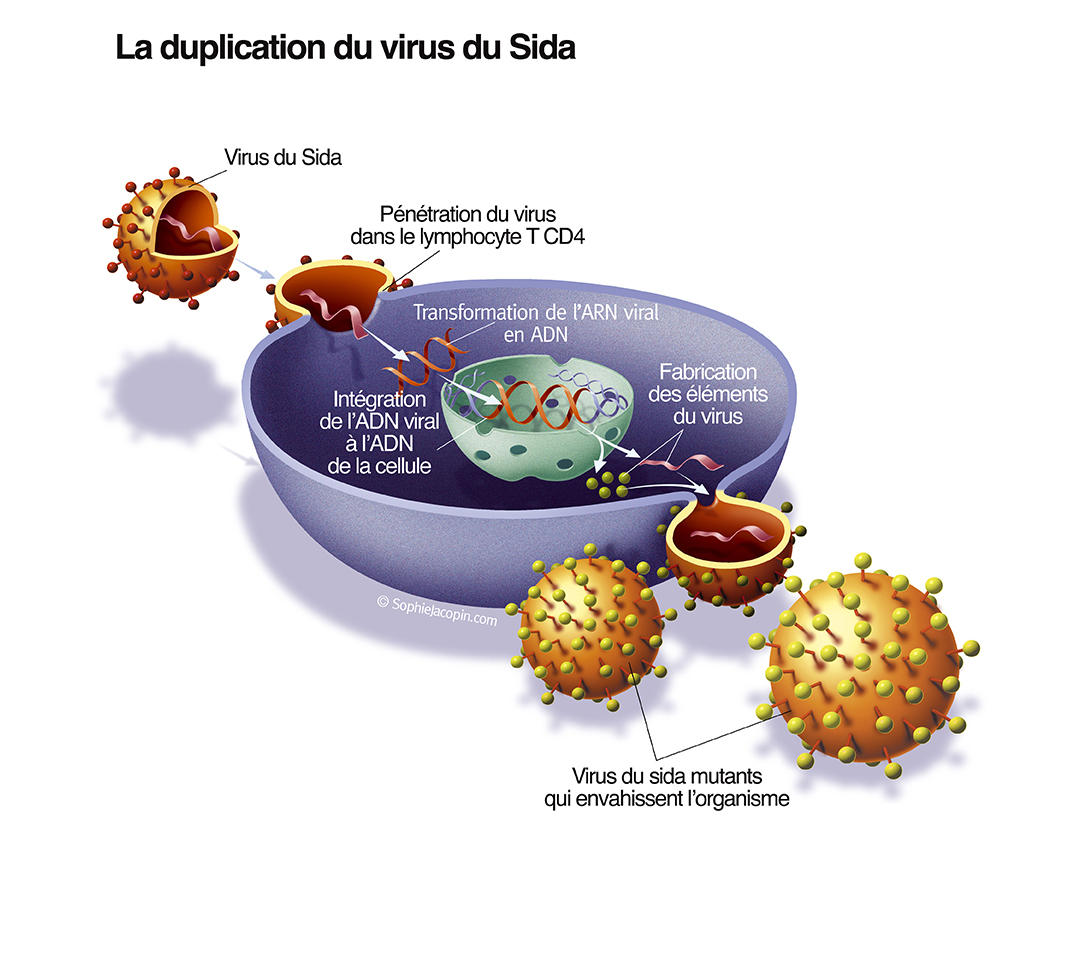
Le VIH est un rétrovirusFermerLes rétrovirus possèdent une enzyme appelée « transcriptase inverse » qui leur permet de transformer leur ARN en ADN et de s’insérer ainsi dans l’ADN des cellules qu’ils infectent. qui infecte certaines cellules du système immunitaire de l’organisme hôte, majoritairement les lymphocytes T CD4 +, qu’il utilise pour se multiplier et se propager. Au bout de plusieurs années (jusqu’à dix ans parfois), la charge virale (nombre de copies du virus dans le sang) explose et les lymphocytes T qui protègent l’organisme des agressions extérieures sont massivement détruits. D’où une forte sensibilité à certains cancers et aux infections opportunistes (tuberculose, maladie de Kaposi, etc.) d’ordinaire contrôlées par le système immunitaire.

Vingt ans après l’apparition des trithérapies, l’arsenal des traitements antirétroviraux disponibles (25 à 30 molécules), l’amélioration de leur efficacité et la réduction de leurs effets secondaires permettent à la majorité des patients traités de vivre normalement. Grâce aux antirétroviraux, la réplication du virus est bloquée et la charge virale maintenue au-dessous de 200 copies par millilitre de sang. Sous ce seuil, le risque de maladies associées et de transmission du virus est infime. Résultat : les patients précocement diagnostiqués et qui suivent le traitement – un comprimé par jour, à vie – ont aujourd’hui une espérance de vie équivalente à celle de la population générale.
La traque des réservoirs viraux
Pour autant, ces avancées notables ne concernent que les traitements existants. L’objectif numéro un des scientifiques est désormais l’éradication complète du virus chez les personnes séropositives. Pour ce faire, ils s’intéressent à un processus spécifique du VIH : sa mise en dormance, dès les premières heures de l’infection, dans certaines cellules du système immunitaire, appelées alors « réservoirs ». Ce véritable archivage du virus, tandis qu’il continue de se répliquer, c’est LA spécificité du VIH et ce qui le rend si difficile à combattre. « Guérir du sida ne sera possible que si nous parvenons à maîtriser ces réservoirs viraux, soit en les éliminant, soit en les empêchant d’exprimer le virus », explique Monsef Benkirane, directeur de l’Institut de génétique humaine1 à Montpellier.
Lorsque la personne séropositive est mise sous traitement antirétroviral, le virus n’est en effet plus détecté dans le sang, mais reste présent dans ces réservoirs sous une forme précurseur (provirus) indécelable par le système immunitaire et insensible au traitement. C’est ce qui explique le rebond de la charge virale observé en cas d’arrêt du traitement et l’obligation pour les patients de s’y tenir quotidiennement et à vie.
Plusieurs stratégies sont aujourd’hui à l’étude pour venir à bout des réservoirs. L’une d’elle consiste à réactiver le virus « caché » pour lui redonner sa forme visible par le système immunitaire qui pourrait alors mieux le contrôler – une piste qui impose au préalable de comprendre les mécanismes moléculaires qui régulent la mise en sommeil du virus et sa réactivation. Car si la connaissance de ces processus a beaucoup progressé ces dernières années, les essais thérapeutiques qui en ont découlé n’ont pas été concluants. Autre stratégie envisagée, plus futuriste : retirer l’ADN viral intégré dans l’ADN des cellules réservoirs par thérapie génique, notamment à l’aide des nouveaux outils de type CRISPR, ces « ciseaux moléculaires » capables de découper sélectivement des séquences du génome.

Une troisième piste vise, elle, à tuer les cellules réservoirs, mais cela nécessite de pouvoir les différencier des cellules immunitaires saines. C’est dans ce domaine, investi par de nombreuses équipes au niveau mondial, que Monsef Benkirane et ses collègues de l’Institut de génétique humaine ont franchi une étape décisive2 au printemps 2017 en identifiant le premier marqueur de surface spécifique des réservoirs. Un résultat qui laisse entrevoir la possibilité d’isoler directement les cellules réservoirs chez les patients et, au-delà, de déployer de nouvelles stratégies thérapeutiques.
Vaccin : des pistes prometteuses
Guérir définitivement du sida est un objectif, ne pas le contracter en est un autre. Après des années de recherche et de fausses annonces, la mise au point d’un vaccin préventif continue de mobiliser les chercheurs. « Le principe de la vaccination classique, qui repose sur l’injection d’une forme atténuée du virus pour stimuler la réponse immunitaire, est inefficace dans le cas du VIH en raison de sa grande capacité à muter (le virus est présent en de multiples versions), explique Vincent Vieillard, chercheur au Centre d’immunologie et des maladies infectieuses3 à Paris. Le développement d’un vaccin antisida impose de trouver des stratégies inédites. »
Si un essai clinique sur près de 6 000 personnes est en cours en Afrique du Sud, il ne concerne que certaines formes du virus présentes exclusivement en Afrique australe et ne garantirait qu’une efficacité limitée (taux espéré de 50 %). Mais d’autres pistes sont porteuses d’espoir, comme celle des anticorps dits neutralisants retrouvés chez un petit nombre de patients et qui sont capables de contrôler simultanément de nombreuses versions du virus. Aux États-Unis, des essais d’injection directe de ces anticorps ont conduit à de bons résultats chez le singe et l’humain.
« L’enjeu aujourd’hui est de parvenir à générer ce type d’anticorps chez des personnes saines pour les prémunir de l’infection », indique Arnaud Moris, chercheur au Centre d’immunologie et des maladies infectieuses. Pour ce faire, les scientifiques étudient les interactions entre ces anticorps et l’enveloppe du virus afin de concevoir des immunogènes – des molécules qui simulent des protéines de l’enveloppe virale et qui, identifiées comme éléments étrangers par l’organisme, déclenchent une réponse immunitaire et la production d’anticorps. Certains de ces anticorps sont en cours d’essais cliniques.
La stratégie de vaccination est aussi évaluée en association au traitement antirétroviral pour renforcer le système immunitaire de patients infectés : cette vaccination dite thérapeutique pourrait pallier la moindre efficacité des traitements observée chez une petite fraction de patients.
Enfin, toujours dans le domaine vaccinal, une autre population de patients hors normes interpelle les chercheurs : les « elite controller » ou « contrôleurs d’élite », qui représentent moins de 1 % des patients. Infectés et non traités, ils contrôlent naturellement l’infection et maintiennent une charge virale durablement indétectable. De nombreuses études cherchent à expliquer les mécanismes spécifiques de cette exceptionnelle immunité, qui pourraient, à terme, fournir de nouveaux outils pour la vaccination.
Au cœur des mécanismes moléculaires
Pour venir à bout du VIH, les scientifiques s’attachent également à mieux comprendre les interactions du virus avec la cellule qu’il infecte ou avec le système immunitaire. Le but est double : améliorer la connaissance fondamentale des processus biologiques à l’échelle moléculaire et définir de nouvelles cibles thérapeutiques. « Si, globalement, les essais cliniques actuels visant à réactiver le virus caché piétinent, c’est parce que nous avons atteint une limite, analyse Stéphane Emiliani, chercheur à l’Institut Cochin. Nous sommes confrontés à un manque flagrant de connaissances sur les mécanismes moléculaires du virus et en particulier ceux qui régissent son intégration, sa mise en dormance et son expression. » Un vrai défi si l’on considère l’hétérogénéité des modes d’intégration et d’expression que le virus est capable de développer au gré de ses mutations.
Avec son équipe, Stéphane Emiliani étudie différentes étapes du cycle de réplication du virus, notamment l’insertion du génome viral dans l’ADN cellulaire et son expression. Les chercheurs ont ainsi identifié la protéine de la cellule hôte qui interagit avec l’enzyme du virus (l’intégrase) permettant cette insertion. Ces travaux brevetés sont à l’origine du développement, par une société de biotechnologie, de nouvelles molécules bloquant l’interaction entre l’intégrase et cette protéine cellulaire. En cours d’étude préclinique, cette stratégie offrirait une alternative aux molécules antirétrovirales existantes qui, elles, bloquent l’activité de l’enzyme, et constituerait ainsi une parade face aux problèmes de résistance dus à la mutabilité du virus.
Sur le front du système immunitaire, des chercheurs s’intéressent de près à des molécules naturellement produites pour combattre le VIH : les interférons, de puissants antiviraux. Problème : produits sur une longue durée, comme c’est le cas dans les maladies chroniques auto-immunes et le sida, ces agents protecteurs finissent par détruire les autres cellules du système immunitaire (lymphocytes...).
D’où l’idée, qui gagne du terrain chez les chercheurs, d’interrompre leur production. « Traiter des patients en phase chronique du sida à l’aide d’anti-interférons devient une réelle stratégie thérapeutique », commente Jean-Philippe Herbeuval, chercheur au Laboratoire de chimie et biochimie pharmacologiques et toxicologiques4. Avec son équipe, il vient d’obtenir des résultats très prometteurs5 en testant des molécules – des monoamines du type histamine – capables d’inhiber partiellement des cellules spécialisées dans la synthèse des interférons. Combiner les trithérapies actuelles avec un blocage intermittent des interférons permettrait de réduire les traitements antirétroviraux et de limiter leurs effets secondaires, mais aussi de lutter contre les problèmes de résistance du virus et de renforcer le contrôle des maladies opportunistes.
Les recherches sur la transmission du virus se poursuivent également. Transporté par le lait maternel, le sang et les sécrétions génitales, le virus est présent dans ces fluides soit sous forme libre, soit intégré dans des cellules qu’il a infectées. De nombreuses études se focalisent notamment sur la formation de la synapse virale, ce contact étroit qui se crée entre la cellule infectée et la surface de la muqueuse génitale et assure une rapide internalisation du virus vers les couches intérieures de la muqueuse. L’enjeu : élucider le fonctionnement de cette synapse afin d’envisager des stratégies locales pour bloquer le virus dès sa porte d’entrée dans l’organisme.
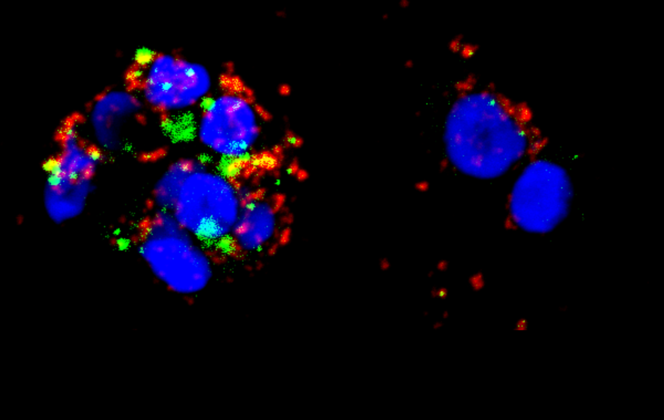

Les muqueuses dans le collimateur
Par ailleurs, les chercheurs tentent d’en savoir plus sur les mécanismes d’immunité au niveau de la muqueuse, notamment à travers le cas particulier de personnes régulièrement en contact avec le virus (personnes prostituées, notamment) qui restent pourtant séronégatives. « Nous ne savons pas expliquer complètement ce phénomène, commente Morgane Bomsel, chercheuse à l’Institut Cochin. On peut penser que le fluide est peu infectieux lors des premiers contacts et que ces personnes s’immunisent au fur et à mesure des contacts. Cette question montre tout l’intérêt d’étudier la réponse immunitaire localement et pas seulement au niveau de l’ensemble de l’organisme ». C’est ainsi qu’en étudiant les anticorps (immunoglobulines A) spécifiques du VIH qui sont présents au niveau de la muqueuse vaginale, l’équipe de Morgane Bomsel est parvenue à élaborer un candidat pour un vaccin préventif. Administré par voie muqueuse intranasale, il induit une réponse immune protectrice au niveau des muqueuses vaginale et rectale (ce que ne fait pas la vaccination traditionnelle intradermique) ET au niveau sanguin. Fondé sur cette stratégie originale, le vaccin vient de passer avec succès les essais cliniques de phase 16…
Le virus du sida est loin d’avoir révélé tous ses secrets. Mais les experts sont unanimes sur un point : outre les bénéfices déjà obtenus pour lutter contre la maladie, les avancées réalisées sur le VIH ont déjà révolutionné bon nombre de connaissances fondamentales en biologie, en immunologie comme en virologie. En témoigne, par exemple, la découverte il y a une dizaine d’années seulement d’une immunité intracellulaire, établissant que chaque cellule de l’organisme est intrinsèquement équipée pour résister aux infections et faciliter la réponse du système immunitaire. « La complexité du VIH, son exceptionnelle capacité à s’adapter et à mettre constamment en place des subterfuges pour contourner les défenses de l’organisme pousse toujours plus loin l’exploration des mécanismes fondamentaux du système immunitaire », constate Arnaud Moris.
Consultez aussi
Sida, une histoire mondiale
Quelle prévention contre le VIH ?
À voir
Présentation vidéo des travaux de Jamal Tazi, médaille de l'innovation 2017 du CNRS , à l'origine d'un candidat médicament contre le virus du sida.
- 1. Unité CNRS/Université de Montpellier.
- 2. « CD32a is a marker of CD4 T cell HIV reservoir harboring replication-competent provirus », Benjamin Descours et al., Nature, publié en ligne le 15 mars 2017.
- 3. Unité CNRS/UPMC/Inserm.
- 4. Unité CNRS/Université Paris-Descartes.
- 5. Travaux publiés en ligne dans la revue Nature Communication le 9 février 2017 et le 31 mai 2017.
- 6. Les essais cliniques de phase 1 visent principalement à évaluer l’innocuité et la tolérance du vaccin chez l’humain.
Voir aussi
Auteur
Rédactrice scientifique depuis plus de dix ans, Stéphanie Belaud s’est notamment spécialisée dans les domaines de la biologie, de la médecine et de l’environnement.