Vous êtes ici
Les promesses de l’hadronthérapie

Chaque année, le cancer touche 384 000 nouveaux patients en France. Parmi eux, 150 000 sont traités par radiothérapie, seule ou associée à la chimiothérapie ou à la chirurgie. Ces traitements permettent déjà une rémission complète dans une majorité de cas. Mais une technique en plein essor laisse espérer de nouveaux progrès: l’hadronthérapie. « Celle-ci est particulièrement indiquée pour les tumeurs résistantes à la chimio- et à la radiothérapie, ou inopérables du fait de leur localisation près de tissus vitaux : tumeurs cérébrales, du crâne, de la face ou du cou, près du cœur ou de l’œil, etc. », détaille Jacques Balosso, cancérologue et radiothérapeute au CHU de Grenoble1. Au total, ce traitement pourrait concerner 15 000 patients chaque année.
Des ions accélérés à très grande vitesse
De fait, l’hadronthérapie est une nouvelle forme de radiothérapie : comme la radiothérapie conventionnelle, elle consiste à irradier les cellules tumorales avec un faisceau de particules pour les détruire. Mais alors que la première utilise des photons de haute énergie (ou rayons X), « l’hadronthérapie repose, elle, sur des ions chargés positivement, notamment des ions hydrogènes ou “protons” – c’est la protonthérapie –, et des ions carbone – c’est la carbonethérapie », explique Daniel Cussol, physicien nucléaire au Laboratoire de physique corpusculaire de Caen2.
Constitués de protons et de neutrons – des particules élémentaires appartenant à la famille des hadrons, d’où le nom de la technique –, ces ions sont accélérés dans des appareils énormes, de quelques mètres à une vingtaine de mètres de diamètre : des synchrotrons ou des cyclotrons. Et ce, à des vitesses vertigineuses… pouvant atteindre 73 % de la vitesse de la lumière, soit 219 000 kilomètres par seconde ! Puis ils sont concentrés en un faisceau de moins d’un millimètre de diamètre permettant d’irradier les tumeurs.

Un ciblage précis
Comparés aux rayons X, les faisceaux d’hadronthérapie sont en théorie plus précis. Concernant spécifiquement les ions carbone, ils seraient aussi plus efficaces. Mais surtout, « les ions chargés délivrent la majorité de leur énergie au niveau de la tumeur visée. Ce qui permet de maximiser les dégâts au niveau de la tumeur, tout en préservant au mieux les cellules saines autour », précise Daniel Cussol.
Proposée dès 1946 par le physicien américain Robert Wilson, la protonthérapie fut utilisée pour la première fois sur des patients en 1954, aux États-Unis ; et la carbonethérapie en 1975, aux États-Unis également. Depuis, « environ 150 000 patients ont été traités par protonthérapie dans le monde, dont près de 14 000 en France ; et 23 000 par ions carbone, dont 20 000 rien qu’au Japon, leader dans ce domaine », dénombre Jacques Balosso.
Un enjeu interdisciplinaire
Restent cependant de nombreuses questions en suspens : quels sont précisément les effets physiques et biologiques de l’hadronthérapie sur les tissus ? Quelle est son efficacité réelle ? Quid de sa possible toxicité ? Comment maîtriser et exploiter au mieux sa puissance antitumorale ? Des interrogations cruciales qui constituent autant de défis pour la recherche.
Menée par une dizaine de laboratoires rien qu’au CNRS, fédérés pour la plupart par le programme scientifique FranceHadron, « La recherche sur l’hadronthérapie est très interdisciplinaire et implique la radiobiologie, la physique nucléaire, la chimie, la biologie cellulaire et moléculaire et bien sûr la médecine », souligne Sylvain David, directeur adjoint scientifique en charge de l’interdisciplinarité à l’Institut national de physique nucléaire et de physique des particules3.
Un défi crucial pour la physique
En physique, l’un des enjeux majeurs consiste à mieux évaluer un phénomène susceptible de fortement modifier les effets de la carbonethérapie : la fragmentation des ions carbone. « Contrairement aux rayons X et aux protons, ces ions peuvent, quand ils percutent des atomes du corps humain, “se casser” en particules plus petites. Plus légères, celles-ci peuvent aller beaucoup plus loin que la cible initiale, et occasionner des dégâts dans des tissus sains », explique Daniel Cussol.
Pour en savoir plus sur ce phénomène, le chercheur et son groupe travaillent à « déterminer la nature des fragments produits, leurs directions d’émission, leur énergie, etc. Cela, pour chaque type de noyau atomique présent dans les tissus humains et susceptible d’être percuté dans les ions carbone. Et pour chaque type de tissus, ceux-ci étant constitués à plus de 95 % d’atomes d’hydrogène (H), de carbone (C), d’azote (N), d’oxygène (O) et de calcium (Ca), dans des proportions différentes d’un type de tissu à l’autre ». Un travail fastidieux… mais crucial.
Lors d’une récente étude4, les chercheurs ont envoyé des ions carbone sur quatre cibles constituées respectivement de C, H, O et de titane (pour mimer le Ca). « Présentés sous forme de tableaux et de graphiques, donnant la probabilité d’émission d’une particule dans une direction donnée, à une énergie donnée, nos résultats sont mis à disposition de la communauté scientifique sur un site Web dédié », signale le physicien.
Faire d’un inconvénient un avantage
Ces données devraient permettre aux médecins et aux biologistes de mieux maîtriser l’efficacité de la carbonethérapie. Elles pourraient aussi mener au développement d’instruments de contrôle et d’imagerie innovants. « Les fragments secondaires issus de la fragmentation créent des rayonnements pouvant sortir du corps humain. Leur détection via des techniques d’imagerie – comme la tomographie par émission de positrons (TEP) –, pourrait donc servir à visualiser le dépôt de la dose par le faisceau d’ions en temps réel pendant le traitement, pour en vérifier la bonne réalisation », précise Daniel Cussol. De quoi transformer un inconvénient en un avantage !
Une dizaine d’essais en cours
Côté médecins, l’un des défis essentiels à relever est de vérifier rigoureusement la supériorité de l’hadronthérapie, et notamment de la carbonethérapie, sur les autres traitements existants. Pour ce faire, une dizaine d’essais cliniques de phase 3 sont en cours dans le monde.
« En décembre 2017, nous avons lancé une étude sur 250 patients recrutés dans une vingtaine de centres en France. La moitié sera traitée dans un centre de carbonethérapie italien ; et l’autre, par radiothérapie classique ou éventuellement protonthérapie en France. Financé par l’Assurance-maladie et mené sous la responsabilité légale des hospices de Lyon, cet essai vise à évaluer et à comparer le taux de survie sans rechute, la toxicité, et le coût de ces différents traitements », indique Jacques Balosso. Les premiers résultats devraient arriver dans cinq ans.
Afin d’évaluer précisément la balance bénéfices-risques de cette thérapie, il faut aussi étudier finement ses effets sur les tumeurs – notamment « hypoxiques » (avec un faible taux d’oxygène tissulaire), résistantes à la radiothérapie classique – ; et sur le tissu sain, en particulier le cerveau. C’est le domaine de la biologie.

Des bénéfices scrutés jusqu’au niveau moléculaire
À la plateforme Cyceron de Caen, l’équipe de Myriam Bernaudin5 mène plusieurs expériences sur des cellules, des tissus et des animaux, et en utilisant l’imagerie biomédicale pour étudier les effets sur le cerveau (IRM ou TEP). Par exemple, « nous tentons de savoir si, contrairement à la radiothérapie conventionnelle6, l’hadronthérapie a un effet bénéfique sur les populations de macrophages , en diminuant le taux de macrophages M2, qui favorisent le développement de la tumeur », illustre la biologiste.
Toujours à Caen, mais au Centre de recherche sur les ions, les matériaux et la photonique (Cimap)7 cette fois, des équipes de physiciens, chimistes et biologistes étudient, avec une approche interdisciplinaire, les effets de l’hadronthérapie à l’échelle cellulaire – notamment sur des tissus bio-imprimés en 3D – et moléculaire. « Nous irradions des molécules biologiques (ADN, acides aminés…) avec des ions carbones, puis nous essayons de voir s’il se crée des composés potentiellement toxiques pour les cellules saines et cancéreuses », développe Amine Cassimi, directeur du Cimap. Bref, la recherche sur l’hadronthérapie a encore beaucoup à faire.
Un accès encore trop limité aux faisceaux
Problème : « l’accès aux faisceaux de protons et d’ions carbone reste encore très limité… », regrette Sylvain David. Et pour cause : en France, il n’existe pour l’instant que deux centres dédiés à la protonthérapie, lesquels sont destinés en priorité au traitement et non à la recherche : le Centre de protonthérapie de l’Institut Curie à Orsay et le Centre Antoine-Lacassagne à Nice. Le nouveau centre inauguré à Caen en ce mois de juillet 2018 sera le troisième.
Pour la carbonethérapie, c’est pire : alors que le Japon possède sept centres dédiés à cette technique, l’Allemagne 2, l’Italie et l’Autriche un chacune, il n’en existe encore aucun en France. « Les chercheurs français doivent soit se tourner vers certains accélérateurs de centres de recherche comme le Grand accélérateur national d’ions lourds de Caen (Ganil), dont les faisceaux n’ont pas toujours les caractéristiques des faisceaux "médicaux”, soit composer avec les accélérateurs d’ions carbonés installés ailleurs en Europe ou au Japon », déplore Sylvain David.
« Nos travaux s’en trouvent fortement ralentis, soupire la biologiste Myriam Bernaudin. Comme nous avons accès au faisceau du Ganil seulement une ou deux fois par an, notre dernière étude a nécessité pas moins de quatre ans. Alors qu’avec un accès hebdomadaire, un an aurait suffi. » Par ailleurs, ajoute-t-elle, « actuellement aucun centre de carbonethérapie au monde ne permet des expériences sur des animaux. Or, ces études sont cruciales pour explorer, par exemple, les possibles effets du traitement sur la cognition (mémoire, etc.) ».
Du programme Archade au centre Cyclhad
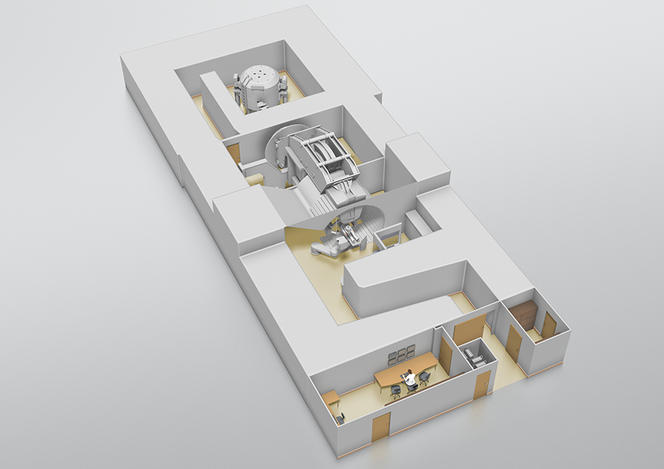
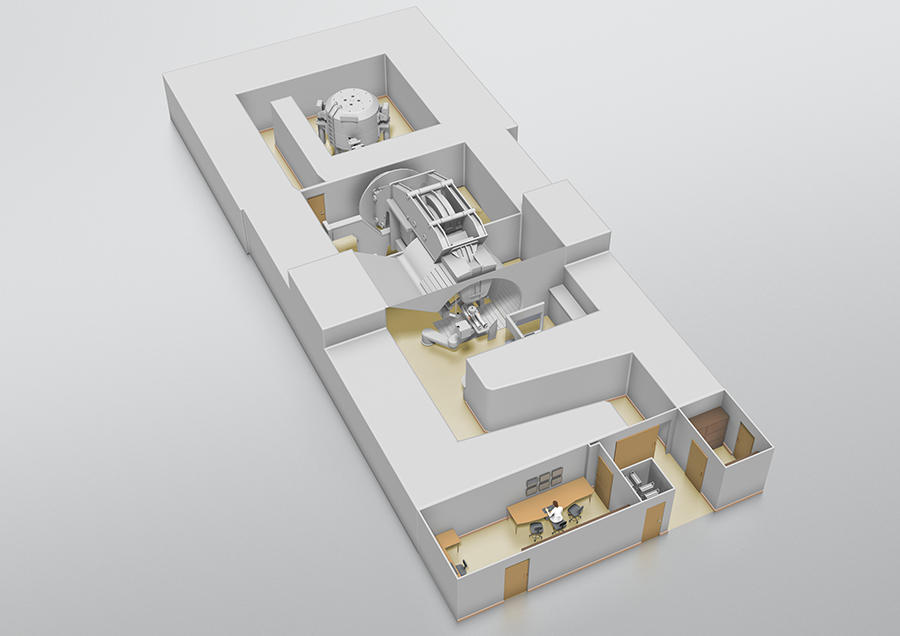
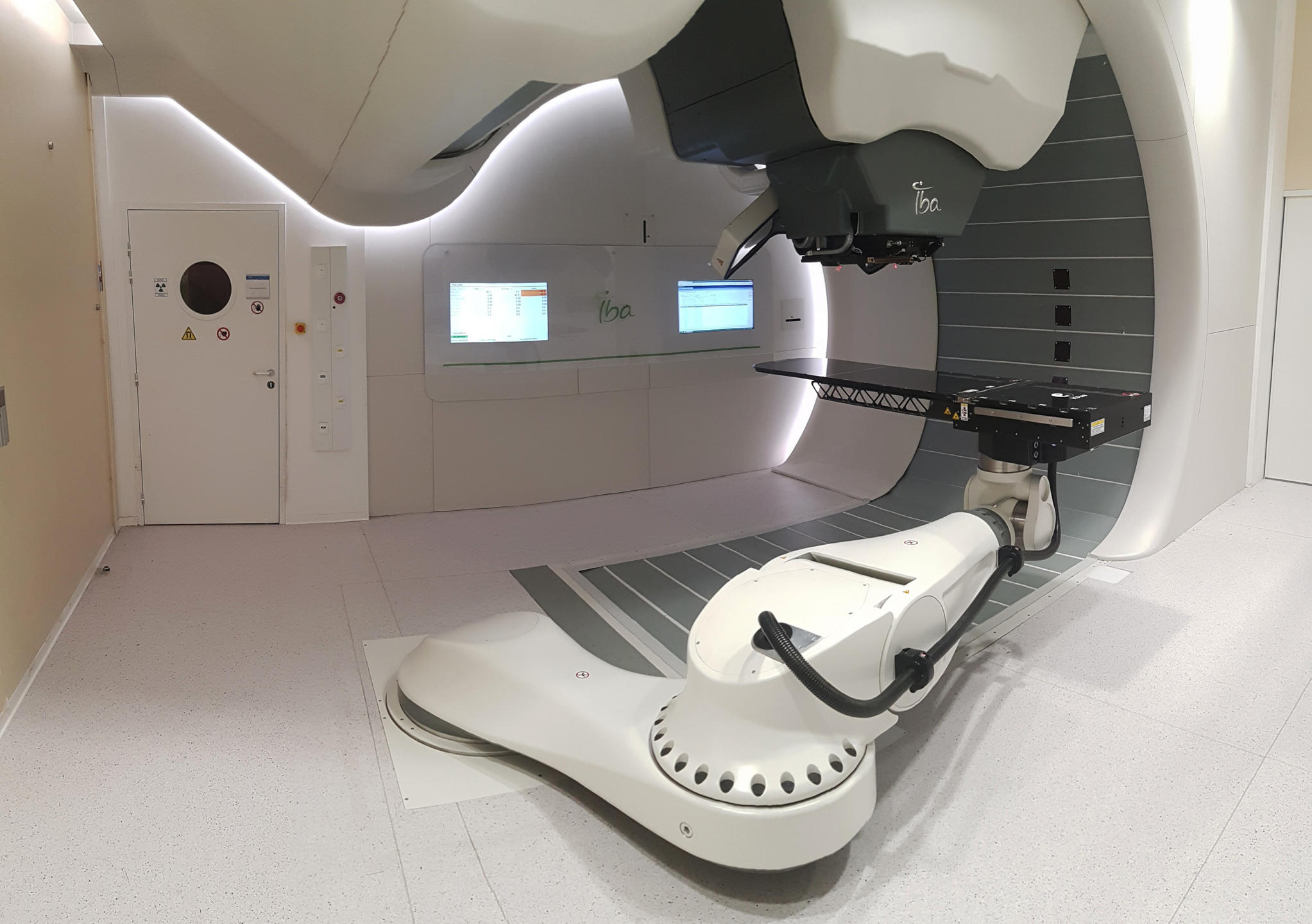
Heureusement, les choses sont en train de changer sensiblement grâce au programme Archade8.Lancé en 20079, ce projet de grande envergure comprend trois phases : la construction, entre 2015 et 2018, du centre Cyclhad10 et l’acquisition d’une première machine de soins de protonthérapie : ProteusOne®, pour un coût total de 76,5 millions d’euros ; le développement, à partir de la fin 2018, d’un second accélérateur dédié à la carbonethérapie : C400, d’un coût estimé à 55 millions d’euros ; et l’acquisition, à partir de 2023, de ce second appareil.
Désormais achevée, la première phase se conclut officiellement ce 5 juillet avec l’inauguration du centre Cyclhad et de ProteusOne®. « Cet appareil va augmenter l’offre de protonthérapie en France », se réjouit le cancérologue Jacques Balosso. « Il permettra de traiter des patients dès la mi-juillet, au rythme de 345 par an à terme, dont un tiers seront des enfants », précise Philippe Lagalle, président- directeur général de la société Cyclhad.
Les chercheurs, eux, attendent aussi le second accélérateur prévu pour 2023. « Cet accélérateur d’ions sera consacré à 50 % au traitement, et 50 % à la recherche, promet Philippe Lagalle. Il devrait aussi être le premier au monde à permettre des essais de carbonethérapie sur l’animal ». De quoi espérer enfin voir la recherche française en hadronthérapie prendre sa pleine dimension. ♦
- 1. Chef du service de radiothérapie du CHU de Grenoble.
- 2. Unité CNRS/Ensi Caen/Université de Caen Basse-Normandie.
- 3. Il est également chercheur à l’Institut de physique nucléaire d’Orsay (CNRS/Université Paris-Sud).
- 4. « Differential cross section measurements for hadron therapy : 50 MeV/nucleon 12C reactions on H, C, O, Al, and natTi targets », C. Divay et al. ; Phys. Rev., 2017 (95) : 044602. https://doi.org/10.1103/PhysRevC.95.044602
- 5. Laboratoire Imagerie et stratégies thérapeutiques des pathologies cérébrales et tumorales (CNRS/CEA/Université de Caen Normandie).
- 6. « M2 macrophages are more resistant than M1 macrophages following radiation therapy in the context of glioblastoma », M. Leblond et col. ; Oncotarget ; 2017 (8) : 72597-72612. doi.org/10.18632/oncotarget.19994
- 7. Unité CNRS/Ensi Caen/Université de Caen Normandie/CEA.
- 8. Pour Advanced Resources Center for HADrontherapy in Europe.
- 9. Lancé par l’ex-Région Basse-Normandie et regroupant le centre de santé François-Baclesse de Caen, le CHU de Caen, le Ganil, l’Ensi Caen, l’université de Caen Basse-Normandie, Nucléopolis et le CNRS.
- 10. Pour CYCLotrons pour l’HADronthérapie.
Voir aussi
Auteur
Journaliste scientifique freelance depuis dix ans, Kheira Bettayeb est spécialiste des domaines suivants : médecine, biologie, neurosciences, zoologie, astronomie, physique et nouvelles technologies. Elle travaille notamment pour la presse magazine nationale.