Vous êtes ici
Ces protéines folles qui minent notre cerveau
Temps de lecture : 6 minutes
Elles affectent plus de 47 millions de patients dans le monde, évoluent si discrètement qu’elles sont très difficiles à diagnostiquer avant que leurs dégâts ne deviennent vraiment handicapants, et demeurent à ce jour incurables. Considérées comme le mal du XXIe siècle, les maladies neurodégénératives sont, comme leur nom l’indique, causées par une dégénérescence des cellules neuronales. Elles se manifestent par une dégradation progressive mais irréversible des fonctions cognitives du sujet, ce qui les rend si terrifiantes tant pour le malade que pour son entourage. Parmi ces maladies, on compte bien sûr les maladies d’Alzheimer, de Charcot ou de Creutzfeldt-Jakob -forme humaine de l’encéphalopathie spongiforme bovine (ESB), plus connue sous le nom de maladie de la « vache folle ». Mais aussi la maladie de Parkinson et l’atrophie multi-systématisée (AMS) Fermer maladie neurodégénérative rare caractérisée par l'association variable de symptomes parkinsoniens (tremblement, lenteur, etc.), uro-génitaux (incontinence, troubles de l'érection, etc.), circulatoire (hypotension), etc. dont une étude qui vient d'être publiée dans la revue Nature montre qu'elles sont chacune causées par deux configurations différentes de la même protéine déficiente.
Un nouvel agent infectieux
Les travaux menés sur l’ESB ont été les premiers à mettre en évidence un nouvel agent infectieux qui n’était ni une bactérie ni un virus mais une protéine de forme anormale : le prion. Les chercheurs savent désormais que la plupart des maladies neurodégénératives sont dues à une accumulation pathologique dans le cerveau de protéines déficientes. Raison pour laquelle on les nomme aussi protéinopathies. C’est le cas de la maladie d'Alzheimer, dont on sait depuis longtemps qu'elle est liée à une accumulation de protéines Tau anormales dans les neurones.
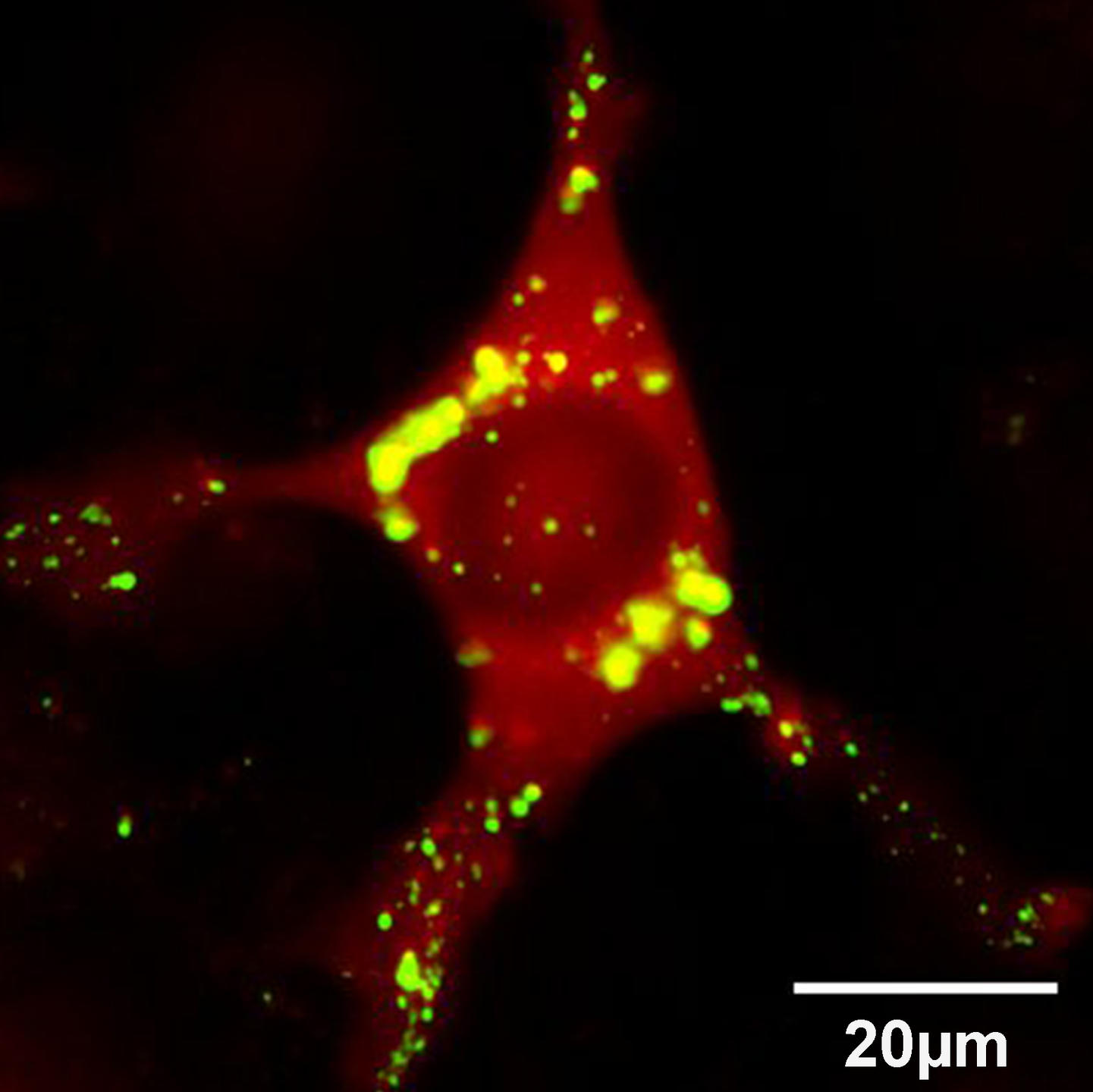
Mais c'est aussi le cas de la maladie de Parkinson, qui touche 1 % des Français de plus de 65 ans et se place ainsi au deuxième rang des maladies neurodégénératives en France, juste après la maladie d’Alzheimer. Heiko Braak, anatomiste et histologiste allemand, et son équipe ont montré en 2003 que la maladie de Parkinson était due à des dépôts nommés « corps de Lewy », qui s’accumulent d’abord dans les tissus du bulbe olfactif et du tronc cérébral avant d’envahir tout le cerveau. Ces corps de Lewy sont des agrégats d’une protéine naturellement présente dans le cerveau mais dont on ne connait pas encore la fonction exacte, l’alpha-synucléine. Cette dernière devient toxique pour les cellules nerveuses lorsqu’elle s’agglomère en agrégats ou en fibrilles.
En 2008, Jeffrey H. Kordower, Patrik Brundin et leurs équipes ont prouvé l’importance de l’alpha-synucléine dans le processus de dégradation de tissus cérébraux chez des patients parkinsoniens1. Ils ont constaté que des greffes de tissus sains finissaient, au bout de plusieurs années, par être envahies par des corps de Lewy. Ce type de propagation jamais observé auparavant pour l’alpha-synucléine et les corps de Lewy est, selon ces équipes, à rapprocher de celui observé avec les protéines de type prion.
Une protéine, deux conformations
À Gif-sur-Yvette, Ronald Melki et son équipe se sont penchés de plus près sur la propagation des agrégats d’alpha-synucléine qu'ils ont donc injecté dans le bulbe olfactif et la paroi intestinale de souris adultes. Ces agrégats ont été retrouvés dans les neurones et leurs prolongements. Ils avaient donc migré depuis les terminaisons nerveuses situées près de la zone où avait été réalisée l’injection jusqu’aux corps des neurones situés dans le cerveau.
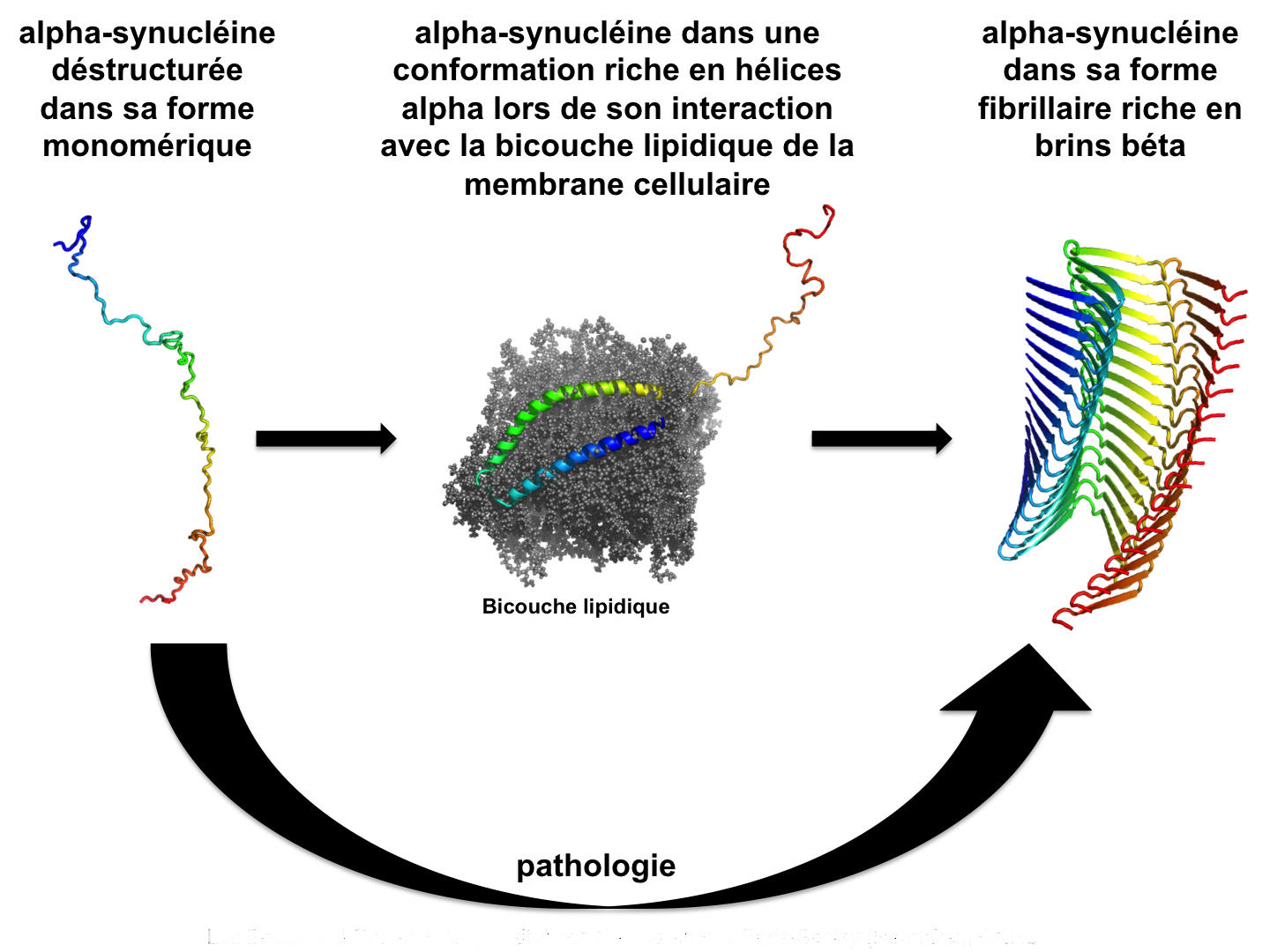
En 2013, en étudiant la polymérisation de l’alpha-synucléine2, ils ont constaté que, dans une même solution, plusieurs conformations coexistaient, donnant un grand nombre d’assemblages possibles (des isoformes). En contrôlant, de façon stricte, les conditions dans lesquelles les assemblages ont lieu, l’équipe est parvenue à isoler deux structures particulières de l’alpha-synucléine : l’une ressemble « à des pâtes larges en forme de ruban, comme des linguines », l’autre « à des pâtes cylindriques pleines, comme des spaghettis ». À cette occasion, les chercheurs ont remarqué qu’il n’était pas possible de passer d’une conformation à l’autre ; une fois les structures réalisées, on ne peut revenir en arrière. De plus ces deux isoformes agissent tel un moule : elles imposent leur conformation aux protéines alpha-synucléine non agrégées. Ce phénomène permet de comprendre le mécanisme par lequel les corps de Lewy se propagent à tout le cerveau à partir des régions du bulbe olfactif et du tronc cérébral.
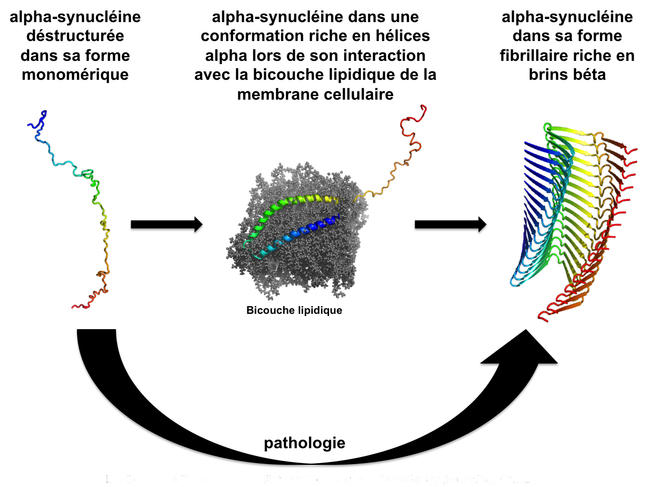
En outre, ces deux conformations manifestent des propriétés fonctionnelles différentes : elles ne présentent ni les mêmes capacités à s’attacher aux cellules ni la même toxicité. Une étude menée conjointement par Ronald Melki et une équipe belge et publiée dans Nature3 vient en effet de montrer que les fibres d'alpha-synucléine qui diffèrent structuralement aboutissent également à des pathologies différentes. Ainsi quand ils ont injectés dans le cerveau de rats des fibres de forme cylindrique, semblables à des spaghettis, ceux-ci ont développé une maladie de Parkinson; tandis que l'injection de fibres en ruban amenait les animaux à développer une atrophie multi-systématisée.
Une piste thérapeutique
Le comportement de l’alpha-synucléine rappelle beaucoup celui de la protéine prion de l’ESB : remontée de la protéine le long des trajets nerveux jusqu’au cerveau et modification de protéines alpha-synucléine saines qui vont former des agrégats. Comment agir pour circonscrire ces agrégats ? Ronald Melki est optimiste : « Il y a deux façons d’interférer avec leur propagation : on cible soit la formation des fibrilles, soit leur propagation. Dans notre laboratoire, on étudie cette seconde possibilité et j’ai beaucoup d’espoir dans cette voie. » Pour réduire le champ d’action des agrégats et leur propagation, il suffirait, selon lui, de les lier à des molécules modifiant leurs propriétés fonctionnelles. En effet, « avec mon équipe, continue Ronald Melki, on cherche les molécules qui, une fois qu’elles sont liées aux fibrilles, changent leurs propriétés de surface, ce qui bloque ainsi leur propagation. »
La recherche sur l’alpha-synucléine continue. Un effort important est mené pour, à terme, permettre de ralentir ou d’arrêter la dégradation du tissu neuronal des malades voire, peut-être à très long terme, d’aboutir à une reconstruction des zones endommagées.
- 1. Nature Medecine, mai 2008, vol. 14 (5) : 467-585.
- 2. Structural and functional characterization of two alphasynuclein strains, L. Bousset.et al. Nature communications, 10 octobre 2013. doi:10.1038/ncomms3575
- 3. α-Synuclein strains cause distinct synucleinopathies after local and systemic administration, W. Peelaerts, L. Bousset, A. Van der Perren, A. Moskalyuk, R. Pulizzi, M.Giugliano, C. Van den Haute, R. Melki, V. Baekelandt. Nature, 10 juin 2015. DOI : 10.1038/nature14547
Voir aussi
Auteur
Meryem Tizniti est étudiante en journalisme scientifique à l’université Paris-Diderot et diplômée en physique.