Vous êtes ici
Une IA décèle les premiers signes de la sclérose en plaques
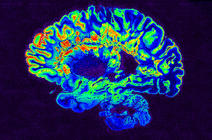
Elle apparaît surtout chez de jeunes adultes, entre 25 et 35 ans, et toucherait plus de 115 000 personnes en France, avec 5 000 nouveaux diagnostics réalisés chaque année1. La sclérose en plaques (ou SEP) est une maladie inflammatoire, auto-immune et neurodégénérative qui affecte le cerveau et la moelle épinière. L’inflammation détruit la myéline, qui ne peut alors plus assurer son rôle de gaine protectrice pour les axones des neurones. Une perte qui affecte particulièrement la transmission de l’information transitant de cellules nerveuses en cellules nerveuses. Cette maladie chronique réduit les facultés motrices, visuelles, sensitives et cognitives, en fonction de la taille et de l’emplacement des lésions qu’elle inflige. Des soins existent pour limiter l’avancée de la pathologie, mais elle ne peut pas encore être guérie.
Retracer l'évolution du volume des structures cérébrales
L’étude et le suivi de la sclérose en plaques sont compliqués du simple fait que les patients passent des examens d’IRM (imagerie par résonnance magnétique) seulement au moment où ils ressentent les premiers symptômes. Ce problème est récurrent pour les maladies neurodégénératives, où plusieurs structures cérébrales sont déjà atteintes sans que l’on ne sache depuis quand ni comment.

Un puzzle qui n’effraie pas Pierrick Coupé, directeur de recherche au CNRS, au Laboratoire bordelais de recherche en informatique2, qui travaille sur l’analyse et le traitement d’imageries biomédicales dans le cadre de maladies neurodégénératives telles que la SEP ou la maladie d’Alzheimer. Le chercheur s’intéresse depuis 2019 aux modèles dits « lifespan », couvrant toute la durée de vie. Une approche qui permet de situer les phénomènes chronologiquement. « Comme personne ne passe d’IRM de manière régulière de sa naissance à sa mort, des modèles ont été construits à partir d’une dizaine de milliers d’IRM de cerveaux d’individus uniques et de tout âge, explique Pierrick Coupé. Il est alors possible d’estimer des trajectoires moyennes du volume des structures cérébrales tout au long de la vie, à la manière des courbes de suivi du poids et de la taille chez les enfants. »
Ces travaux, décrits dans la revue Human brain mapping, étaient initialement destinés à l’étude du vieillissement normal du cerveau. Mais Pierrick Coupé et ses collègues en ont détourné le principe pour étudier des pathologies telle la maladie d’Alzheimer. Ils ont ainsi montré que les courbes du volume de l’hippocampe, structure essentielle pour la mémoire, divergent de son vieillissement habituel dès quarante ans3.
Un traitement massif d'imageries médicales
Pour la sclérose en plaques, les chercheurs ont analysé les IRM cérébrales de près de 41 000 sujets, dont plus de 2 500 patients issus de la base de données de l’Observatoire français de la sclérose en plaques (Ofsep). « La sclérose en plaques est plutôt décrite comme une maladie inflammatoire, mais nous l’avons regardée sous l’angle de la neurodégénérescence, explique Pierrick Coupé. Nous voulions en particulier vérifier si des structures étaient atteintes de façon précoce et spécifique par la maladie. »
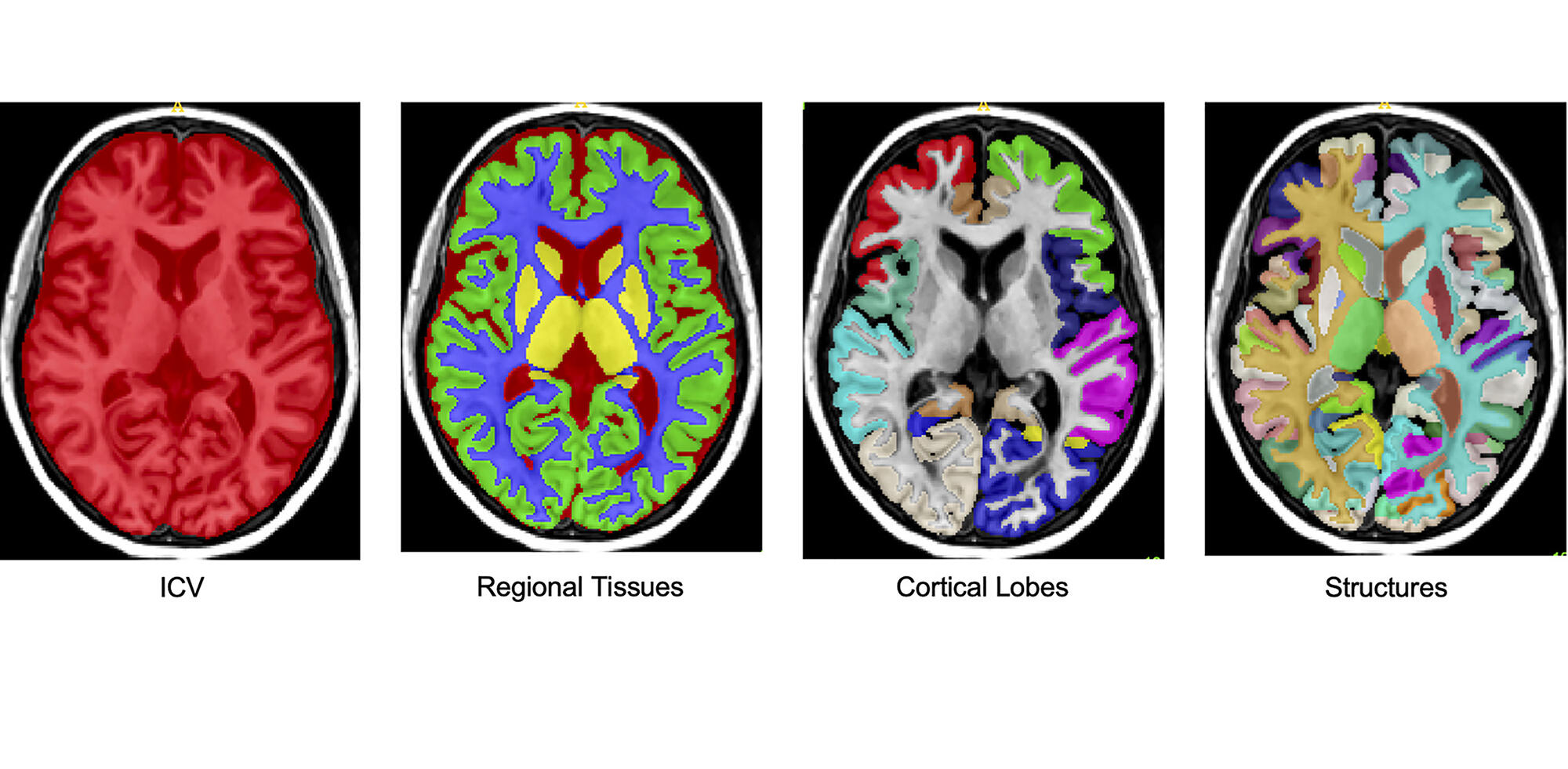
Le but est donc d’identifier toutes les parties du cerveau et de surveiller l’évolution de leur volume au fil de la vie des individus, qu’ils souffrent de sclérose en plaques ou non. Ici, il ne s’agit plus de développer un outil, mais bien de créer de la connaissance. « Une segmentation fine du cerveau sur des images IRM demande deux semaines de travail à une personne formée spécialement pour, déplore Pierrick Coupé. Avec 41 000 cerveaux à analyser, ce travail serait tout bonnement impossible sans IA. »
Les chercheurs ont donc développé une IA collective, où de nombreux réseaux de neuronesFermerUn réseau de neurones artificiels est un ensemble organisé de neurones interconnectés permettant la résolution de problèmes complexes tels que la vision par ordinateur ou le traitement du langage naturel) travaillent de concert afin de converger vers un résultat précis et robuste. Ainsi, 250 réseaux de neurones analysent l’image simultanément. Une approche empruntée à la manière qu’ont les humains de traiter les sujets complexes. « Nous nous sommes inspirés d’un système parlementaire bicaméral, explique Pierrick Coupé. Les réseaux de neurones sont organisés comme deux chambres d’un parlement : l’une analyse à faible résolution tandis que l’autre affine ses résultats. Elles communiquent pendant tout le processus jusqu’à converger sur un consensus découlant sur la discrimination des structures cérébrales les unes par rapport aux autres. La principale difficulté de gérer une grande quantité de données réside dans le contrôle de la qualité des données, et certains réseaux de neurones sont uniquement chargés de vérifier la qualité des analyses. »
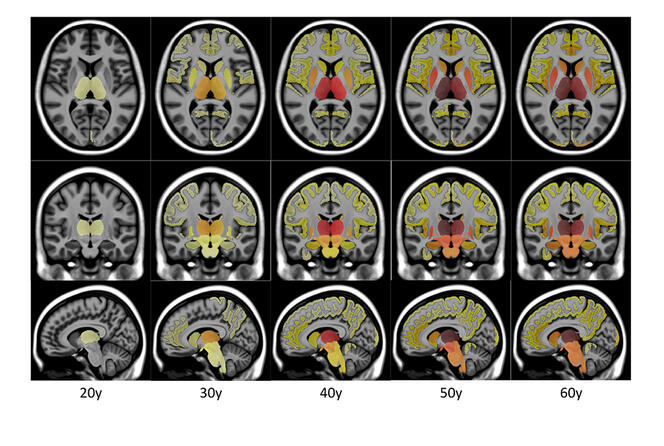

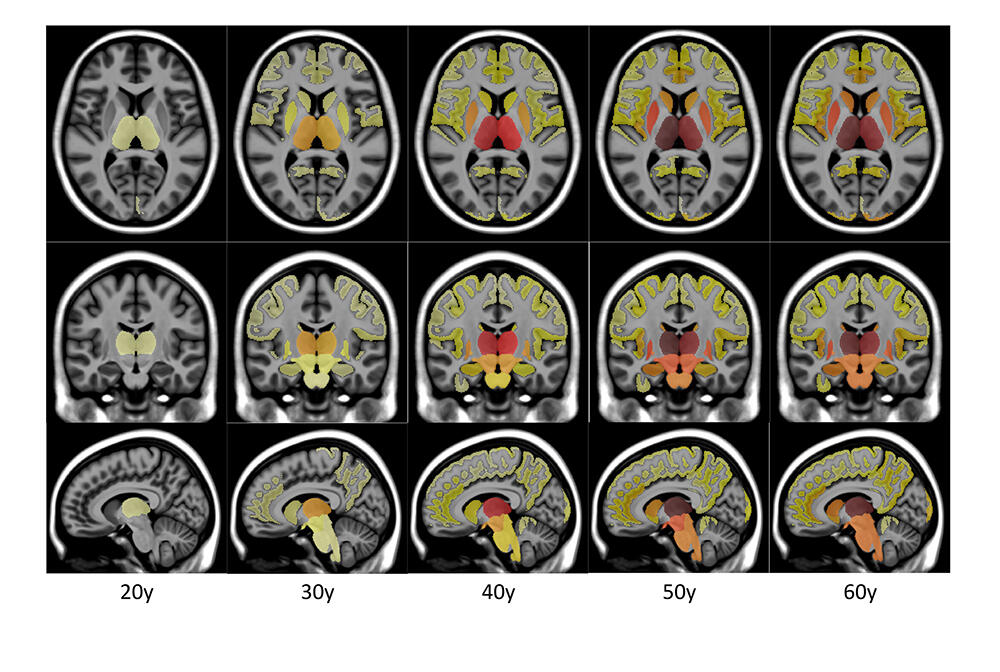
L’IA segmente le cerveau puis traite la masse de données ainsi obtenues à partir des 41 000 sujets. Ces segmentations permettent ensuite d’inférer la trajectoire de l’évolution moyenne du volume de chaque structure cérébrale au cours de la vie. Pour chaque structure, une trajectoire de l’évolution normale et une trajectoire pathologique sont construites afin d’estimer le moment où les deux modèles divergent.
Ces travaux ont montré que le thalamus, impliqué dans le traitement des informations sensitives et sensorielles, était la première structure impactée par la sclérose en plaques. Le putamen, qui joue un rôle dans la régulation des mouvements et l’apprentissage, commence à se dégrader en moyenne quatre ans plus tard. Le tronc cérébral, qui régule notamment le rythme cardiaque et la respiration, est quant à lui affecté environ neuf ans après le thalamus. Autrement dit, les résultats obtenus par Pierrick Coupé et ses collègues ont permis de comprendre que plusieurs structures cérébrales étaient bien affectées plusieurs années avant l’apparition des premiers symptômes de la sclérose en plaque qui, en moyenne, sont décelés plus de dix ans après les premiers signes de neurodégénérescence.
Des conclusions que l'on peut expliquer
Ces résultats soulignent l’importance prise par l’intelligence artificielle dans l’étude et le diagnostic de diverses pathologies, grâce au traitement massif d’imageries médicales. Le fait que les présents travaux se basent sur des IA qui utilisent une segmentation cérébrale lisible par les humains a son importance, car cela signifie que leurs conclusions sont explicables. En effet, de nombreuses IA parviennent à des résultats corrects en apparence, mais sans que l’on ait accès à leur cheminement. Cela limite les chances de se rendre compte d’un problème si jamais elles se trompent. Il est aussi évidemment peu souhaitable de poser un diagnostic à partir d’algorithmes qui ne peuvent expliquer ou justifier leurs choix.


« Nous avons récemment développé un outil d’aide au diagnostic pour la maladie d’Alzheimer4, car nous avons détecté que deux structures divergeaient précocement et fortement, poursuit Pierrick Coupé. Nous travaillons actuellement à un outil similaire pour la sclérose en plaques. De plus, nos modèles peuvent réduire les coûts d’études cliniques en aidant à mieux sélectionner les patients. Dans un futur un peu plus lointain, nous souhaitons concevoir des outils d’IA capables de fournir une aide au diagnostic différentiel entre plusieurs formes de démence comme la maladie d’Alzheimer ou encore la démence fronto-temporale. » ♦
À lire sur notre site
Quand l’IA s’attaque à la sclérose en plaques
Les IRM cérébrales ont leur traducteur automatique
À lire sur le site du CNRS
Une assemblée d’intelligences artificielles au service de la médecine
- 1. https://www.arsep.org/fr/159-la-sep.html
- 2. LaBRI, unité CNRS/Bordeaux INP/Université de Bordeaux.
- 3. https://onlinelibrary.wiley.com/doi/full/10.1002/hbm.26464
- 4. onlinelibrary.wiley.com/doi/10.1002/hbm.25850
Voir aussi
Auteur
Diplômé de l’École supérieure de journalisme de Lille, Martin Koppe a notamment travaillé pour les Dossiers d’archéologie, Science et Vie Junior et La Recherche, ainsi que pour le site Maxisciences.com. Il est également diplômé en histoire de l’art, en archéométrie et en épistémologie.