Vous êtes ici
Comment l’optogénétique a en partie rendu la vue à un aveugle
Temps de lecture : 13 minutes
Cette prouesse médicale et scientifique a été rendue possible grâce à l’optogénétique. De quoi s’agit-il ?
José-Alain Sahel1. L’optogénétique consiste à modifier génétiquement une cellule, généralement grâce à un virus, afin qu’elle produise une protéine photosensible. Celle-ci génère un signal électrique lorsqu’elle reçoit une stimulation lumineuse dans la longueur d’onde correspondante. Cette discipline est née dans les années 1990 et au début des années 2000. Au départ, les chercheurs s’intéressaient principalement à déterminer, d’un point de vue biophysique, les mécanismes sous-jacents aux interactions de certaines algues et bactéries avec la lumière. Une équipe allemande de l’Institut Max Planck a identifié une protéine naturelle, appelée channelrhodopsin, qui change le potentiel électrique au travers de la membrane d’une cellule en fonction de la lumière.
Ces travaux étaient à l’origine très fondamentaux, et les chercheurs ont progressivement réalisé que cela pourrait permettre de manipuler l’activité électrique des cellules, et en particulier des neurones. Les neurosciences s’en sont donc emparées pour comprendre les connexions des réseaux de neurones du cerveau. Valentina Emiliani, qui a depuis rejoint l’Institut de la vision et obtenu cette année la médaille d’argent du CNRS, s’en sert par exemple pour étudier ces réseaux dans le cortex. Claire Wyart, à l’Institut du cerveau et de la moelle épinière2, applique ces outils chez le poisson-zèbre.
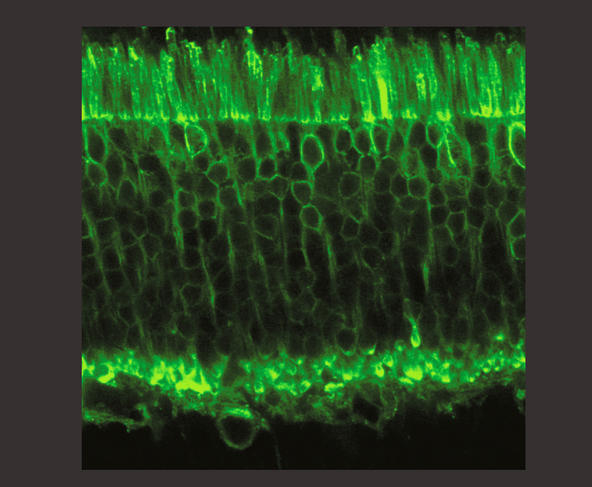

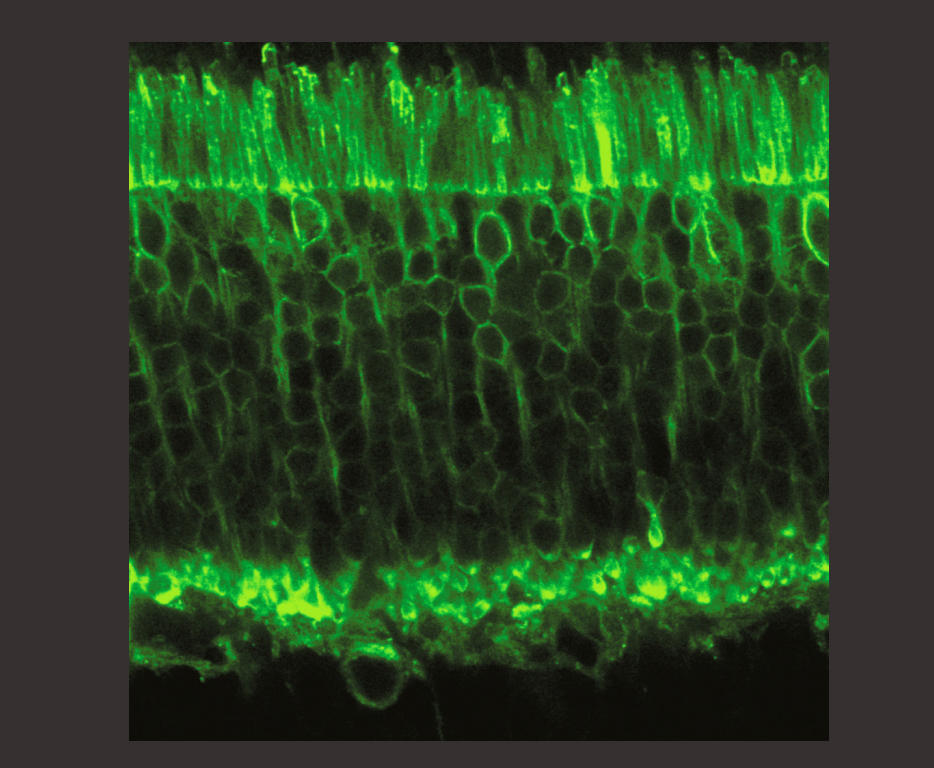
Le premier brevet mentionnait déjà la possibilité d’applications cliniques, et de plus en plus de laboratoires se sont intéressés à l’optogénétique. Elle a même été désignée « méthode de l’année 2010 » par la revue Nature Methods et compte parmi les avancées de la décennie selon Science !
J’insiste pour souligner que nous sommes partis de recherches très fondamentales sur les protéines des algues ou le traitement de l’information dans le système nerveux. Nous sommes malgré tout parvenus à la toute première application clinique de l’optogénétique, ce qui illustre le caractère fallacieux de la distinction entre recherches fondamentales et « appliquées ».
Comment en êtes-vous venus à appliquer l’optogénétique au traitement de la cécité ?
J.-A. S. En 2007, j’ai commencé à discuter avec Botond Roska, aujourd’hui codirecteur de l’Institut d’ophtalmologie moléculaire et clinique de Bâle (Suisse) qui avait appliqué cette technique à l’étude des circuits dans la rétine. L’idée d’employer une réponse à la lumière pour induire la production d’un courant électrique nous a fait penser à ce qu’il se passe dans la rétine.
Nous avons donc souhaité appliquer l’optogénétique aux handicaps visuels. Ce projet a cependant été jugé ridicule par certains confrères, mais nous avons tenu bon car nous savions que cela avait du sens. Les premiers essais, menés à Detroit (États-Unis) par une autre équipe que la nôtre, utilisaient une protéine qui avait besoin d’un niveau d’éclairage très important. La lumière était trop forte pour des applications cliniques et, malgré une belle publication, les essais cliniques ne semblent pas avoir abouti. Nous avons pu identifier trois grands défis à relever pour aboutir à des applications cliniques : sélectionner les bonnes protéines pour le bon type de cellule, trouver comment les stimuler efficacement et développer les protocoles de rééducation visuelle pour les patients.
Ce projet nous a demandé un temps long et a réclamé beaucoup de ténacité. Il a été difficile à financer tout au long de ces douze années et nous avons dû garder le cap quand les essais ne fonctionnaient pas. Mais nous n’avons jamais abandonné.
Comment s’est opéré le choix de la protéine à injecter et du type de cellule à cibler ?
J.-A. S. Botond Roska a d’abord exploré les cellules bipolaires de la rétine, qui divisent le signal sensoriel entre on et off. Ces neurones se sont cependant révélés trop compliqués à cibler chez le primate pour y injecter un gène codant une protéine. Un groupe de chercheurs suisses travaille encore dessus, mais à un stade plus précoce.
Nous nous sommes ensuite intéressés aux photorécepteurs dormants. Dans des pathologies comme la rétinopathie pigmentaire, les cellules perdent progressivement leurs propriétés photoréceptives, mais elles ne meurent pas pour autant et restent connectées entre elles. Nous avons réussi à réactiver ces cônes et publié en 2010, avec Botond Roska et Serge Picaud, nos résultats dans Science, ce qui nous a facilité l’obtention d’un financement de la Foundation Fighting Blindness. Nous n’arrivions cependant pas à exprimer suffisamment fortement les bonnes protéines dans ces cellules. Botond Roska à Bâle et Deniz Dalkara à l’Institut de la vision étudient toujours cette piste avec des approches différentes, et elle pourrait réémerger dans quelques années.

Nous nous sommes alors focalisés sur les cellules ganglionnaires du nerf optique. Bien qu’elles ne soient pas photoréceptrices, elles réagissent naturellement à la lumière car elles possèdent un photopigment qui régule les cycles jour/nuit de l’organisme : la mélanopsine. Ce pigment répond cependant trop lentement pour une stratégie de restauration visuelle. Il a donc fallu trouver quelle protéine exprimer dans ces cellules ganglionnaires, sachant que nous avons dû écarter celles qui demandaient une quantité de lumière qui abîmerait les cellules.
Ed Boyden, professeur au Massachusetts Institute of Technology (États-Unis), modifie des protéines naturelles afin de les sensibiliser à un type de lumière spécifique. Des questions proches de celles qui intéressaient Roger Tsien, prix Nobel de chimie 2008 pour ses travaux sur la protéine fluorescente verte. Alors que nous testions la protéine développée par Roger Tsien, Ed Boyden nous a proposé de tester la protéine Crimson R, qui réagit à une lumière ambrée faiblement énergétique et que nous avons pu adresser efficacement sur la membrane des cellules ganglionnaires. La version naturelle de cette protéine provient d’algues qui s’en servent pour s’orienter grâce à la lumière venant de la surface.
Comment parvenez-vous à stimuler cette protéine ?
J.-A. S. Il nous fallait un projecteur capable d’envoyer cette lumière ambrée dans l’œil. La protéine a non seulement besoin d’une longueur d’onde précise, mais aussi d’une luminosité constante. Or la lumière environnante connaît d’énormes variations de ces deux paramètres. Une équipe de GenSight, travaillant avec l’Institut de la vision3, a donc développé des caméras bio inspirées, qui détectent des changements de lumière, pixel par pixel et à la microseconde près.
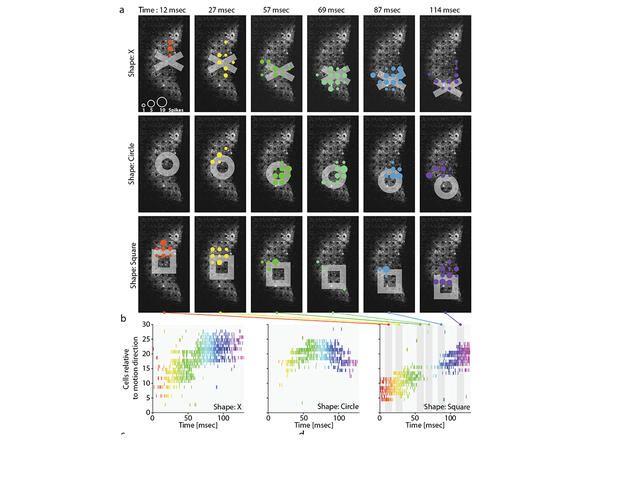

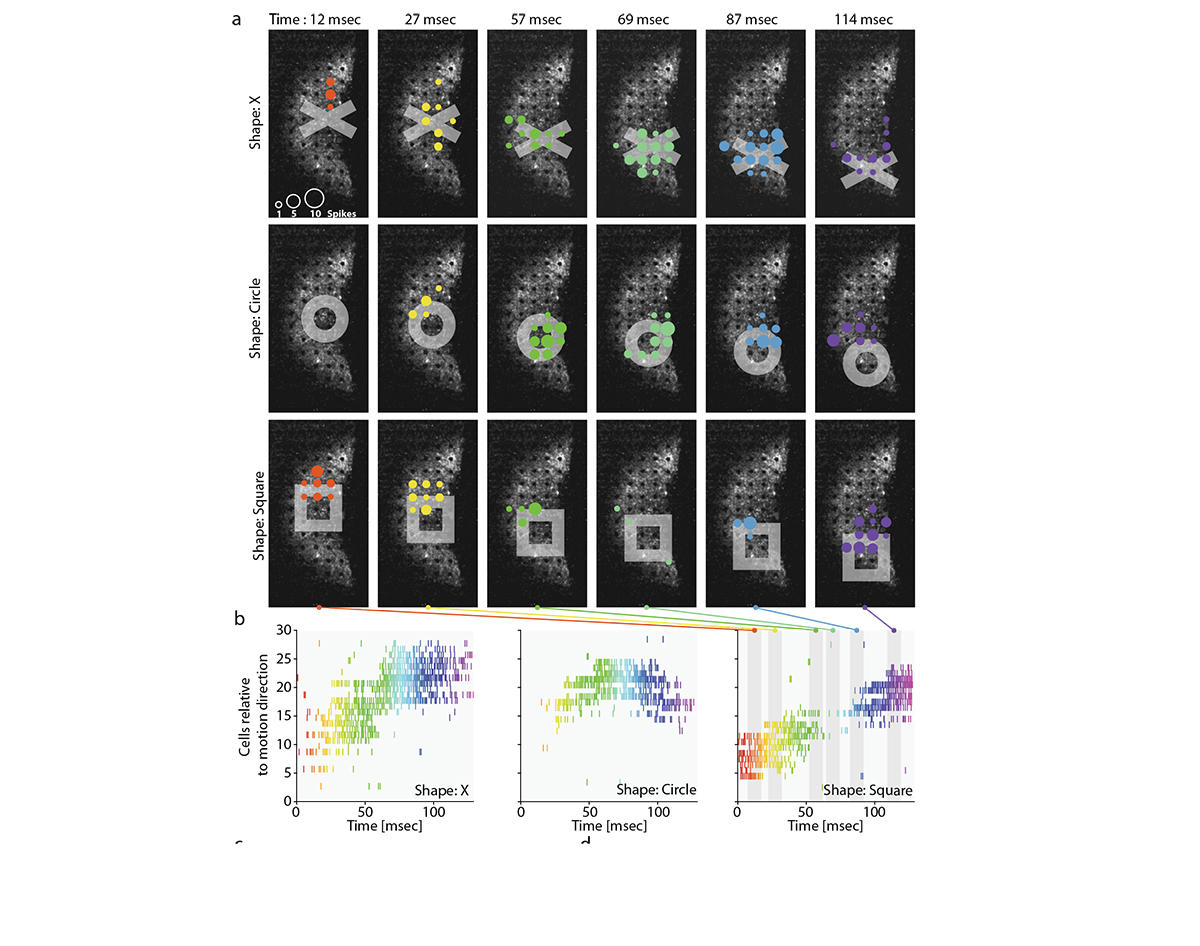
Elles ont été montées sur des lunettes qui codent ce signal, puis le projettent dans l’œil à la bonne longueur d’onde. Comme ce système a coûté très cher à concevoir et que les groupes pharmaceutiques traditionnels sont focalisés sur le versant moléculaire, sans expertise en dispositifs médicaux, nous avons fondé l’entreprise GenSight Biologics, avec Bernard Gilly, Serge Picaud et Botond Roska. Cette start-up a donc aussi bien développé la thérapie génique que le matériel nécessaire à son utilisation.
Une fois ces éléments réunis, comment est-ce que le patient en bénéficie ?
J.-A. S. Au début 2019, nous avons commencé à injecter chez les premiers patients aveugles des vecteurs chargés de transmettre aux cellules ganglionnaires un gène codant la protéine Crimson R. Il s’agissait de virus modifiés pour ne pas être pathogènes, pour pénétrer facilement dans la rétine et transmettre le plus efficacement possible le code génétique de Crimson R. Le patient, dont le traitement est décrit dans notre publication dans Nature Medicine4, a subi l’injection à l’hôpital des Quinze-Vingts de Paris ; il a fallu ensuite attendre plusieurs mois pour que la protéine s’exprime suffisamment pour agir.
Les patients devaient ensuite commencer une rééducation au sein de StreetLab, une plateforme qui reproduit les conditions réelles. Nous pouvons aussi y étudier les mouvements de leur corps et de leurs yeux, après avoir été entraînés à utiliser les lunettes et à effectuer différentes tâches, tout en adaptant le matériel à leurs besoins et à leur confort.
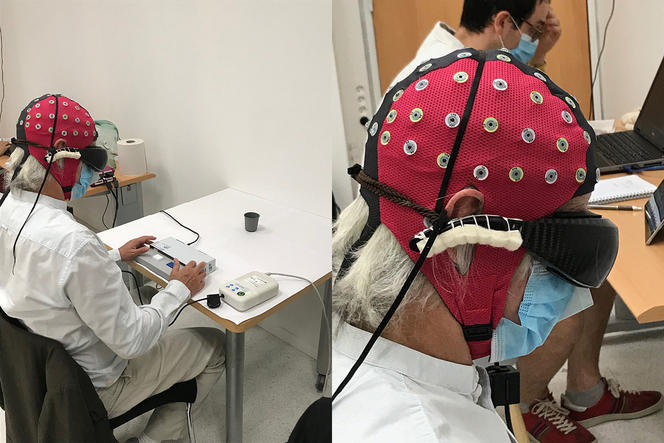

En février 2020, un de nos patients nous a annoncé qu’il avait vu les bandes blanches d’un passage piéton. Il a ensuite été en mesure de repérer, de compter et d’attraper différents objets : un calepin, des agrafes, un verre d’eau… Notre système ne rend pas une vision normale, mais offre une image aux contours vibrants, qui répond à la forme des objets. Nous avons de plus, avec Angelo Arleo de l’Institut de la vision, bien détecté chez ce patient une activation du cortex visuel qui correspond à un décodage visuel correct.
Malheureusement, l’arrivée du Covid a perturbé nos plans et les six autres patients traités à Paris, Londres (Royaume-Uni) et Pittsburgh, n’ont pas pu revenir nous voir assez régulièrement pour être suffisamment stimulés et rééduqués à l’utilisation des lunettes. Sept personnes ont cependant reçu l’injection, qui se fait par groupe de trois par paliers successifs. On augmente progressivement la dose de vecteurs injectés afin de vérifier qu’ils ne posent pas de problèmes. Nous atteindrons à terme la quinzaine de patients traités.
Notre recherche se fait avec les patients et au plus près d’eux. Ils jouent un rôle actif dans nos travaux. Nous tenons à l’idée que, en matière de rééducation, il faut rapprocher les acteurs, les développeurs et les utilisateurs. Nous continuons d’ailleurs à améliorer nos lunettes.
De quel type de cécité souffrent ces patients et est-ce que votre méthode peut s’appliquer à tous les cas de figure ?
J.-A. S. Ils sont tous atteints de rétinopathie pigmentaire au stade terminal. Mais cette maladie peut être causée par plus de soixante-dix gènes différents, dont les défauts convergent vers le même déficit visuel. Les patients ne sont cependant donc pas forcément affectés par le même problème génétique. Nous allons poursuivre et élargir notre étude à d’autres formes de dégénérescence, toutes les maladies de la rétine à l’origine de cécité pourraient potentiellement être traitées grâce à l’optogénétique, à la condition expresse que le nerf optique fonctionne.
Quelles sont les autres maladies que l’optogénétique pourrait aider à soigner ?
J.-A. S. Les applications optogénétiques liées à la vision sont en avance sur les autres, car la stimulation des neurones par la lumière est le mécanisme naturel de l’œil. D’autres domaines sont cependant concernés. Karl Deisseroth, de l’université de Stanford (États-Unis), décrypte les anomalies des circuits neuronaux liées aux maladies psychiatriques, mais il ne parle pas d’essais cliniques.
Tobias Moser, de l’université de Göttingen (Allemagne), œuvre de son côté sur le système auditif et espère démarrer des essais cliniques d’ici à 2025. Une autre équipe allemande souhaite utiliser l’optogénétique pour une stimulation cérébrale profonde, dans l’espoir de traiter des pathologies neurodégénératives telles que la maladie de Parkinson.
Quels sont les autres travaux menés à l’Institut de la vision, que vous dirigez ?
J.-A. S. Beaucoup de nos membres étudient le développement du système visuel et de ses connexions au système nerveux. Nous opérons au sein d’un continuum entre une recherche très fondamentale et des applications thérapeutiques ou de diagnostic. Nous travaillons par exemple sur de l’imagerie cellulaire non invasive, ou sur la protection de la vision centrale. Avec une équipe de Stanford et Pixium Vision, nous avons développé et implanté chez plusieurs patients la première rétine artificielle sans fil au monde. Certains de nos scientifiques explorent les thérapies géniques sans se limiter à l’optogénétique, ou encore l’application de cellules souches progénitrices des photorécepteurs. Enfin, nous disposons d’une plateforme pour étudier les effets du vieillissement, des handicaps visuels et de leur prise en charge sur l’orientation spatiale et la vision. ♦
À lire et à voir sur notre site
Peut-on voir dans le noir ?
L’optogénétique, quand la lumière prend les commandes du cerveau
Un décor de cinéma pour tester le vieillissement (vidéo)
- 1. Fondateur de l’Institut de la vision (CNRS/Sorbonne Université/Inserm), directeur de l’IHU FOReSIGHT, professeur à Sorbonne Université et à l'université de Pittsburgh (États-Unis).
- 2. Unité CNRS/Sorbonne Université/Inserm.
- 3. Avec Francesco Gallupi, Serge Picaud et Ryad Benosman.
- 4. "Partial recovery of visual function in a blind patient after optogenetic therapy", Sahel, J.-A., Boulanger-Scemama, E., Pagot, C. et al., Nat Med (2021). https://doi.org/10.1038/s41591-021-01351-4
Voir aussi
Auteur
Diplômé de l’École supérieure de journalisme de Lille, Martin Koppe a notamment travaillé pour les Dossiers d’archéologie, Science et Vie Junior et La Recherche, ainsi que pour le site Maxisciences.com. Il est également diplômé en histoire de l’art, en archéométrie et en épistémologie.