Vous êtes ici
Voyage au cœur du poumon
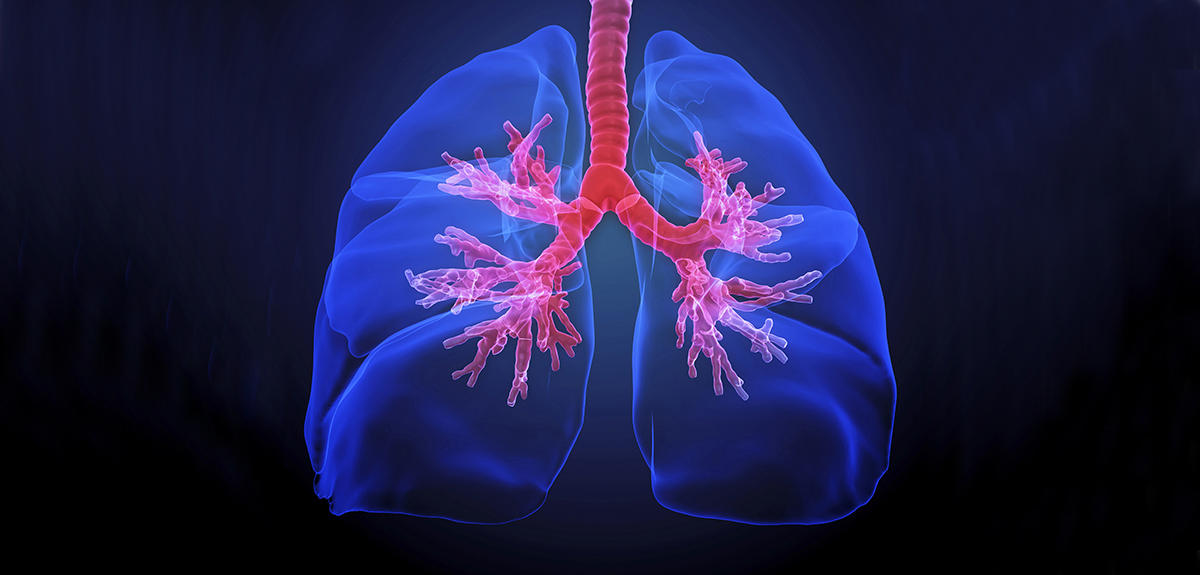
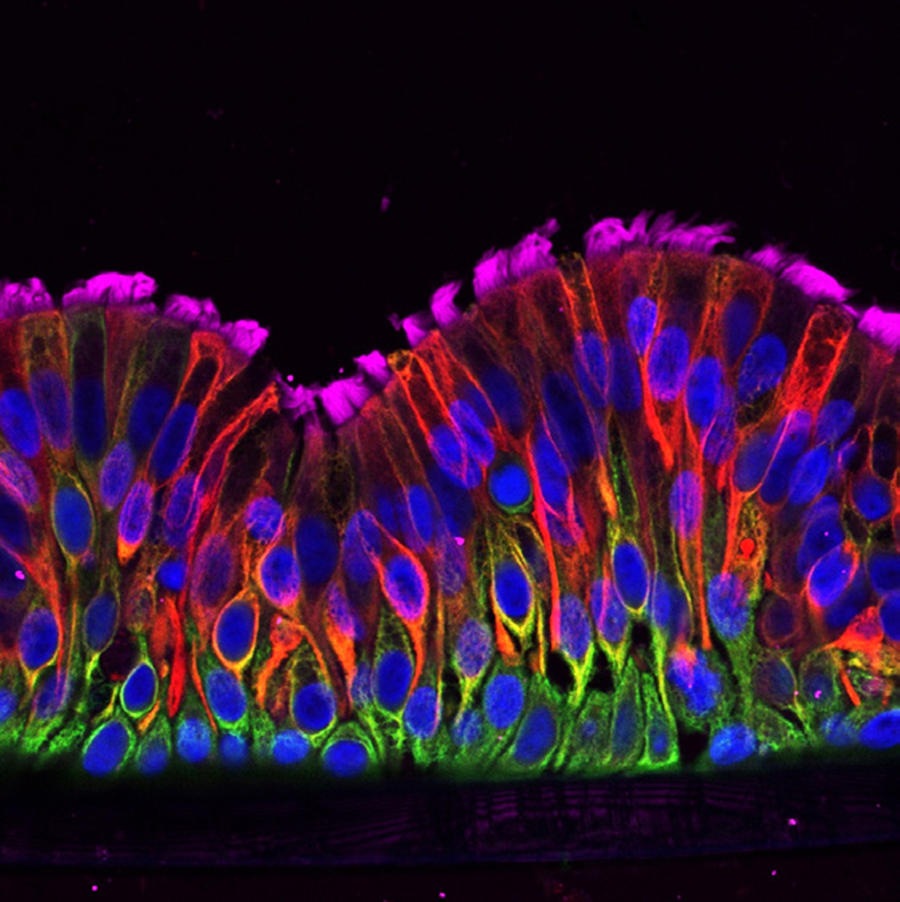
L’appareil respiratoire est ce qui permet d’acheminer l’air que nous respirons jusqu’à notre sang, qui va alors y prélever de l’oxygène et y rejeter du gaz carbonique. Entrant par la bouche ou le nez, cet air passe par le pharynx puis la trachée avant de traverser les voies aériennes de plus en plus étroites qui constituent l’arbre bronchique et aboutir aux alvéoles pulmonaires, où vont se dérouler les échanges gazeux sur une surface grande comme un terrain de football. Depuis le pharynx jusqu’en profondeur dans le poumon, un tissu protecteur tapisse tout l’appareil respiratoire : l’épithélium pulmonaire.
À chaque cellule, sa fonction
Riche en cellules qui s’enchevêtrent, l’épithélium pulmonaire assure une fonction protectrice face à des molécules toxiques, bactéries ou virus. Ainsi, chaque cellule de l’épithélium pulmonaire a sa fonction attitrée. Les cellules basales d’abord, communes à tous les épithéliums du corps humain. S’appuyant sur un assemblage de protéines et de glycoprotéines extracellulaires, les cellules basales sont des cellules progénitrices – c’est à partir d’elles que toutes les autres cellules de l’épithélium sont produites. Viennent ensuite les cellules sécrétrices, qui sécrètent, entre autres, un constituant du mucus pulmonaire : la mucine. « À chaque inhalation, des déchets se déposent sur la surface des voies aériennes : poussières, particules ou microbes. Le mucus constitue un papier tue-mouches sur lequel ils vont pouvoir être attrapés, pour pouvoir ensuite être évacués », précise Pascal Barbry, directeur de recherche CNRS à l’Institut de pharmacologie moléculaire et cellulaire1, à Sophia Antipolis près de Nice.
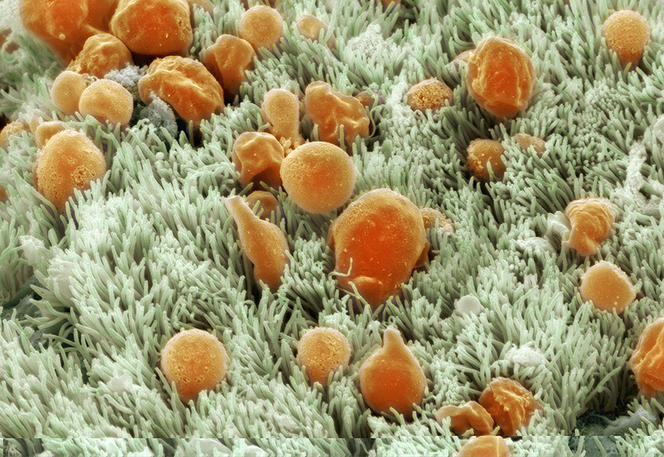

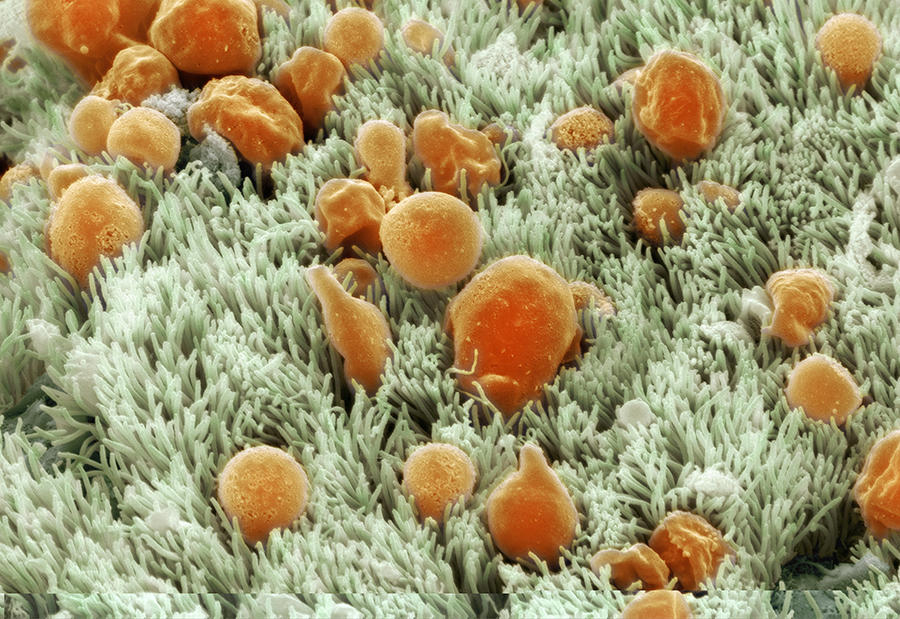
Pour évacuer ce mucus, un autre type de cellules entre en jeu : les cellules multiciliées. Situées à la surface de l’arbre bronchique, elles font battre de façon coordonnée des centaines de cils vibratiles, permettant ainsi « au mucus de flotter comme un radeau sur cette vague de cil pour être expulsé vers les voies digestives, illustre Pascal Barbry. Un système relativement simple, mais extrêmement efficace ! »
Récupérer les informations d’une seule et unique cellule
Pour fonctionner correctement, l’épithélium doit rester intact. Mais chaque agression par des agents inflammatoires ou infectieux peut altérer cette barrière cellulaire. Il lui faut alors se restaurer, et c’est là qu’interviennent les cellules souches progénitrices. Du moins chez la souris ! « De nombreuses études avaient bien détaillé ces mécanismes cellulaires chez la souris, mais jamais de façon aussi détaillée chez l’homme. Nous avons donc voulu confirmer ces pistes chez l’homme, en nous appuyant sur une culture en 3D de cellules épithéliales des voies aériennes, raconte le chercheur. Cette culture reproduisait bien les caractéristiques observées in vivo ».
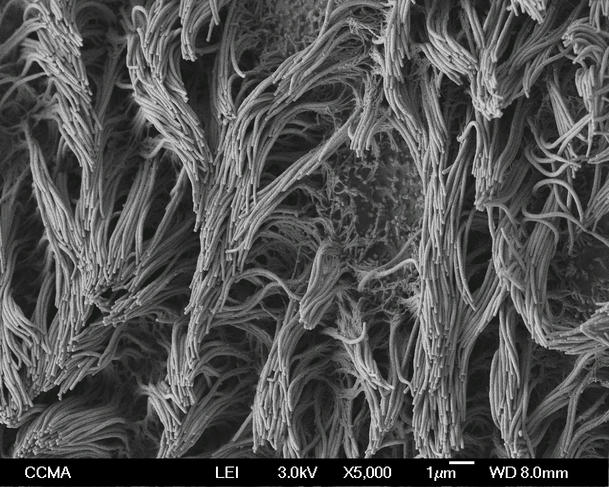
L’objectif ? Dresser une classification la plus complète possible de toutes ces cellules et comprendre comment elles se différencient et se spécialisent au sein de l’épithélium. Pour ce faire, ils ont utilisé une technique de biologie moléculaire innovante : le séquençage de cellule unique. « Ce séquençage permet d’analyser l’expression des gènes au sein d’une seule cellule et de préciser ainsi les différences existant entre plusieurs milliers de cellules analysées en parallèle », indique Pascal Barbry.
Auparavant, les mesures ne pouvaient être réalisées que sur une quantité beaucoup plus importante de matériel génétique que celui d’une seule cellule. L’information génétique de centaines, voire de milliers de cellules différentes était ainsi mélangée, indistinctement, ce qui empêchait de caractériser l’expression propre à chaque cellule individuelle.
De nouveaux types de cellules découverts
Ces nouvelles analyses, confirmant plusieurs résultats obtenus chez la souris, ont permis d’établir une classification extrêmement précise des types cellulaires présents dans les voies aériennes humaines. De la cellule souche à la cellule spécialisée, les chercheurs ont ainsi pu retracer toute l’histoire de l’épithélium, et fournir les signatures moléculaires de chaque étape. Ainsi : « nous avons redécouvert ces cellules basales progénitrices de départ, à partir desquelles se différencient les cellules sécrétrices de mucus et les cellules multiciliées », relate Pascal Barbry.
De nouveaux types cellulaires ont ainsi pu être identifiés. Notamment les cellules deutérosomales, qui correspondent à un stade cellulaire intermédiaire entre la cellule sécrétrice et la cellule multiciliée. « Nous avons pu les identifier grâce à leur expression très spécifique d’ARN. Les cellules deutérosomales jouent un rôle clé dans la différenciation des cellules multiciliées », précise le chercheur. Leur courte existence est consacrée à la fabrication des centaines de cils mobiles, ce qui requiert une expression coordonnée de nombreuses molécules. Certaines maladies rares découlent d’ailleurs d’un dysfonctionnement de la production de cils par ces cellules : on parle alors de ciliopathies ou de dyskinésies ciliaires.
Par ailleurs, un autre type particulier de cellules qui avait été découvert chez la souris, vient d’être identifié chez l’homme : les ionocytes. « Ces cellules rares, qui représentent de l’ordre de 0,1 % de toutes les cellules présentes, ont la particularité d’exprimer de grande quantité de CFTR, le produit du gène de la mucoviscidose », précise Pascal Barbry. Même si CFTR n’est pas exprimé uniquement dans ces cellules, leurs caractéristiques très particulières fournissent de nouvelles hypothèses pour corriger le fonctionnement déficient du CFTR chez les malades.
L’importance des voies de signalisation
C’est la mobilisation de facteurs moléculaires et l’activation de voies de signalisation spécifiques qui permet à des cellules souches à l’origine identiques d’évoluer de manière très différente. Grâce au séquençage sur cellule unique, toutes ces voies moléculaires ont pu être caractérisées, créant une cartographie de signalisation cellulaire. Ensemble, ces données fournissent donc un compte rendu détaillé des voies de signalisation activées pendant la régénération des voies aériennes.
« De nombreuses voies de signalisation jouent un rôle clé dans chaque spécialisation. Par exemple la voie Notch : pour se différencier, les cellules ciliées vont devoir inhiber la voie Notch. Au contraire, elle va être activée au sein des cellules sécrétrices de mucus », détaille Pascal Barbry.
Autres molécules importantes : les kératines. « Nous avons établi un répertoire complet de l’expression des kératines dans chaque cellule. Et nous nous sommes rendu compte qu’un changement de kératine pouvait largement, à lui seul, caractériser les diverses identités cellulaires », ajoute le chercheur. Si ces voies de signalisation peuvent sembler secondaires, elles jouent en réalité un rôle primordial ; elles permettent de mieux comprendre la cause de certaines maladies pulmonaires, mais aussi d’établir des cibles thérapeutiques potentiellement plus pertinentes. En effet, en inhibant pharmacologiquement une voie de signalisation, on peut changer totalement le devenir d’une cellule et l’état du poumon.
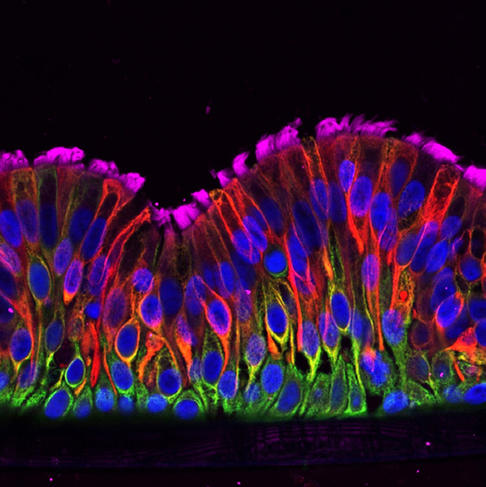
Un modèle pour la recherche médicale
Ces travaux ont donc permis de mieux comprendre comment, chez l’homme, la différenciation des cellules basales de l’épithélium assure la régénération de ce tissu en cas de lésions. Une avancée prometteuse, car dans de nombreuses maladies chroniques respiratoires, une réparation défectueuse entraîne un remodelage des tissus. Par exemple, une réduction du nombre de cellules multiciliées, associée à une augmentation des cellules sécrétrices de mucus, est souvent retrouvée dans des pathologies comme la broncho-pneumopathie obstructive chronique.
Par ailleurs, ces recherches ont fait émerger un modèle complet de cellules pulmonaires, précieux pour la recherche médicale. « Regarder à l’échelle d’une cellule unique comment agit un traitement anticancéreux, c’est avoir l’opportunité d’adapter le traitement quand certains clones résistants viennent à exploser, indique Pascal Barbry, qui souligne : c’est une piste intéressante pour aller vers une médecine personnalisée ». Et comprendre ainsi pourquoi certains patients ne répondent pas à la pharmacopée classique.
L’atlas du corps humain
Ce projet s’intègre également dans le projet « Human Cell Atlas ». Un projet international visant à recenser l’intégralité des profils d’expression des cellules humaines. Dix mille milliards au total. « C’est un projet pharaonique, très interdisciplinaire, qui nécessite la collaboration de biologistes, d’informaticiens, de physiciens. Il y a encore peu de temps, on imaginait qu’il n’y avait que quelques centaines de types cellulaires différents. Or, les premiers résultats montrent qu’il sera sans doute nécessaire de réévaluer ces prévisions à la hausse. Cela va permettre de mieux définir tous les états possibles de la cellule humaine », s’enthousiasme Pascal Barbry. Un rêve rendu possible par le séquençage sur cellule unique.
Le poumon reste un modèle fascinant. « Des pathologies extrêmement graves s’y déclenchent à cause de modifications extrêmement subtiles », insiste le chercheur. En témoigne la mucoviscidose, dont la mutation est causée par la perte d’un seul et unique acide aminé. « Pas étonnant que le poumon apparaisse aujourd’hui comme le tissu pilote du Human Cell Atlas ! » ♦
- 1. Unité CNRS/Université de Nice Sophia-Antipolis.
Voir aussi
Auteur
Léa Galanopoulo est journaliste scientifique indépendante.