Vous êtes ici
Edith Heard, passion épigénétique
Temps de lecture : 13 minutes
« Je n’étais pas le genre d’enfant qui capture des insectes pour les observer dans un bocal. Mais j’étais curieuse de tout, et j’avais soif de tout comprendre jusqu’au bout. » Très tôt, la jeune Edith Heard, née au Royaume-Uni en 1965 d’un père anglais et d’une mère grecque, se révèle passionnée par les sciences, et les mathématiques en particulier. Sa brillante scolarité l’amène tout droit à la prestigieuse université de Cambridge, où elle arrive avec le projet de devenir astrophysicienne. « Ça me semblait naturel à l’époque : j’étais forte en maths et en physique et très intéressée par l’astronomie. »
Mais très vite, Edith Heard troque les astres contre la biologie. Elle y voit l’influence de sa mère : « Elle accueillait régulièrement des Grecs qui venaient se faire soigner à Londres. J’ai donc grandi dans le monde de la maladie à combattre. Et dans une maison toujours ouverte aux autres. » C’est de là que doit venir la générosité que l’on perçoit chez elle, dans son regard bleu clair, dans chacun de ses sourires bienveillants. « Dès que je me suis prise de passion pour la biologie à l’université, j’ai eu envie d’aider à soigner, j’ai même hésité à devenir médecin. Mais ma grande soif de comprendre les choses l'a emporté. Je me suis dit que décrypter le vivant contribuerait à mieux combattre les maladies. »
Des Post-it sur la molécule d'ADN
Ce décryptage, elle l’amorce avec une thèse de doctorat en biochimie à l’Imperial Cancer Research Fund, à Londres. C’est là que, un peu par hasard, elle tombe nez à nez avec l’épigénétique. Afin de caractériser le génome d’une lignée cellulaire cancéreuse, elle a besoin de couper l’ADN avec ce que l’on appelle des enzymes de restriction provenant de bactéries. Problème : certaines de ces enzymes ne fonctionnent pas lorsque les brins d’ADN à couper sont sujets à la méthylation : un changement chimique qui n’est autre que l’une des marques de l’épigénétique. En se documentant pour trouver le moyen d’éliminer cette méthylation, elle découvre tout un pan effervescent et fascinant de la recherche, alors en plein essor.

Un peu comme des Post-it qui seraient positionnés sur la molécule d’ADN, les marques épigénétiques participent à l’expression ou au contraire à la répression des gènes, via des modifications chimiques – comme la méthylation. Mais contrairement aux mutations génétiques, les marques épigénétiques n’altèrent pas la séquence ADN et sont réversibles.
L’épigénome, cette couche d’information complémentaire au génome, se révèle indispensable à la différenciation des cellules et joue un rôle clef dans l’embryogenèse. Chaque cellule portant en elle l’intégralité du code ADN, c’est notamment grâce aux marques épigénétiques qu’elle se spécialise, devenant une cellule de foie, de cœur, ou de muscle... Les marques épigénétiques lui permettent aussi et surtout de mémoriser son état, et de le transmettre aux générations suivantes de cellules. « L’épigénétique est donc une sorte de mémoire cellulaire », résume la chercheuse.
S’il n’a jamais été établi que les modifications épigénétiques se transmettaient des parents aux enfants chez les mammifères – « Imaginez si les individus portaient toutes les marques épigénétiques induites par les événements subis par tous leurs aïeux, ce serait une catastrophe pour le fonctionnement de l’organisme ! » –, certaines marques peuvent en revanche être induites sous l'influence de l’environnement (stress, tabac, pollution…) et se révéler délétères pour la santé des individus, sans pour autant être transmises à leurs descendants.
1990. Sa thèse en poche, Edith Heard embraye avec un postdoctorat à l’Institut Pasteur sur l’un des sujets phares de l’épigénétique : l’inactivation du chromosome X. « Chez les mammifères, alors que les cellules mâles comptent un chromosome X, accompagné d’un Y, celles des femelles comptent quant à elles deux X, rappelle la chercheuse. Or, cette double dose de X est très problématique. Chez les humains, la seule “surdose” de chromosomes qui soit viable, c’est la trisomie 21, où le chromosome 21 est en trois exemplaires au lieu de deux. Mais ce chromosome est petit, alors que l’X est particulièrement grand, il compte 1 000 gènes ! Chez une femelle mammifère, si les deux X s’expriment, l’embryon meurt rapidement. L’évolution a donc trouvé le moyen ingénieux de rendre l’un des deux X silencieux. » Grâce aux fameux Post-it épigénétiques.
Expérience américaine
Avide de tout comprendre jusqu'au bout, comme à son habitude, la jeune chercheuse entend élucider les mystères qui entourent l’inactivation du X. Comment une cellule « sait-elle » qu’elle est femelle ? se demande-t-elle. Comment choisit-elle le X à inactiver et sur lequel poser des Post-it épigénétiques ? Et selon quels mécanismes précis cette mise sous silence se déroule-t-elle ? Recrutée au CNRS à l’issue de son postdoc, elle entreprend, pour répondre aux nombreuses questions qui la taraudent, de décrypter le fonctionnement du centre d’inactivation du X. Un dessein ambitieux qui la pousse à se former à de nouvelles technologies innovantes.

En l’an 2000, elle s’envole au laboratoire Cold Spring Harbor, à Long Island, près de New York, avec son compagnon Vincent Colot – directeur de recherche à l'École normale supérieure, lui-même épigénéticien des plantes –, et leurs deux enfants. « C'est avec lui, aujourd’hui mon mari, que j'ai construit ma carrière, confie-t-elle ; avec lui que je partage les joies et les secrets de l’épigénétique. » Outre-Atlantique, elle apprend, grâce à la microscopie de pointe, à visualiser au sein des cellules les toutes premières étapes de ce processus d’inactivation.
Armée de sa curiosité et de ses nouvelles compétences techniques acquises en Amérique, elle intègre l’Institut Curie en 2001, dès son retour en France. Elle y officiera en tout dix-sept ans, de cheffe d’équipe junior à directrice du Département de biologie du développement et de génétique. « Ça a été la période la plus intéressante de toute ma vie scientifique, confie-t-elle, toujours avec ce français parfait, teinté d’un mélodieux accent britannique. J’y ai fait de la recherche fondamentale, ce qui nourrissait ma passion de comprendre, et en parallèle, mon équipe collaborait étroitement avec des collègues merveilleux ainsi que des médecins de l’hôpital Curie, afin de mieux cerner les changements épigénétiques, surtout au niveau du chromosome X, pouvant être liés au développement de différents types de cancers chez l’humain ».
La chercheuse participe même aux réflexions sur des stratégies thérapeutiques via les « épi-médicaments » qui, basés sur la réversibilité des mécanismes épigénétiques, visent à éliminer les marques anormales. « Mais je ne crois pas à une recherche qui ne serait vouée qu’aux applications médicales, déclare-t-elle. Je suis une fervente défenseuse de la recherche fondamentale, qui permet de faire des bonds en avant dans la connaissance, ces derniers pouvant ensuite donner lieu à des applications. »
Quand la nature « bricole »
Des bonds en avant, elle en a provoqué plus d’un. En 2004, son équipe est ainsi l’une des premières à reconstituer les étapes de l’inactivation du chromosome X chez la souris. La chercheuse et ses collaborateurs, en particulier Ikuhiro Okamoto, un chercheur postdoc qu’elle qualifie d'« extraordinairement talentueux », montrent qu’au stade d’un embryon à 4 cellules, c'est systématiquement le X paternel qui est inactivé, avant d'être réactivé au stade 120 cellules – après quoi l’inactivation se fait sur l’un des deux X (paternel ou maternel), de façon aléatoire1.
« Cette dynamique épigénétique que nous avons mise en lumière n'était pas du tout attendue », raconte-t-elle. Dans la communauté scientifique, elle fait donc grand bruit. Tout comme la percée suivante, quelques années plus tard. Avec le Dr Okamoto et d’autres collaborateurs, elle décortique le même processus chez l’humain et le lapin. Et surprise, pour ces deux espèces, la dynamique est très différente de celle observée chez la souris : les deux X sont d’abord inactivés simultanément, puis l’un est pour ainsi dire « rallumé » tandis que l’autre continue de s’éteindre. « On s’attendait à ce qu’un processus aussi central à la biologie ait été conservé par l’évolution, et soit similaire d’une espèce à l’autre. Mais ce n’est pas le cas. En réalité, la nature fait avec ce qu’elle a “sous la main”, et s’adapte aux nécessités et contraintes développementales de chaque espèce. »


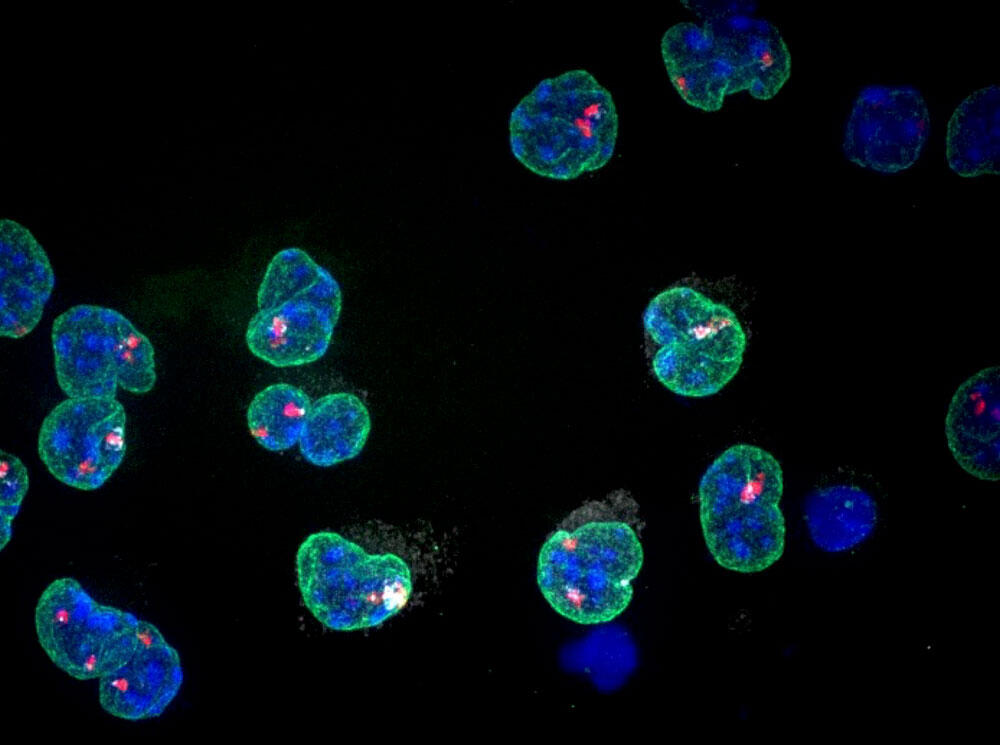
Ce nouveau résultat est publié dans la revue Nature, en 2011. à l’époque, Edith Heard est déjà une chercheuse de renommée internationale, lauréate de nombreuses distinctions, dont la médaille d’argent du CNRS en 2008, l’ERC Advanced Investigator Award du Conseil européen de la recherche en 2010 et le Grand Prix de la Fondation pour la recherche médicale en 2011. En 2012, elle est nommée professeure au Collège de France. La même année, elle publie un article qui fera date. « Avec mon brillant étudiant de l’époque, Elphège Nora, nous voulions comprendre comment démarre le processus d’inactivation, en sachant qu’avant nous, des équipes avaient mis en évidence le rôle prépondérant joué par un gène particulier, appelé Xist2, dans ce processus, raconte la chercheuse. Nous avons collaboré avec le scientifique américain Job Dekker qui avait développé de nouvelles techniques permettant de restituer l’organisation du génome en 3D. Nous avons cherché comment ce gène spécifique était mobilisé, et plus précisément par quelle partie du génome il était commandé. »
Une percée majeure en génétique
Ce faisant, les chercheurs font une découverte inattendue : ils révèlent une architecture du génome jusqu’alors inconnue. Leurs travaux montrent en effet que les chromosomes sont organisés en régions qui dialoguent préférentiellement les unes avec les autres ; que cette structuration est sans doute indispensable au bon fonctionnement du génome et que cette organisation semble être commune à tous les mammifères. Une illustration parfaite de la sérendipité en science : l’art de faire des découvertes « par hasard » en travaillant sur un tout autre sujet…
Après cette découverte fracassante, qui a ouvert plusieurs voies importantes dans la recherche sur le génome, la chercheuse reprend ses enquêtes épigénétiques. Toujours grâce aux techniques de microscopie high-tech apprises outre-Atlantique, elle parvient à visualiser la chorégraphie moléculaire qui mène tout droit à l’inactivation du X : « Le gène Xist produit un ARN (l’ARN ou acide ribonucléique est une molécule, plus simple que ne l’est l’ADN, utilisée dans les cellules comme intermédiaire des gènes pour fabriquer les protéines dont elles ont besoin, NDLR) qui vient littéralement couvrir l’ensemble du chromosome X, comme s’il le décorait. Ceci permet à ce dernier de recruter les marques épigénétiques qui vont non seulement éteindre les gènes, mais aussi leur faire mémoriser cette extinction ».
Profondément européenne
Avant même la publication de cette nouvelle découverte en 2020, la renommée d’Edith Heard dans la communauté des biologistes lui a encore ouvert de nouveaux horizons. En 2019, en effet, elle est nommée directrice générale de l’European Molecular Biology Laboratory (EMBL), à Heidelberg en Allemagne, un organisme intergouvernemental unique en son genre, établi il y a tout juste cinquante ans dans le but de promouvoir la recherche fondamentale en biologie moléculaire et de garder les scientifiques sur le sol européen. Profondément européenne (en plus d’être gréco-britannique, elle est depuis peu française), elle accepte le poste et se voit confier la mission de mettre en place un nouveau programme pluriannuel ambitieux, « Molecules to ecosystems », pour la période 2021-2026.
« Nous, scientifiques, avons tendance à vouloir contrôler au maximum l’environnement dans lequel nous menons nos expériences, afin de ne pas les perturber. Mais dans la réalité, c’est tout l’inverse qui se produit : la vie n’est jamais isolée, elle interagit constamment dans un écosystème, participe à des communautés, en symbiose… L’idée de ce nouveau programme est d’étudier la vie dans son contexte naturel. Dans ce cadre, nous avons notamment mis sur pied une mission nommée Trec3 (Traversing European Coastlines), centrée sur la dynamique des écosystèmes marins et terrestres des côtes européennes. »
Si, pour assurer ses fonctions à l’EMBL, elle avait quitté Paris pour l'Allemagne, où se trouve le siège de l’organisme, elle s’apprête désormais à s’envoler pour une nouvelle destination : Londres, où elle prendra en 2025 la direction du Francis Crick Institute, un prestigieux organisme de biomédecine – tout en poursuivant en parallèle ses recherches et ses cours au Collège de France, ainsi que son engagement pour aider autrui. Depuis 2017, elle est en effet marraine du programme Pause (programme d’accueil en urgence des scientifiques et artistes en exil). Créé en 2017 sous l’égide du Collège de France, il vise à accueillir les chercheurs étrangers en danger dans leur pays et à leur donner les moyens de poursuivre leurs recherches. « Nous recevons sans cesse des demandes, et cherchons les instituts susceptibles de les accueillir », précise la chercheuse, à la curiosité et la générosité intactes. ♦
Consultez aussi
Edith Heard ou la révolution épigénétique
L’épigénétique mène le génome à la baguette
Stéphane Mallat, bâtisseur de ponts mathématiques et informatiques
Voir aussi
Auteur
Journaliste scientifique avec une appétence particulière pour l’astronomie et les reportages de terrain, Émilie Martin est cheffe de rubrique au magazine Ciel & Espace, auteure de documentaires pour la télévision et collabore régulièrement à des projets de muséographie scientifique.