Vous êtes ici
Ce que l'on sait de la douleur

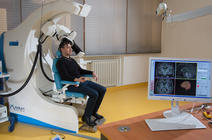
Qu’est-ce que la douleur, à quoi sert-elle et comment la faire taire ? C’est à cette question bien plus complexe qu’il n’y paraît que tentent de répondre les biologistes et les neuroscientifiques, armés des dernières techniques d’exploration : IRM ou magnétoencéphalographie pour voir fonctionner le cerveau, études électrophysiologiques pour suivre la propagation du signal électrique dans le système nerveux... « Les progrès limités faits dans les traitements contre la douleur nous ont conduits à revoir nos approches expérimentales et à aller beaucoup plus loin dans nos connaissances du phénomène », constate Michel Barrot, chercheur en neurosciences à l’Institut des sciences cellulaires intégratives (INCI1).
Une expérience sensorielle ET émotionnelle
La définition de la douleur elle-même a été profondément révisée. Pour l’International association for the study of pain, qui regroupe tous les médecins et chercheurs spécialistes de la douleur, la douleur est décrite comme une « expérience sensorielle ET émotionnelle désagréable en lien avec une lésion tissulaire réelle ou potentielle. » L’organisme, via les fibres qui innervent la totalité de la peau et des organes, envoie un signal électrique au cerveau pour le prévenir qu’une lésion (coupure, brûlure, choc) vient d’avoir lieu ou est imminente. C’est un véritable système d’alarme qui préserve notre intégrité corporelle. « Les gens insensibles à la douleur – c’est une véritable pathologie génétique -, ont une vie courte : sans douleur, on se blesse, on se mutile… » rappelle Jean-Philippe Pin, neuropharmacologiste à l’Institut de génomique fonctionnelle2.
La nouveauté, dans cette approche de la douleur, c’est la composante émotionnelle, longtemps sous-estimée par les scientifiques. « Quand on se coupe le doigt, il n’y a pas de douleur au bout du doigt. L’information électrique remonte jusqu’au cerveau, et c’est le cortex qui interprète ce signal comme étant douloureux, explique Michel Barrot, qui précise : si on n’est pas dans une expérience émotionnellement désagréable, on ne parle pas de douleur mais de nociceptionFermerMécanismes permettant la détection et la transmission des stimulations susceptibles de porter atteinte à l’intégrité de l’organisme. »

Grâce aux recherches menées ces dernières décennies, on connaît bien désormais les circuits de la douleur, c'est-à-dire l’ensemble des mécanismes neuronaux qui capturent et transmettent les stimuli reçus par notre peau et nos organes. A ce jour, on a dénombré une quarantaine de récepteurs et de voies spécialisées : certains sont sensibles au chaud - il en existe qui sont spécifiquement sensibles aux températures supérieures à 47°C -, d’autres au froid, d’autres sont sensibles à la pression mécanique exercée..., d’autres sont plus généralistes et exercent une veille sur le « bruit de fond » du corps. « Dans la vie réelle, lorsque vous mettez la main sur une plaque électrique, plusieurs récepteurs et voies se déclenchent en même temps, ceux qui sont actifs à plus de 40°C, ceux qui se déclenchent à 47°C, ceux qui sont sensibles à la pression exercée lorsque vous avez appuyé la main… », précise Luis Garcia-Larrea, neurophysiologiste à l’hôpital neurologique de Lyon.
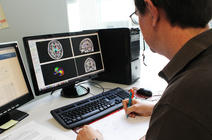
Le signal électrique produit au niveau des récepteurs remonte tout d’abord jusqu’à la moelle épinière, où il est analysé. A ce stade, la moelle épinière peut déclencher une réaction réflexe et provoquer le retrait de la main avant même qu’il y ait une sensation de douleur. On parle alors d’arc réflexe. Deuxième possibilité : le message est encodé par la moelle épinière, qui le transmet au cerveau pour interprétation. « Grâce à l’imagerie cérébrale, on sait aujourd’hui que le message atteint à la fois les zones du cerveau spécifiquement dédiées aux informations sensorielles, et des zones non spécifiques de la douleur que sont les zones de l’attention, les zones de l’émotion responsables de la déplaisance, ou les zones de la mémoire qui cherchent si l’on a déjà été confronté à une douleur identique, explique Luis Garcia-Larrea. Ce sont ces dernières régions qui font accéder le stimulus à notre conscience et en font une véritable expérience. »
Une cartographie cérébrale de la douleur
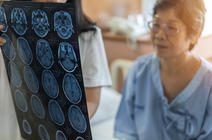
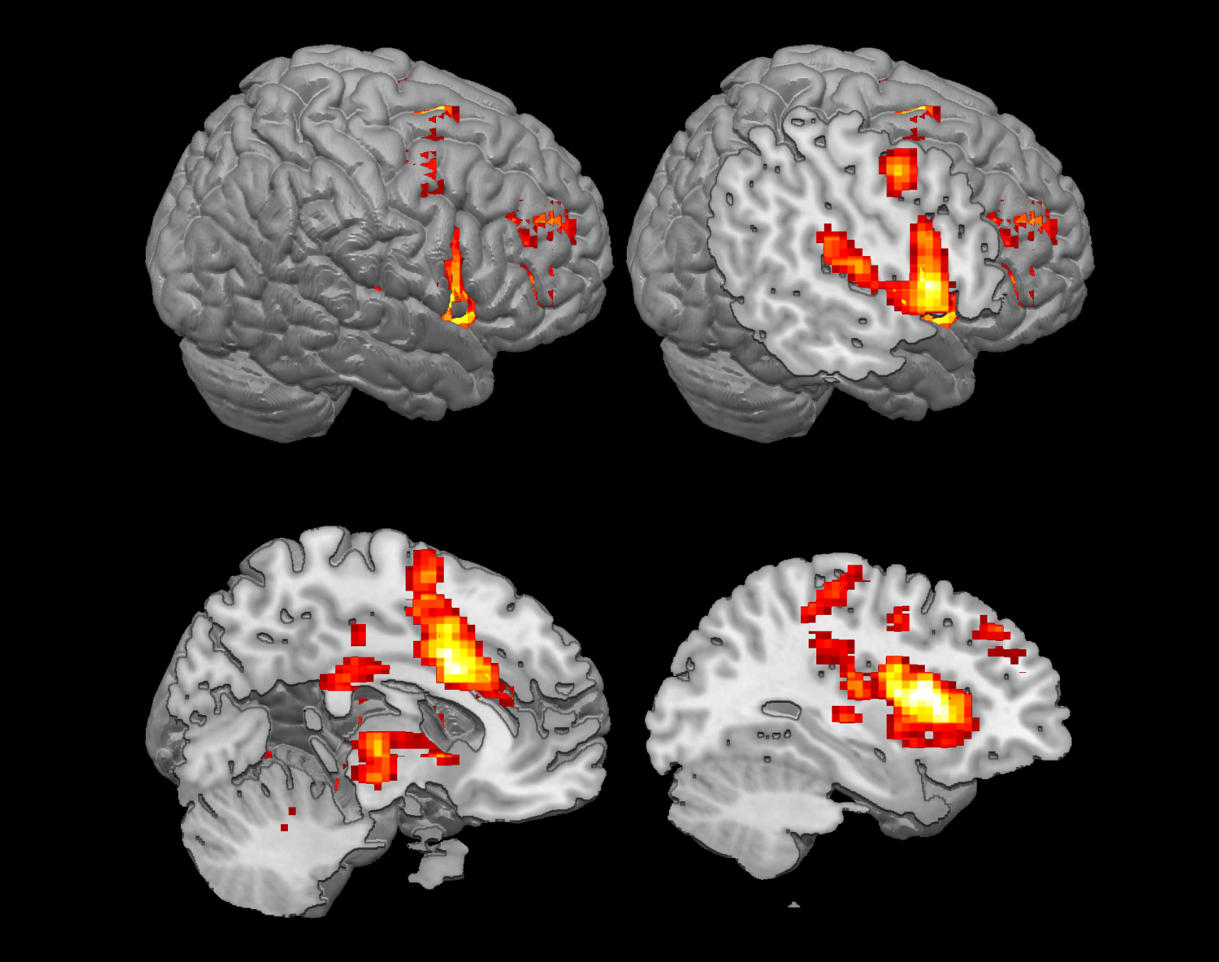
On dispose aujourd’hui d’une véritable cartographie cérébrale de la douleur : « quand on regarde les régions cérébrales actives lors d’un stimulus douloureux, on regarde une « matrice douloureuse » qui comporte environ une quinzaine de régions dans le cerveau, sans que l’on sache encore bien dans quel ordre ces dernières s’allument », détaille Luis Garcia-Larrea. Pour la partie émotionnelle, deux zones corticales sont particulièrement importantes, le cortex cingulaire antérieur et le cortex insulaire antérieur, sans oublier l’amygdale située dans la zone sous-corticale. Une chose est sûre, cependant : si dans le cerveau, les circuits empruntés par le signal douloureux sont séparés, l’expérience ressentie au final par l’individu est bien globale.
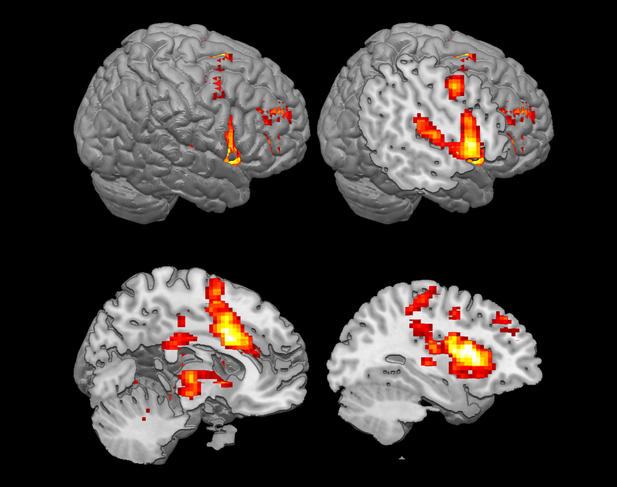
L’imagerie cérébrale ne permet en revanche ni de diagnostiquer la douleur chez un patient, ni de la quantifier. « La douleur est une expérience éminemment subjective, et un même stimulus va être ressenti différemment chez une personne ou l’autre, sans que l’on sache bien si la différence se joue au niveau des circuits de la nociception qui véhiculent le message sensoriel, ou au niveau du cortex cérébral lui-même », indique Michel Barrot. Le seul moyen d’évaluer la douleur à ce jour, c’est de demander au patient de la noter sur une échelle subjective (généralement de 0 à 10), une pratique de plus en plus répandue dans le milieu médical qui n’a pas toujours bien pris en compte la souffrance des patients.
Mais les informations sensorielles ne se contentent pas de remonter de la périphérie vers le cerveau. On sait aujourd’hui que le cerveau lui-même est capable de moduler la façon dont la moelle épinière traite et encode l’information: c’est le contrôle descendant de la douleur. « Un bon exemple de contrôle descendant est celui de la proie blessée qui s’enfuit pour échapper à son prédateur, explique Michel Barrot. Elle n’a pas conscience de la douleur le temps de la fuite, car l’information est pour ainsi dire bloquée par le cerveau qui a alors une seule priorité, la survie de l’animal. Mais dès que le danger immédiat est écarté, la douleur réapparaît. » Le même mécanisme de priorisation s’applique dans le cas de douleurs simultanées, par exemple lorsque l’on a mal au dos et que l’on se blesse la main avec un couteau de cuisine : la deuxième douleur supplante momentanément la première.
Ce contrôle descendant de la douleur s’exerce généralement sous forme électrique, la plus rapide, mais peut aussi emprunter des voies hormonales. Des chercheurs de l’INCI viennent de montrer comment l’ocytocine – l’hormone de l’attachement, aussi responsable des contractions lors de l’accouchement et de l’éjection du lait maternel – parvient à atténuer une sensation douloureuse en agissant à la fois sur les neurones périphériques qui envoient le message au cerveau, et sur la moelle épinière où le signal est codé en intensité. Les chercheurs ont précisément identifié trente neurones situés dans l’hypothalamus, qui coordonnent la libération d’ocytocine dans le sang et la moelle épinière. « L’ocytocine n’est malheureusement pas utilisable en thérapeutique, car elle joue de nombreux autres rôles dans l’organisme, précise Michel Barrot. On sait néanmoins que des médecins qui en ont délivré en péridurale ont réussi à atténuer la douleur d’un patient. »

Si les circuits de la douleur aigüe ont de moins en moins de secrets pour les chercheurs, il n’en est pas de même pour la douleur chronique ou pathologique : la douleur qui n’est pas provoquée par une lésion des tissus, ou qui dure bien après que les lésions tissulaires ont disparu. Il s’agit des neuropathies liées à une lésion du système nerveux lui-même - c’est le cas des douleurs fantômes qui hantent près de 15% des personnes amputées d’un membre, ou encore des neuropathies diabétiques ; des douleurs du côlon irritable ; ou encore des fibromyalgies, ces douleurs musculo-squelettiques généralisées qui touchent principalement les femmes.
Les défis de la douleur chronique
Difficiles à cerner, les mécanismes de la douleur chronique focalisent désormais toute l’attention des chercheurs. « La douleur chronique a une communauté de voies avec la douleur aigue, toutefois on remarque une plus forte mobilisation émotionnelle dans la première », avance Luis Garcia-Larrea. Son rôle même continue d’interroger les scientifiques : à quoi sert-elle, sachant qu’il n’est plus question ici de protéger son organisme contre un danger immédiat ? Sa prise en charge, enfin, reste encore insatisfaisante.
« Certains anti-dépresseurs, mais aussi des anti-épileptiques, sont utilisés depuis les années 1960 et réussissent à soulager 30 à 50% des patients qui souffrent d’une douleur neuropathique », note Michel Barrot. Longtemps mystérieuse, leur action commence à être mieux comprise, notamment grâce aux travaux menés au sein de son laboratoire. « Bien qu’elles soient classées comme anti-dépresseurs, ces molécules - comme la duloxétine ou l’amitriptyline - n’agissent pas que sur le système nerveux central, explique le chercheur. Elles influent également sur les contrôles descendants de la douleur et sur les mécanismes de neuroinflammation qui accompagnent les lésions nerveuses. »

Depuis la fin des années 2000, les médicaments opioïdes jusqu’alors réservés aux douleurs aigües très fortes et aux soins palliatifs, sont de plus en plus prescrits pour la prise en charge des douloureux chroniques. Mais ils ne sont pas sans danger : les molécules comme la morphine, la codéine, le tramadol…, voient leur efficacité diminuer au fil du temps (d’où la tentation d’augmenter les doses), provoquent une forte accoutumance et des effets secondaires tels que nausées, constipation et détresse respiratoire pouvant entraîner la mort. Aux Etats-Unis, où ils sont très prescrits, ces médicaments auraient provoqué 74.000 décès par surdose pour la seule année 2017.
Des alternatives aux opioïdes ?
L’une des piste à l’étude aujourd’hui pour répondre à cette véritable crise des opiacés pourrait être l’utilisation d’« opiacés biaisés ». Une molécule mimant la morphine, mais sans provoquer ses effets négatifs, est ainsi à l’étude aux Etats-Unis. « La morphine est comme une clef qui active deux voies différentes dans la cellule, la voie A anti-douleur et la voie B, à l’origine de l’accoutumance et des effets respiratoires, explique Jean-Philippe Pin. L’idée, c’est de créer une molécule qui ressemble à la morphine, mais à laquelle manque le bout de clef qui active les effets d’accoutumance. »
Les nanomédicaments pourraient également offrir une alternative à la morphine, comme vient de le montrer une équipe de chercheurs français de l'Institut Galien Paris-sud3. En liant un peptide (la leu-enképhaline, habituellement dégradée en quelques minutes dans l’organisme) à un lipide naturel (le squalène), ces scientifiques ont réussi à créer des nanoparticules actives jusqu’à 48 heures, capables de cibler les récepteurs des opiacés et de faire disparaître une douleur liée à une inflammation prolongée chez le rat. Avantage de ce traitement, s'il venait à prouver son efficacité chez l'homme : « contrairement à la morphine, ces nanoparticules sont trop grosses pour passer la barrière hémato-encéphalique et ne pénètrent donc pas le système nerveux central, indique Patrick Couvreur, qui cosigne l'étude. On évite ainsi les phénomènes d'addiction et la détresse respiratoire.»
« Dans le cas de douleurs neuropathiques comme les douleurs des neuropathies diabétiques, des traumatismes des nerfs ou même de membres fantômes, on peut également utiliser des anesthésiques locaux comme la lidocaïne qu’on applique en pâte sur la zone douloureuse », précise Luis Garcia-Larrea. Des préparations à base de capsaïcine, la molécule active du piment, montrent aussi une certaine efficacité. « La douleur du patient paraplégique ou amputé qui dit avoir mal aux jambes provient en réalité du fait que le système nerveux essaie de régénérer les fibres sectionnées sans y arriver, ce qui aboutit à surexciter tout le système, précise le médecin. Or les scientifiques ont découvert que TRVP1, un récepteur périphérique sensible à la chaleur, répondait très bien à la capsaïcine à des concentrations très fortes. » Objectif : surexciter ces récepteurs au point de les inactiver, et offrir un répit de quelques semaines au patient qui souffre.
A l’Institut de génomique fonctionnelle, le chercheur Cyril Goudet se focalise lui sur l’amygdale, cette structure du cerveau qui joue un rôle important dans les réponses au stress et à la douleur. Il a montré chez la souris souffrant de douleur neuropathique - en l’occurrence, une inflammation durable de la patte -, qu’on pouvait supprimer la douleur en agissant sur des récepteurs sensibles au glutamate situés au niveau de l’amygdale. « Le problème des études sur la douleur avec des modèles comme le rat ou la souris, c’est qu’on ne peut pas reproduire les mêmes protocoles chez l’homme pour vérifier nos hypothèses. Par le passé déjà, des traitements efficaces chez la souris se sont révélés sans effet chez l’homme », tempère Jean-Philippe Pin, qui explore également chez la souris la piste des médicaments contrôlés par la lumière : des molécules délivrées au cœur du cerveau qui pourraient être activées par des micro-leds implantées dans le cortex et activées par réseau wifi...

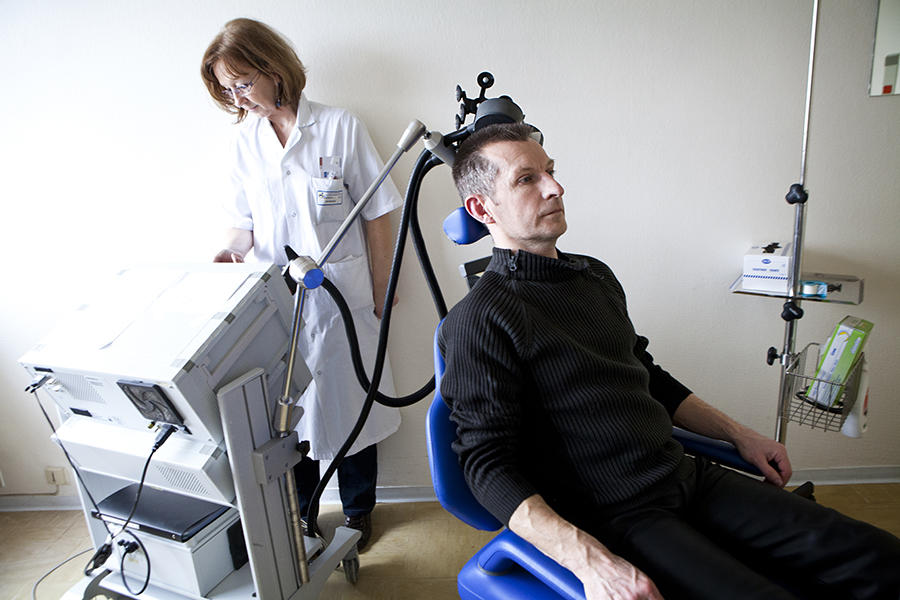
Face aux limites actuelles de la pharmacologie, d’autres pistes se développent pour atténuer le ressenti des douloureux chroniques. C’est le cas de la neuromodulation, qui consiste à modifier l’activité électrique à des endroits précis du système nerveux - soit dans la moelle épinière, soit directement dans le cortex cérébral – et qui soulage environ la moitié des patients douloureux. « On sait aujourd’hui qu’il n’y a pas un, mais plusieurs centres de la douleur dans le cerveau, explique Luis Garcia-Larrea. L’objectif est de modifier l’activité électrique de trois ou quatre régions du cortex qui provoquent la déplaisance .» Soit en y implantant des électrodes – c’est la stimulation neurochirurgicale à effet direct, ou TCDS. Soit au moyen d’une bobine électromagnétique qui stimule l’intérieur du cerveau - c’est la stimulation magnétique transcranienne répétitive, ou RTMS. « Si elle est moins invasive que la stimulation par électrodes, cette dernière est aussi moins puissante car on est plus loin des centres visés », précise Luis Garcia-Larrea.
La piste de l'hypnose et de la méditation
D’autres méthodes moins orthodoxes sont également explorées, qui jouent directement sur le vécu de la douleur : c’est le cas de la méditation et de l’hypnose, aujourd’hui prises très au sérieux par les scientifiques. « L’idée n’est pas de supprimer la cause, mais le ressenti, en jouant sur deux régions particulièrement importantes du cortex, activées lors d’une expérience douloureuse : l’insula et le cortex cingulaire antérieur, explique Rémy Schlichter, professeur de neurosciences à l’université de Strasbourg. Ces régions aident en effet le système nerveux central à décider si un stimulus est important ou pas. » Tout l’objectif des pratiques comme l’hypnose ou la méditation est de brouiller le système pour empêcher qu’une information potentiellement douloureuse arrive à notre conscience.
« Le cerveau ne peut traiter qu’un nombre limité d’informations en parallèle, environ 6 ou 7, précise Rémy Schlichter. La méditation de pleine conscience, en focalisant l’attention sur la respiration, ou telle ou telle partie du corps, modifie l’état cognitif du cerveau. Tout occupé à traiter ces nouvelles informations, il se retrouve incapable d’en traiter d’autres. » L’hypnose suit une autre logique : il s’agit ici de dissocier l’aspect sensoriel (les circuits de la nociception) du ressenti émotionnel, et de réassocier un autre contexte au stimulus, afin d’en changer l’interprétation.
« L’hypnose était considérée comme du charlatanisme jusqu’à récemment par de nombreux médecins, rappelle le scientifique, mais elle a été sauvée par les progrès de l’imagerie médicale. » De plus en plus employée dans la prise en charge des douleurs chroniques, l’hypnose s’invite également au bloc opératoire, où elle peut dans certains cas et chez des personnes particulièrement réceptives aux suggestions hypnotiques, remplacer l’anesthésie générale. C’est le cas, notamment, d’une opération de la thyroïde réalisée à l’hôpital Henri Mondor de Créteil sous hypnose avec une simple anesthésie locale : la patiente, une chanteuse professionnelle, a pu chanter pendant l’opération et ainsi éviter que les cordes vocales ne soient touchées durant l’intervention. Pour autant, les mécanismes physiologiques de l’hypnose sont encore à préciser. « Les régions que l’on voit s’activer ou se désactiver dans le cerveau lors d’une séance d’hypnose ne sont pour la plupart pas spécifiques à l’hypnose », indique Rémy Schlichter, ce qui complique l’étude du phénomène.
Si les pistes d’étude sont nombreuses, la douleur est loin d’avoir livré tous ses secrets.
Partager cet article
Auteur
Laure Cailloce est journaliste scientifique pour CNRS Le journal.

























































Commentaires
Connectez-vous, rejoignez la communauté
du journal CNRS