Vous êtes ici
Dépression, TOC, Parkinson… Des ultrasons pour guérir le cerveau
Impulsion électrique, ultrasons, ondes électromagnétiques… Et si les outils physiques prenaient un jour la place des médicaments neurologiques dans notre trousse à pharmacie ? Depuis la première implantation d’une électrode sur le système nerveux en 1967, les techniques de neuromodulation ont largement évolué. Aujourd’hui, la stimulation cérébrale profonde, qui consiste à implanter une électrode dans le cerveau des malades de Parkinson pour venir stimuler leurs neurones, est devenue un traitement courant en France. Une technique invasive, également expérimentée pour le traitement des troubles obsessionnels compulsifs (TOC) ou des tremblements essentiels, et dont le mode d’action est, pour l’heure, mal connu.
« Cette technique s’améliore, on l’adapte de plus en plus à la tolérance du patient par exemple », nous indique Benoît Larrat, ingénieur-chercheur à NeuroSpin1, qui précise que des travaux sont également menés pour utiliser la stimulation cérébrale profonde « comme une sorte de “reset” dans certaines formes d’épilepsie ».
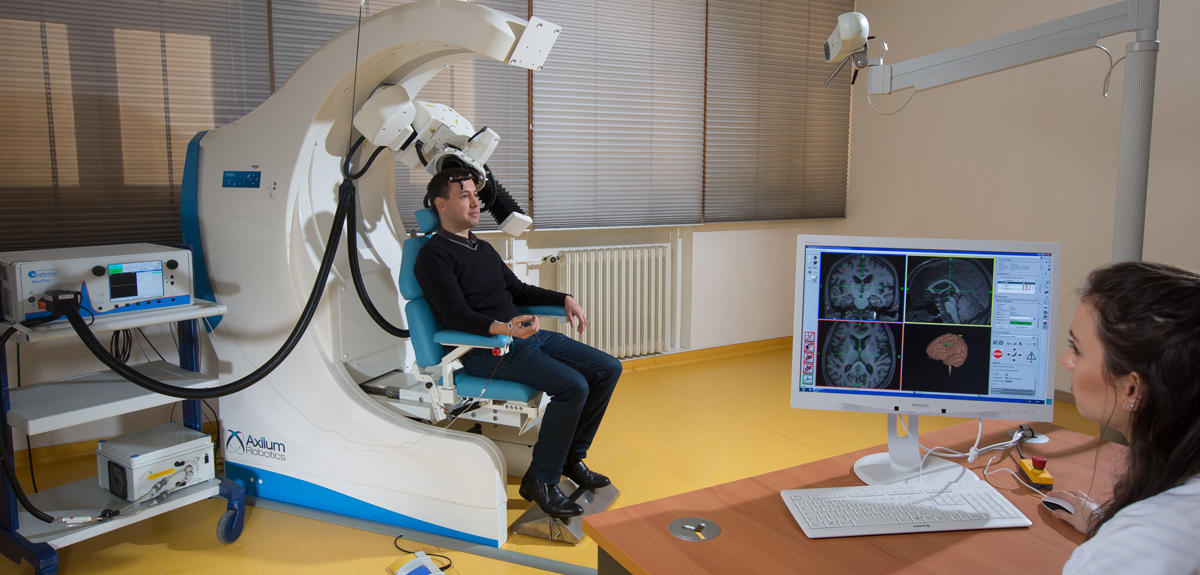
Autre technique de neuromodulation en place actuellement : la stimulation magnétique transcrânienne, ou TMS. Cette fois-ci, ce n’est plus l’électricité qui est utilisée pour modifier l’activité neuronale, mais un puissant champ électromagnétique. Indiquée dans certaines douleurs neuropathiques, TOC ou dépression résistante, la TMS n’est pas invasive. Mais elle pâtit de sa lourdeur ! « Il faut maintenir avec précision une bobine externe sur la tête du patient pendant 45 minutes et l’appareil fait 5 kg », raconte Benoît Larrat. La précision de la TMS reste donc controversée, d’autant plus qu’elle coûte très cher. « De nouveaux systèmes robotisés voient actuellement le jour et devraient améliorer sa reproductibilité », précise le chercheur.
Plus forts que les antidépresseurs ?
Invasive, trop lourde, trop coûteuse… La neuromodulation a de quoi s’améliorer. Depuis une dizaine d’années, l’une des voies de recherche les plus prometteuses est l’application d’ultrasons sur le cerveau. Déjà utilisés dans un but thérapeutique avec la lithotripsie, une technique employée pour la destruction de calculs rénaux, les ultrasons pourraient par exemple traiter les patients dépressifs, résistants à la pharmacopée classique.
« La stimulation du cerveau pour traiter la dépression est une idée qui ne date pas d’hier », raconte Ayache Bouakaz, directeur de recherche Inserm à l’Université de Tours. 30 à 40 % des patients dépressifs ne répondent pas aux antidépresseurs et se retrouvent à court de solutions. S’il est possible dans certains cas de pratiquer l’électroconvulsivothérapie (ECT), une délivrance d’électrochocs, cette technique impose l’anesthésie générale du patient. La TMS, quant à elle, « stimule surtout les zones superficielles du cerveau et non les zones profondes impliquées dans la dépression », complète Ayache Bouakaz, qui a expérimenté avec son équipe la neuromodulation par ultrasons chez la souris.
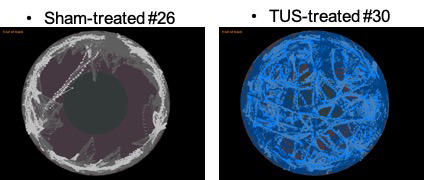
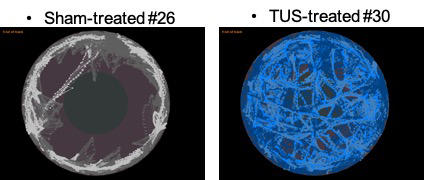
Le protocole est simple : l’équipe compare deux groupes de souris, l’un sous fluoxétine, un antidépresseur, l’autre bénéficiant d’une délivrance d’ultrasons transcrâniens. Les deux groupes sont stressés puis les chercheurs comparent leurs comportements. « Un critère est particulièrement probant : le test de construction du nid. Les souris traitées par ultrasons construisaient plus vite et mieux leur nid que celles sous fluoxétine, détaille Ayache Bouakaz. Par ailleurs les ultrasons baissent de manière significative l’anxiété des souris. » Si ces travaux sur la dépression n’en sont qu’à leurs débuts, l’objectif serait ensuite de miniaturiser le dispositif pour le rendre portatif et disponible en médecine de ville. Mais aussi de comprendre comment ces ondes peuvent agir sur la maladie psychiatrique. Pour l’instant aucune piste n’est exclue, « mais on remarque que ce ne sont pas les mêmes zones du cerveau qui sont activées avec les antidépresseurs ou avec les ultrasons », renchérit Ayache Bouakaz.
Quelle fréquence utiliser ?
« Une onde ultrasonore est une vibration mécanique qui nécessite un milieu de propagation. Pour créer des ultrasons, il faut un système piézoélectriqueFermerProduction d’électricité à partir d’une contrainte mécanique. qui va transformer l’électricité en onde mécanique via un transducteur », nous explique Lori Bridal, directrice de recherche au Laboratoire d’Imagerie Biomédicale de l’Université Pierre et Marie Curie2. Et depuis l’invention de l’échographie, « l’utilisation d’ultrasons en médecine est de plus en plus sophistiquée et sensible », précise-t-elle. Reste que la résolution spatiale des ultrasons utilisés en neurologie n’est pas encore satisfaisante, les zones ciblées ne sont pas assez focalisées. « Cela dépend des fréquences utilisées, à basse fréquence la tache focale est moins précise qu’à haute fréquence », explique Lori Bridal.
Les paramètres d’application des ultrasons à la neuromodulation restent donc encore à calibrer précisément, en fonction des pathologies notamment. Mais tous s’orientent en neuromodulation vers des utilisations à basse fréquence. « Par exemple pour une échographie on utilise du 2 mégahertz, et pour le traitement de la dépression nous avons testé du 0,5 mégahertz », illustre Ayache Bouakaz. Pour agir, les ultrasons doivent passer une barrière ardue : le crâne, qui va distordre l’onde ultrasonore. « Les basses fréquences passent mieux l’os du crâne, mais sont moins précises. Elles ciblent une zone plus large, centimétrique et non millimétrique », indique Benoît Larrat. Les basses fréquences peuvent aussi plus facilement induire des effets mécaniques potentiellement délétères pour les tissus cérébraux tels que la cavitationFermerDans un liquide soumis à une forte dépression, de petites bulles de vapeur ou de gaz peuvent se former, qui oscillent et implosent rapidement.. A contrario, les hautes fréquences ultrasonores sont absorbées plus fortement et peuvent créer des lésions thermiques.
Le crâne : une barrière infranchissable ?
L’enjeu est donc de développer des techniques capables de franchir la boîte crânienne sans ambages, même à hautes fréquences. C’est tout l’objet des travaux de Jean-François Aubry, directeur de recherche CNRS au laboratoire Physique pour la médecine3, et président de la Société internationale de thérapie par ultrasons jusqu’en 2018. « Notre objectif a été d’anticiper la déformation de l’onde lors du passage de la boîte crânienne, à partir d’un scanner X de l’os, pour compenser ensuite cette déformation », précise Jean-François Aubry.
Pour réussir cette prouesse, l’équipe a récemment développé une lentille acoustique. Cette lentille, par laquelle passent les ultrasons, est positionnée à l’avant d’un unique transducteur courbe. La lentille va moduler la trajectoire de l’onde et la faire varier en fonction des irrégularités du crâne. « Cette technique est tout à fait adaptée pour la neuromodulation ! », s’enthousiasme le chercheur. La lentille acoustique donne de réels espoirs. Testée sur crâne humain sec, elle a montré une résolution millimétrique4. « À terme, l’objectif est de pouvoir cibler n’importe quelle zone du cerveau », ajoute Jean-François Aubry.
L’équipe développe actuellement un système de neuromodulation ultrasonore compact et mobile. La technologie sera testée prochainement sur des patients dépressifs à l’hôpital Sainte-Anne. Reste à savoir si l’effet des ultrasons dans le cerveau est pérenne. « Nous visons un effet similaire à la TMS : on envisage de stimuler le patient pendant quelques minutes, toutes les semaines, puis moins souvent, pour finalement forcer le cerveau à se remodeler tout seul, sans stimulation externe », espère Jean-François Aubry. « Nous avons d’ailleurs franchi cette année une étape majeure en induisant chez des singes une modulation de l’activité cérébrale pendant plusieurs heures, grâce à une stimulation ultrasonore de 20 secondes seulement », ajoute-t-il. Une modulation d’activité cérébrale contrôlée par imagerie5.
Guider grâce à l'imagerie
Où placer correctement le transducteur ultrasonore pour obtenir l’effet escompté ? Le guidage de la neuromodulation peut être ardu, d’autant plus que l’émetteur acoustique n’est pas compatible a priori avec l'imagerie à résonance magnétique (IRM). Benoît Larrat et son équipe travaillent donc à l’élaboration « d’un transducteur dépourvu de tout métal ferreux, compatible avec l’imagerie médicale ».
Pour l’heure, cette technique de ciblage par IRM est extrêmement chère, « plusieurs millions d’euros chez l’homme, alors que l’objectif c’est d’avoir un dispositif accessible, notamment pour traiter des maladies aussi courantes que la dépression », souligne Benoît Larrat. Cependant, elle pourra permettre de servir les connaissances théoriques sur l’action des ultrasons dans le cerveau, en localisant par exemple les zones actives pendant la délivrance des ondes, car « nous ne savons pas encore précisément ce qu’il se passe quand on perturbe le cerveau avec des ultrasons », affirme Benoît Larrat.
Restaurer l’audition
Non invasifs contrairement aux stimulations électriques, plus focalisés et plus profonds que la TMS… les ultrasons semblent dépasser les limites de la neuromodulation actuelle. Cela pourrait être également le cas dans le domaine de l’audition, sur lequel planche Olivier Macherey et Émilie Franceschini, chargés de recherche au Laboratoire de mécanique et d’acoustique6 de l’Université Aix-Marseille. Leur objectif est de perfectionner, grâce aux ultrasons, les implants cochléaires utilisés chez les personnes malentendantes. « L’implant cochléaire actuel fonctionne en stimulant électriquement les neurones auditifs primaires situés dans la cochlée », explique Olivier Macherey. Chaque endroit de la cochlée code pour une fréquence particulière. Il est ainsi possible, en implantant plusieurs électrodes, de recruter des groupes de neurones codant pour chacune de ces fréquences. « Sauf que la précision n’est pas parfaite, car la cochlée est remplie d’un liquide physiologique conducteur entraînant une large diffusion du courant électrique », détaille le chercheur. Résultat : l’implant manque de résolution.
Après avoir tenté de pousser à son maximum la stimulation électrique, l’équipe s’est tournée vers une autre solution. « Nous sommes en train de tester la stimulation par ultrasons. Pour l’instant, nous avons montré qu’il était facile d’obtenir des réponses chez l’animal "normo-entendant" et nous nous penchons actuellement sur l’animal atteint de surdité, indique Oliver Macherey. En collaboration avec l'équipe d'Aziz Moqrich, de l'Institut de biologie du développement de Marseille7, nous avons également débuté une expérience de stimulation de neurones sensoriels isolés et avons montré par imagerie calcique que certains de ces neurones étaient sensibles aux ultrasons. Le fait que ces neurones présentent des similarités avec les neurones auditifs nous encourage à poursuivre nos investigations. »
Pour l’heure expérimentés sur le cochon d’Inde, ces travaux devront être poursuivis pour comprendre l’action des ultrasons sur ces neurones auditifs et envisager une application chez l’homme. « Il faudrait pour cela miniaturiser le transducteur pour qu’il puisse s’intégrer à la cochlée humaine », soulève le chercheur.
Quelle action sur les neurones ?
Rien n’est moins sûr et plusieurs hypothèses ont été explorées. L’une d’entre elles semble des plus probables : « les ultrasons pourraient exercer une force de radiation acoustique qui viendrait étirer ou déformer la membrane des neurones, entraînant l’ouverture ou la fermeture de canaux ioniques mécanosensibles, qui vont eux-mêmes dépolariser la membrane et engendrer des potentiels d’action. La neurostimulation ultrasonore serait donc principalement causée par des effets mécaniques via la force de radiation », résume Olivier Macherey.
L’hypothèse s’est renforcée grâce à des travaux de l’Université de Stanford sur le ver Caenorhabditis elegan. Ils montrent que les vers génétiquement modifiés pour être dépourvus de canaux mécanosensibles n’étaient pas sensibles aux stimuli ultrasonores.
Stimulation électrique versus ultrasons
Malgré les promesses de la neuromodulation ultrasonore, des systèmes utilisables en clinique restent seulement en cours d’élaboration. Évidemment, les normes de sécurité des dispositifs médicaux doivent être respectées, même si « les premières données animales sont rassurantes : les analyses anatomopathologiques n’ont montré aucune lésion8 », rassure Jean-François Aubry.
A l'avenir, les travaux devront également s’atteler à comprendre le rôle précis des ultrasons sur le cerveau. Pour Olivier Macherey, ils sont encore loin de remplacer la stimulation électrique en neuromodulation : « visiblement utiliser des ultrasons reste plus compliqué, il faudra réussir à être beaucoup plus précis ». Lluis Mir, directeur de recherche CNRS au Laboratoire de vectorologie et thérapeutiques anticancéreuses9 de l’Institut Gustave Roussy, renchérit pour sa part : « l’avantage de l’électricité c’est que l’on sait, d’une électrode à une autre, où elle sort et où elle rentre. L’ultrason va rentrer puis se distribuer de manière incertaine. L’électricité permet d’anticiper davantage ». Une chose est sûre : les scientifiques tiennent des pistes sérieuses pour améliorer un jour le quotidien de très nombreux patients. ♦
______________________________________________________
Booster l'efficacité de certains médicaments
La neuromodulation peut également potentialiser l’effet de certains médicaments sur le cerveau, « justement parce que la stimulation électrique permet de rendre les cellules perméables à des molécules auxquelles elles étaient alors imperméables », nous apprend Lluis Mir. C’est le principe de l’électrochimiothérapie, qu’il a développée avec son équipe. « Nous nous sommes rendu compte qu’une vieille molécule anticancéreuse, la bléomycine, était très peu active sur les tumeurs, mais n’entraînait pas d’effet indésirable. En réalité, ce n’est pas qu’elle était inactive, c’est que la molécule ne pouvait pas passer la membrane cellulaire ! »
Grâce à l’électroporation, des impulsions électriques qui augmentent la perméabilité de la membrane, son efficacité anticancéreuse a été multipliée. « Environ 4 000 patients sont déjà traités en Europe avec cette électrochimiothérapie, et en moyenne, plus de 70 % des nodules tumoraux traités disparaissent après un seul traitement », se réjouit Lluis Mir, dont les travaux font référence dans le monde entier. Si cette technique est aujourd’hui surtout utilisée pour des cancers gastriques ou cutanés, des travaux sont en cours pour appliquer l’électroporation au traitement de tumeurs cérébrales. « Il faudrait ainsi placer des électrodes dans le cerveau, par trépanation, en les guidant par IRM », précise Lluis Mir. Cette technique donne des résultats prometteurs sur le rat.
- 1. Centre de recherche pour l'innovation en imagerie cérébrale. Il dépend du Commissariat à l'énergie atomique et aux énergies alternatives.
- 2. Unité CNRS/Sorbonne Université/Inserm.
- 3. Unité CNRS/ESPCI Paris/Inserm/PSL.
- 4. « 3D-printed adaptive acoustic lens as a disruptive technology for transcranial ultrasound therapy using single-element transducers », G. Maimbourg, A. Houdouin, T. Deffieux et al., Physics in Medicine & Biology, janvier 2018.
- 5. « Offline impact of transcranial focused ultrasound on cortical activation in primates », L. Verhagen, C. Gallea, D. Folloni et al., eLife, février 2019.
- 6. Unité CNRS/Aix-Marseille Université/École Centrale Marseille.
- 7. Unité CNRS/Aix-Marseille Université.
- 8. « Offline impact of transcranial focused ultrasound on cortical activation in primates », op. cit., 2019.
- 9. Unité CNRS/Université Paris-Sud/Institut Gustave-Roussy.
Voir aussi
Auteur
Léa Galanopoulo est journaliste scientifique indépendante.